氯沙坦对慢性不可预知温和应激模型大鼠的抗抑郁作用
田桂芹 张静 祝幸 陈友 王长水
抑郁症是一种常见的精神性疾病,具有高发病率、低治愈率、高致残率及高自杀率的特点,严重危害了人们的身心健康,给家庭和社会带来了沉重的负担[1-2]。抑郁症是由遗传因素和生存环境共同导致的,但是其具体的发病机制目前还不清楚。应激是抑郁症发病的一个诱因,在长期的慢性应激下,下丘脑-垂体-肾上腺轴和糖皮质激素受体功能异常,促进糖皮质激素释放增多,进而对神经细胞产生毒性作用。抑郁症的发病还与脑内的多种神经递质有关,如5-羟色胺、多巴胺等[3]。有文献报道,脑中的肾素-血管紧张素系统(renin-angiotensin-system,RAS)与抑郁症的发病和治疗有关[4-5]。RAS 因其在高血压、冠心病等心血管疾病中的调节作用而被认知,并广泛存在于多种组织中,主要包括血管紧张素转化酶(angiotensin converting enzyme,ACE)和血管紧张 素Ⅱ(angiotensinⅡ,AngⅡ)及其1 型受体(AngⅡtype 1 receptor,AT1R)[6]。AngⅡ是RAS 中的活性介质,在ACE 的作用下由血管紧张素Ⅰ(AngⅠ)转化而来,并与AT1R 结合,进而引起一系列的炎症反应、氧化应激反应、细胞凋亡等。研究表明,在神经系统中,阻滞AT1R 可以起到神经保护和改善认知功能的作用。氯沙坦(losartan,Los)作为AT1R 阻滞剂常用于治疗高血压和心力衰竭,通过阻断血管紧张素与受体结合发挥作用。然而,Los 能否起到抗抑郁的作用及其可能的作用机制还需要进一步研究。因此,本研究拟通过建立慢性不可预知温和应激(chronic unpredicted mild stress,CUMS)大鼠抑郁模型,探究Los 对大鼠抑郁样行为的改善作用及潜在的抗抑郁机制,为抗抑郁治疗新靶点提供参考。
材料与方法
一、实验动物
实验选用健康的清洁级雄性SD 大鼠,共24只,体质量约200~230 g,由济宁医学院动物实验中心提供。动物实验室内维持环境温度24℃±2℃,空气湿度为50%±5%,明/暗周期为12/12 h。实验前大鼠适应性喂养1 周。实验期间除对大鼠进行禁食禁水的应激外,大鼠均可自由进食进水。
二、主要试剂及用品
Los(上海麦克林生化科技有限公司);大鼠AngⅡ酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒(济南淼济生物科技有限公司);TRIzol试剂、SYBR Green、反转录试剂盒[天根生化科技(北京)有限公司];超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonyldialdehyde,MDA)试剂盒(南京建成生物工程研究所);引物由青岛擎科梓熙生物技术有限公司合成。
三、实验方法
1.动物及分组:将24 只大鼠随机分成4 组,分别为对照组(Control)、Los 组、抑郁组(CUMS)、抑郁+氯沙坦组(CUMS+Los),每组6 只。在整个过程中,Los 组、CUMS+Los 组每天灌10 mg/kg 的Los 溶液,Control 组和CUMS 组每日用等体积的生理盐水灌胃,各组均连续给药8 周。给药的同时CUMS 组和CUMS+Los 组给予应激刺激。整个实验过程中每天监测大鼠的体质量,根据体质量来随时调整用药的计量。
2.大鼠慢性应激抑郁模型的制备:使用文献[7]的应激方法并略加改进,主要包括:(1)食物剥夺24 h、禁水24 h 后用空瓶子应激;(2)冰水强迫游泳5 min;(3)用钳子夹尾根1 min,夹尾时力度以大鼠出现第1 声哀嚎为准;(4)用水弄湿垫料并群居24 h;鼠笼倾斜45℃;(5)昼夜颠倒。不同的应激方式随机安排,每种应激至少出现3 次,整个过程持续8 周。
3.大鼠慢性应激抑郁模型行为学检测:(1)糖水偏好实验:在隔噪音的房间内,对大鼠进行单独饲养48 h,并在笼具两边给予2 瓶1%的糖水。随后对大鼠进行禁水14 h,同时在笼子的两侧分别放一瓶1%的糖水,一瓶清水,预先测量质量,1 h 后取走记录液体量并计算其糖水偏好度。糖水偏好度=糖水消耗量/(糖水总量+清水总量)×100%;(2)强迫游泳实验:将每只大鼠放于高45 cm、直径25 cm 有机玻璃桶内,桶内装有约35 cm 高的温水,温度约24℃,时间为10 min,然后将大鼠干燥并移至笼中。24 h后,将大鼠再次置于圆筒中,进行5 min 游泳测试并录像。以大鼠在水中停止挣扎、漂浮在水中维持静止状态或仅作微小的移动以使头部保持在水上作为不动时间;(3)高架十字迷宫实验:高架十字迷宫装置是一个十字形的有机玻璃平台,具有2 个相对的开放臂(50 cm×10 cm)和2 个相对的封闭臂(50 cm×10 cm×40 cm),通过开阔的中央平台连接(10 cm×10 cm),进行实验时,将迷宫放置在高于地面50 cm处,并且在昏暗的房间中进行;将动物放置在设备的中央,使其头部朝向开放臂;用安装在设备上方的摄像机记录5 min 内进入开放臂和和封闭臂的总次数,以及在每个臂的滞留时间。为了提高大鼠进入开放臂总次数,避免大鼠总是躲在封闭臂中,在测试前先将大鼠放在开阔场地中适应5 min 后再放入迷宫。每只大鼠观测结束后,将实验动物放回饲养笼具内,并用75%的酒精擦拭迷宫,待酒精挥发完全后,可进行下1 只大鼠的观察测试。
4.大鼠海马组织SOD 活性及MDA 含量测定:在最后一次行为学检测结束后,腹腔注射1%戊巴比妥钠对大鼠进行麻醉(50 mg/kg),麻醉后断头取脑,小心剥除两侧脑膜,轻轻用镊子在冰上迅速分离海马组织。取海马组织匀浆,4℃下以3000 r/min,离心半径为8 cm,离心15 min,取上清液,按照SOD、MDA 试剂盒说明书检测SOD 活性和MDA 含量。
5.Ang Ⅱ分析:取海马组织匀浆,并在4℃下以10 000 r/min,离心半径为8 cm,离心20 min,取上清液,用ELISA 试剂盒检测Ang Ⅱ的含量。
6.荧光定量PCR 分析:按照厂家的使用说明书,TRIzol 法提取海马组织总RNA,随后进行反转录,采用SYBR Green 法分别对海马组织中炎性因子白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的表达水平进行荧光定量PCR 检测,同时对海马中的AT1R 的表达水平进行荧光定量PCR 检测。每个cDNA 进行3 次重复测试。扩增条件为:95℃预变性10 min;95℃15 s,60℃1 min,40 个扩增循环。以肌动蛋白(β-actin)作为内参基因,基因特异性引物见表1。
四、统计学分析
使用SPSS23.0 软件进行统计学分析,计量资料以均数±标准差(Mean±SD)表示,满足正态分布与方差齐性的情况下采用单因素方差分析,两两比较采用LSD-t 检验。以P<0.05 为差异有统计学意义。
结果
一、Los 对大鼠行为学的影响
与Control 组相比,Los 组和CUMS+Los 组体质量的增加差异无统计学意义(P>0.05),CUMS 组体质量增加显著性降低,差异具有统计学意义(P<0.05);CUMS+Los 组体质量的增加较CUMS 组差异无统计学意义(图1A)。与Control 组相比,Los 组的糖水消耗量差异无统计学意义(P>0.05),而CUMS组对糖水偏好度显著降低,差异具有统计学意义(P<0.05);CUMS+Los 组大鼠对糖水的偏好程度较CUMS 组增加,差异具有统计学意义(P<0.05)(图1B)。与Control 组相比较,Los 组大鼠强迫游泳不动时间无明显变化,差异无统计学意义(P>0.05),CUMS 组不动时间显著延长,差异具有统计学意义(P<0.05);CUMS+Los 组不动时间较CUMS 组显著性降低,差异具有统计学意义(P<0.05)(图1C)。与Control 组相比,Los 组在开放臂的时间和进入开放臂的次数以及比率差异无统计学意义(P>0.05),CUMS组在开放臂的时间和进入开放臂的次数以及比率显著减少,差异具有统计学意义(P <0.05);CUMS+Los 组在开放臂的时间和进入开放臂的次数及比率较CUMS 组显著性上升,差异具有统计学意义(P<0.05)(图1D~F)。
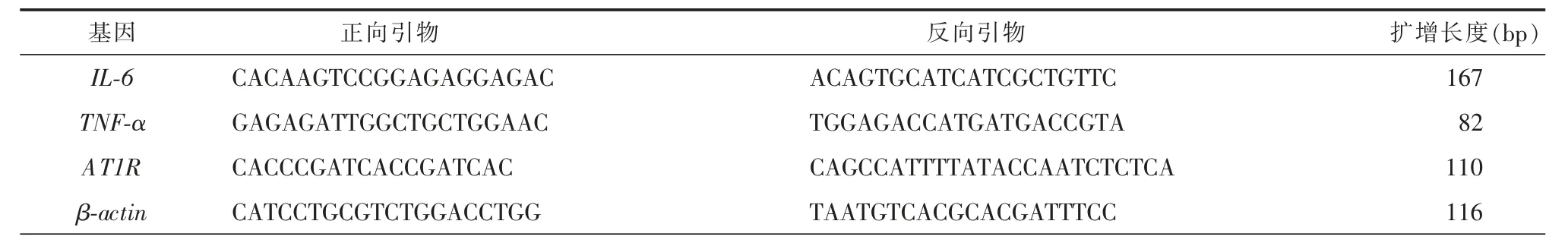
表1 实时荧光定量PCR 引物序列
二、Los 对CUMS 大鼠海马肾素-血管紧张素系统活性的影响
与Control 组相比,Los 组海马Ang Ⅱ水平提高,AT1R 的表达量有所增加,但差异无统计学意义(P>0.05);CUMS 组Ang Ⅱ水平显著提高,AT1R 的表达量显著增加,差异具有统计学意义(P<0.05)。与CUMS 组相比,CUMS+Los 组给药处理后显著降低了AT1R 表达,同时降低了Ang Ⅱ水平,差异具有统计学意义(P<0.05)。具体信息见图2。
三、Los 对CUMS 大鼠海马炎性因子的影响
与Control 组比较,Los 组大鼠海马IL-6、TNF-α水平无明显变化(P>0.05),CUMS 组大鼠海马IL-6、TNF-α 水平显著升高,差异具有统计学意义(P<0.05);CUMS+Los 组较CUMS 组IL-6、TNF-α 的表达显著降低,差异具有统计学意义(P<0.05)。具体信息见图3。
四、Los 对大鼠海马组织SOD 活性及MDA 含量的影响
与Control 组相比较,Los 组海马组织的SOD 活性和MDA 含量差异均无统计学意义(P>0.05),CUMS组大鼠海马的SOD 活性降低,MDA 的含量升高,差异有统计学意义(P<0.05);与CUMS 相比较,CUMS+Los 组SOD 活性增加,MDA 的含量降低,差异具有统计学意义(P<0.05)。具体信息见图4。
讨论
目前抑郁症的发病机制尚未明确,现有的抗抑郁药物仍不能满足临床的需要,因此急需探寻潜在的抗抑郁药物。CUMS 抑郁模型是公认的经典的抑郁症模型,CUMS 模型的抑郁样行为与人类抑郁症临床表现极为相似,目前已在啮齿动物中成功建立了该模型[8-9]。本实验通过对大鼠进行8 周的CUMS造模,模型组的体质量增加量、糖水偏好、进入开放臂的时间和进入开放臂的次数以及比率较对照组显著降低,强迫游泳的不动时间显著增加,说明大鼠抑郁模型成功建立。有研究报道,Los 作为血管紧张素受体拮抗剂可以使阿尔茨海默病老年小鼠模型空间学习和记忆能力恢复[10]。除此之外,Los 在其他神经系统疾病认知障碍方面也显示出良好的治疗效果[11]。在本研究中,虽然大鼠经过Los 连续给药没有显著影响体质量,但是可以明显改善CUMS 引起的行为学变化,表明Los 对慢性应激导致的抑郁样行为有明显的防治作用。
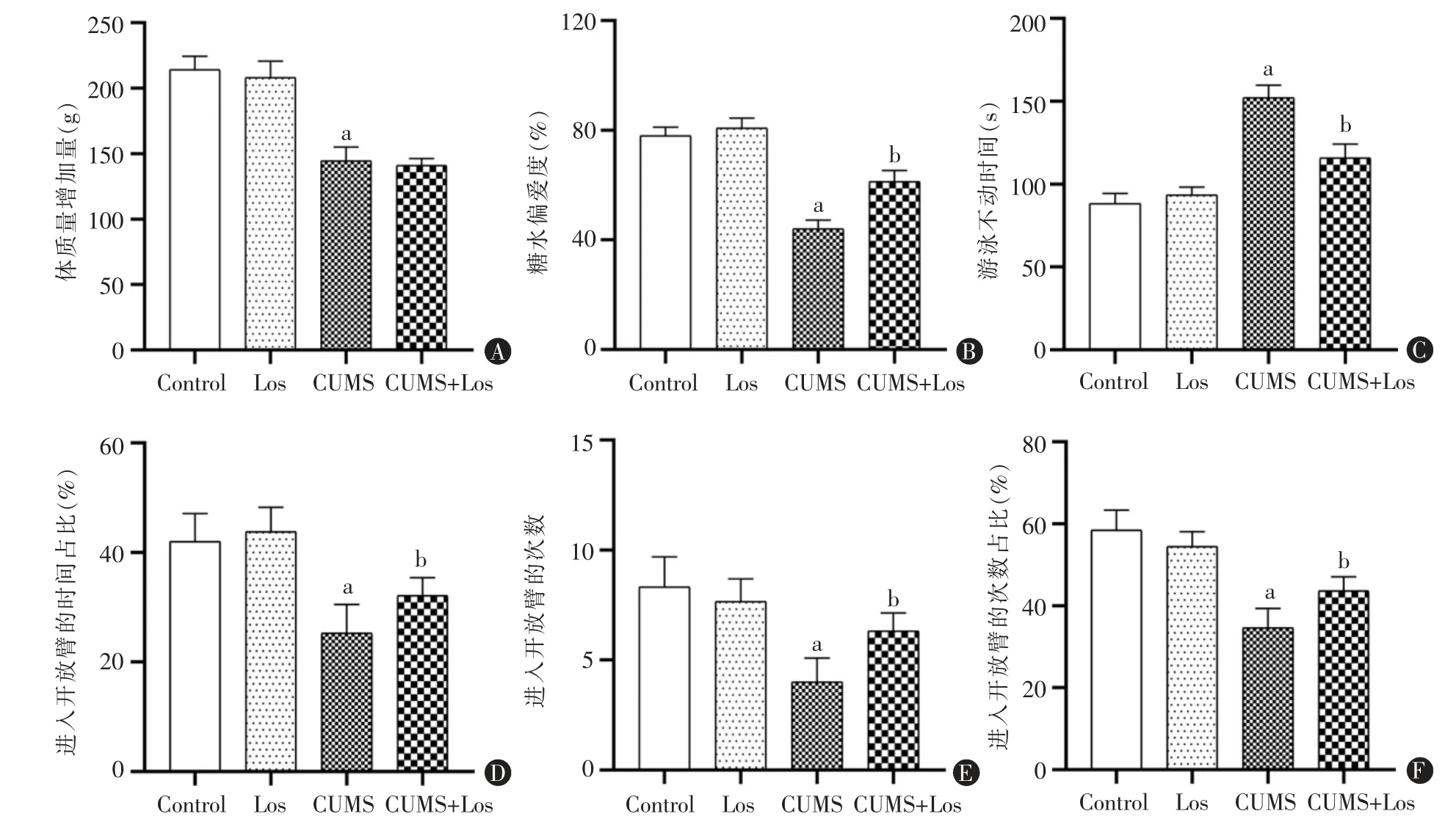
图1 氯沙坦对4 组大鼠体质量及行为的影响
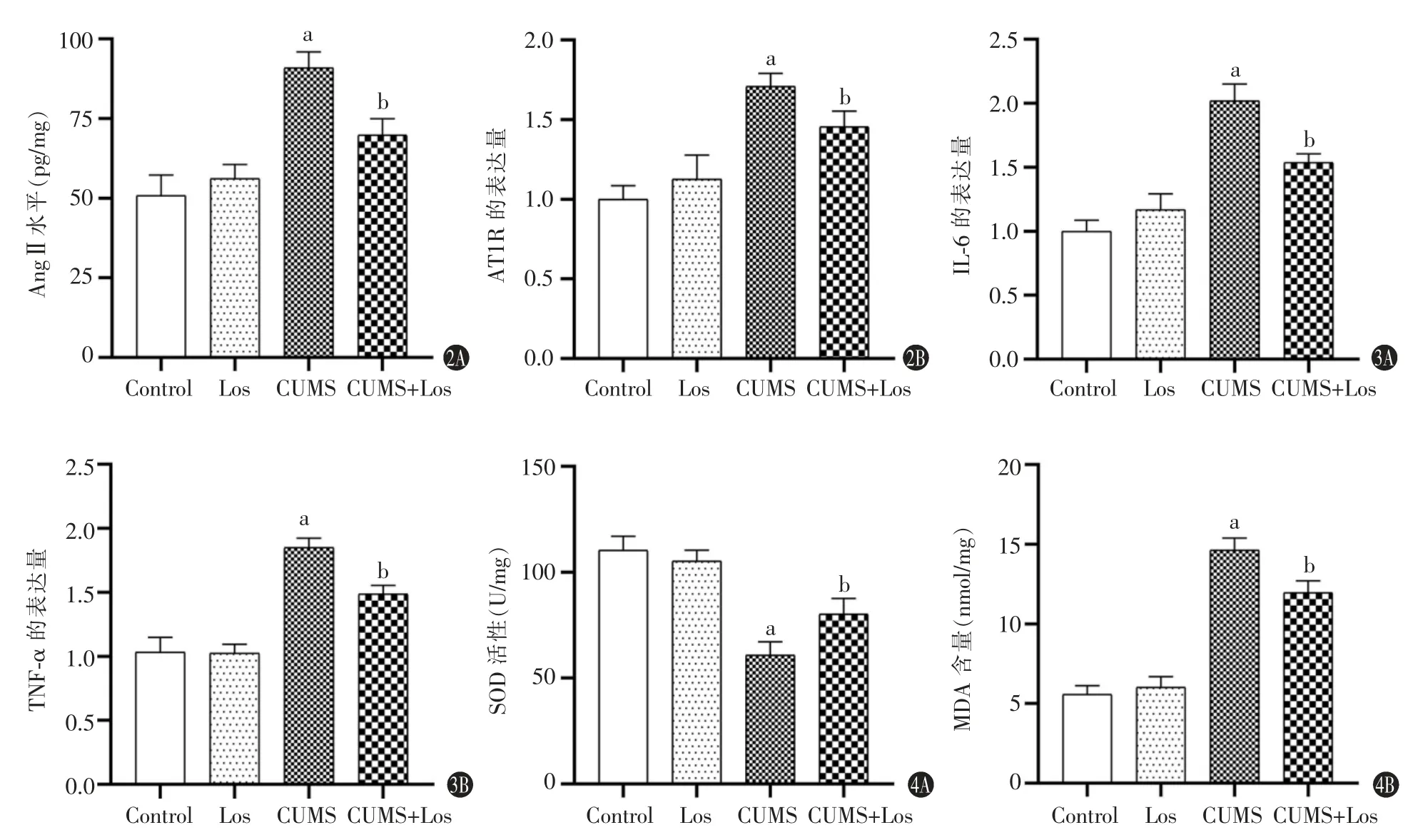
图2 氯沙坦对大鼠海马Ang Ⅱ和AT1R 的影响;图3 氯沙坦对大鼠海马炎性因子的影响;图4 氯沙坦对大鼠海马组织的SOD 活性及MDA 含量的影响
研究证明,脑内存在局部的RAS,其参与各种神经功能,包括认知、记忆、情绪和压力反应,并且已经在多种神经精神疾病中发现RAS 过度激活[12]。AngⅡ作为RAS 的成员之一,主要通过与AT1R 结合实现其功能,而AT1R 主要分布在脑内应激反应区域,应激时AngⅡ水平升高。本研究发现CUMS 组大鼠海马中的AngⅡ和AT1R 的表达较对照组显著升高,这与既往结果研究一致,说明大鼠经过长时间的应激后,脑内的RAS 系统被激活,参与了应激反应。而CUMS 模型在经过Los 连续给药后,AngⅡ及AT1R 的表达水平显著降低,Los 作为一种血管紧张素拮抗剂,可以穿过血脑屏障,与中枢神经系统内的受体特异性结合,抑制了AngⅡ及AT1R 的表达,阻止了AngⅡ进一步作用。
抑郁症是一种慢性的心理和生理应激过程,炎症反应参与了抑郁症的发生、发展过程。越来越多的研究表明,在抑郁症患者和动物模型中均发现有炎性因子水平显著升高[13-14]。本研究发现CUMS 大鼠抑郁模型的IL-6、TNF-α 含量较对照组明显升高。长时间的慢性应激会导致机体免疫系统和外周的激活,致炎性细胞因子大量释放。同时有文献报道,Ang Ⅱ通过核因子-κB 信号传导途径参与炎性因子的调节,加剧炎症反应[15]。在动物模型和临床研究中,AT1R 阻滞可以改善脑功能并降低IL-6、TNF-α 等炎性因子水平[16-18]。Los 可以显著降低外伤性损伤的脑神经元中的炎性因子水平[19]。值得注意的是,本研究使用Los 后,炎性细胞因子显著降低,这是对Los在抗脑损伤中作用的又一补充。Los 作为AT1R 拮抗剂对CUMS 大鼠抑郁状态的改善可能与其抗炎作用有关。
临床研究发现,重度抑郁患者体内SOD 的活性降低,而MDA 的含量升高[20]。氧化应激可以引起血脑屏障通透性改变和神经组织损伤。发生氧化应激时,MDA 作为脂质过氧化反应产物,其含量会升高,对神经细胞产生不良反应。SOD 活力的高低间接反应了机体清除氧自由基的能力,MDA 的高低间接反应了机体细胞受到自由基攻击的严重程度。本研究中CUMS 大鼠海马SOD 的活性显著降低,而MDA的含量显著升高,长时间的应激对大鼠海马造成了过氧化损伤。AT1R 拮抗剂阻碍了Ang Ⅱ与AT1R结合,进而影响Ang Ⅱ参与的氧化应激[21-22]。本研究中,Los 给药后大鼠模型海马SOD 活性提高,MDA含量降低,说明Los 可以提高机体的抗氧化应激能力,减轻过氧化损伤,有一定神经保护作用。
综上所述,Los 作为AT1R 拮抗剂对CUMS 大鼠抑郁行为具有良好的改善作用,同时可以降低炎症反应、减轻氧化损伤,为治疗炎症相关的神经系统疾病提供了潜在的药物靶标。

