抗SmD1抗体与系统性红斑狼疮疾病活动及狼疮肾炎的相关性研究
项光博 李素蘋 金珍木
系统性红斑狼疮(SLE)是体内出现多种自身抗体并合并多器官损害为特征的自身免疫性疾病。肾脏是最常见的靶器官损害(LN)。这些器官的损害主要由患者血液中分泌出多种自身抗体引起,而多以血管炎的弥漫性损害为主[1]。寻找与SLE活动相关的自身抗体具有相当的意义和价值。自身抗体中的抗Sm抗体较早被发现是SLE标志性抗体。近年来研究发现抗Sm抗体识别的蛋白多肽D是最主要靶抗原,其特异性和敏感性均高于抗Sm抗体;抗SmD1抗体对SLE的诊断敏感性较抗ds-DNA抗体、抗Sm抗体高,特异性与抗ds-DNA抗体、抗Sm抗体相近[2]。本文探讨抗SmD1抗体与SLE 疾病活动及狼疮肾炎的相关性。报道如下。
1 资料与方法
1.1 临床资料 选取2015年1月至2017年1月本院SLE 患者49例(疾病组),其中男3例,女46例;年龄21~69岁,平均年龄(41±13)岁。均符合2009年美国风湿病学会对SLE的分类修订标准。参照系统性红斑狼疮疾病活动指数(SLEDAI)进行评分。其中评估为疾病活动35例;疾病稳定14例。在确诊为SLE的基础上,如存在24h蛋白尿>0.5g或多次尿常规提示蛋白尿≥3+,或(和)存在细胞管型尿(可为各种类型或混合性管型),则临床诊断为狼疮肾炎。49例患者中LN患者占30例,非LN患者占19例。这些标本采集和临床调查均在患者使用大剂量糖皮质激素、免疫抑制剂和细胞毒性药物之前完成。选取其他非系统性红斑狼疮风湿性疾病,如类风湿关节炎、干燥综合征等患者77例为疾病对照组,均符合美国风湿病学会诊断标准。疾病对照组中男9例,女68例;年龄18~82岁,平均年龄(52±14)岁。另选择健康体检者40例为健康对照组,其中男10例,女30例;年龄26~65岁,平均年龄(45±11)岁。与疾病组的年龄、性别相匹配。
1.2 检测方法 抗SmD1抗体、抗dsDNA抗体采用线性免疫印迹法测定,试剂由德国胡曼公司提供。操作严格按试剂盒说明书进行,佳能LIDE 210扫描仪。其中抗SmD1抗体采用线性免疫印迹法测定、抗Sm抗体采用酶联免疫吸附试验(ELISA)检测;补体(C3、C4)采用散射免疫比浊法检测;血尿常规、24h尿蛋白、血沉(ESR)、肾功能、CRP等使用常规方法检测。
1.3 统计学方法 采用SPSS 19.0软件软件。计数资料以%表示,用χ2检验,计量资料以(x±s)表示,用t检验、方差分析和逐步回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组抗SmD1抗体比较 49例疾病组中有34 例抗SmD1抗体阳性,阳性率为69.4%。77例疾病对照组中4例抗SmD1抗体阳性,阳性率5.2%。其中4例均为类风湿关节炎。40例正常对照组中3例抗SmD1抗体阳性,阳性率为7.5%。抗SmD1抗体阳性率在疾病组和疾病对照组(χ2=58.582,P=0.000)及健康对照组(χ2=34.726,P=0.000)间差异均有统计学意义。而疾病对照组与健康对照组间差异无统计学意义。抗SmD1抗体对系统性红斑狼疮的诊断特异性和敏感性分别92.5%、69.4%,阳性预测值为91.9%,阴性预测值为71.2%。
2.2 抗SmD1抗体单因素回归分析 血沉(ESR)、C反应蛋白(CRP)、肌酐(Cr)、血小板计数(PLT)、血红蛋白(Hb)、免疫球蛋白、补体C4、24h尿蛋白定量与抗SmD1抗体水平无相关关系;抗SmD1抗体与补体 C3(b=-3.140)和白细胞计数(WBC)(b=-0.249)呈负相关(P<0.05);与dsDNA(b=0.981)及SLEDAI(b=0.175)呈正相关(P=0.000)。
2.3 抗SmD1抗体多因素回归分析 对上述4个可能相关的计量指标(补体C3、WBC、dsDNA、SLEDAI评分)进行多因素线性回归分析,建立优化回归方程如下:Y=1.698+0.111X1。该回归方程表明抗SmD1抗体与SLEDAI评分具有线性回归性,SLEDAI评分与抗SmD1抗体水平呈正相关(P<0.05)。WBC、补体C3及dsDNA在逐步回归中被剔除。WBC、补体C3及dsDNA与抗SmD1抗体的线性关系可能存在其他暂不明确因素的影响。见表1。
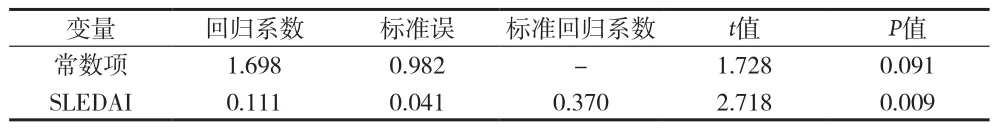
表1 抗SmD1抗体多元逐步回归系数结果
2.4 抗SmD1抗体与SLE临床表现的关系 见表2。
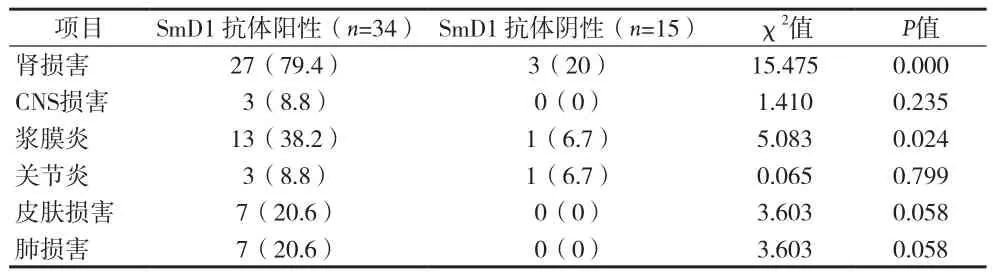
表2 抗SmD1抗体阳性与抗SmD1抗体阴性的器官受累情况[n(%)]
2.5 自身抗体与狼疮肾炎的关系 见表3。
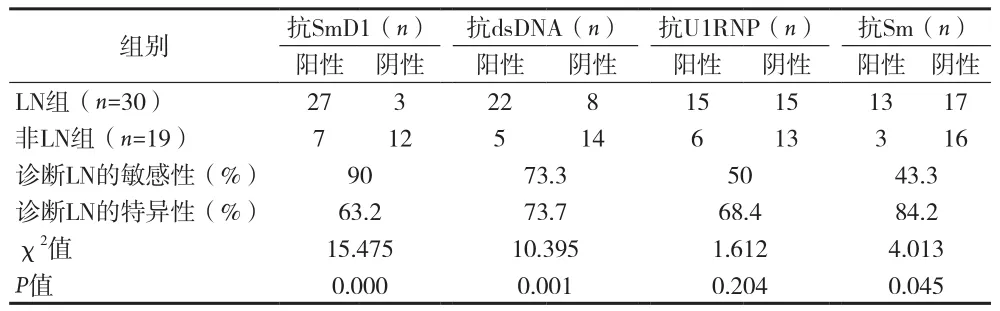
表3 抗SmD1抗体、抗dsDNA、抗U1RNP抗体及抗Sm 抗体对LN诊断的敏感性和特异性
2.6 抗SmD1抗体与狼疮疾病活动性的关系 (见表4)。未累及肾组抗SmD1抗体在SLEDAI评分>4系统性红斑狼疮活动组(分肾脏累及组及非肾脏累及组)和SLEDAI≤4系统性红斑狼疮非活动组(分肾脏累及组及非肾脏累及组)比较 共49例SLE患者中,有28例狼疮活动累及肾、2例狼疮非活动性累及肾、7例狼疮活动未累及肾和12例狼疮非活动性未累及肾。抗SmD1抗体阳性率在狼疮活动累及肾组与狼疮非活动性累及肾组,狼疮活动未累及肾组与狼疮非活动性未累及肾组差异有统计学意义(P=0.000)。
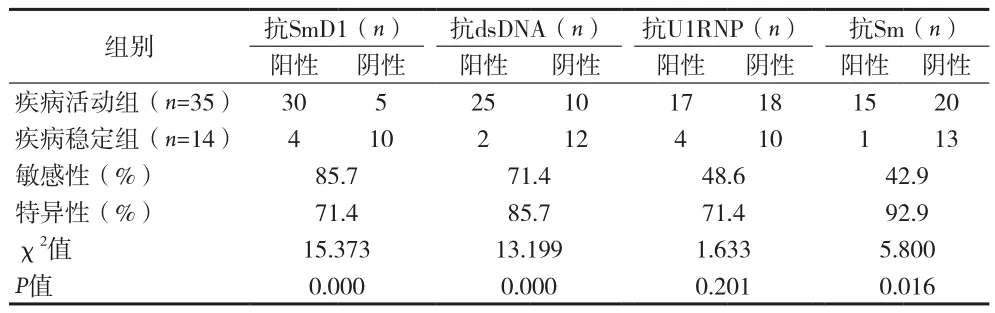
表4 抗SmD1抗体、抗dsDNA、抗U1RNP抗体及抗Sm 抗体对SLE疾病活动的特异性和敏感性
3 讨论
SLE能产生大量自身抗体的复杂的自身免疫性疾病。对这些自身抗体产生过程及机制进行了解,较多自身抗体与疾病的相应临床表现相关,可根据此抗体滴度指导临床治疗。抗Sm抗体一直被认为是SLE标志性抗体。该抗体对SLE诊断是高度特异性的,然而其敏感性较低;且Sm的抗原与U1RNP抗原具有共同抗原表位。可能存在交叉反应,这也影响了抗Sm抗体的特异性[3]。
抗Sm抗体识别的蛋白多肽至少有9种,包括B(B1,28kDa),B'(B2,29kDa),N(B3,29.5kDa),D1(16kDa),D2(16.5kDa),D3(18kDa),E(12kDa),F(11kDa),G(9kDa)。所有的9种蛋白多肽中,最常见的是B和D多肽,其中SmD1是最主要的抗原[4]。SmD1为SLE高度特异性靶抗原[5]。研究发现抗SmD1抗体是SLE的特异性自身抗体,其特异性和敏感性均较高,特异性达92.5%,且敏感性高于抗Sm抗体。
本资料结果显示,抗SmD1抗体的阳性与狼疮疾病活动存在正相关,表明抗SmD1抗体可能参与狼疮病情活动,因此抗SmD1抗体可以作为判断狼疮病情的参考指标。抗SmD1抗体对于诊断狼疮疾病活动的敏感性85.7%,但特异性较差;而抗Sm抗体特异性高、敏感性差;两者比较抗SmD1抗体相对有较好特异性和敏感性,抗SmD1抗体若与抗dsDNA抗体联合检测可提高诊断疾病活动的SLE的特异性及敏感性,临床上可减少狼疮漏诊的发生。
临床表现中肾脏受损是系统性红斑狼疮最常见的临床表现,约50%~70%患者在病程中可出现[6]。有学者提出抗dsDNA抗体与体内抗原结合形成免疫复合物沉积于肾小球基底膜或直接作用于肾小球,从而引起肾脏损害[7]。Jaekel HP等[8]研究发现SmD1抗体与疾病活动和肾损害相关。本资料结果证实抗SmD1抗体与系统性红斑狼疮的肾损害及浆膜炎显著相关。血清抗SmD1抗体阳性狼疮患者的肾损害及浆膜炎发生率明显高于抗SmD1抗体阴性组。抗SmD1抗体对于系统性红斑狼疮肾损害及浆膜炎的发生有重要意义。但其参与这些临床症状的发生、发展机制还有待进一步研究。
To CH等发现抗Sm抗体与系统性红斑狼疮靶器官损坏如肾损伤、肺纤维化、浆膜炎等有关[9]。但抗Sm抗体SLE患者检测中的阳性率较低,易造成漏诊[10],本资料结果显示抗SmD1抗体的特异性和敏感性分别为84.2%和90%;抗SmD1抗体的敏感性及特异性均较高。且狼疮肾炎患者血清抗SmD1抗体阳性率(90%)显著高于无肾炎表现的狼疮对照组(36.9%)。
综上所述,抗SmD1抗体具有良好的特异性和敏感性,与狼疮的病情活动及狼疮肾炎有一定的相关性,抗SmD1抗体可作为系统性红斑狼疮诊断的标志性抗体之一,特别是抗Sm抗体阴性时,提高红斑狼疮的诊断率,抗SmD1抗体的实验室检测值得临床广泛应用。

