河蚬肉酶解产物解酒护肝功效
张 帅章超桦,2,3,4高加龙,2,3,4秦小明,2,3,4郑惠娜,2,3,4郝记明,2,3,4张 静,2,3,4
(1. 广东海洋大学食品科技学院,广东 湛江 524088;2. 广东省水产品加工与安全重点实验室, 广东 湛江 524088;3. 广东普通高等学校水产品深加工重点实验室,广东 湛江 524088; 4. 国家贝类加工技术研发分中心〔湛江〕,广东 湛江 524088)
据WHO统计[1],早在2010年中国15岁以上人群人均消耗纯酒精量就高达6.7 L,而且呈逐年上升趋势。过量饮酒会造机体酒精中毒,引起组织器官或者免疫改变,导致各种酒精性疾病。2016年全球有300多万人因过量饮用酒精而死亡[2]。目前对于急性酒精性肝病的预防及治疗的研究很多,其中包括不少对天然提取物解酒护肝的研究,如葛根、枳椇子[3]、姜黄[4]、朝鲜蓟[5]等植物提取物,玉米肽、大豆肽等小分子多肽物质[6]12-24,牡蛎[7]、珍珠贝[8]、贻贝[9]、河蚬[10-13]等水产动物酶解产物或提取物。
河蚬(Corbiculafluminea),双壳类软体动物,又称黄蚬、扁螺等,常栖息于淡水或咸淡水中,其可食部位味道鲜美,营养丰富,蛋白含量高且富含多种必需氨基酸。《本草纲目》中记载,河蚬具有治肝病、解酒毒等疗效[14]。张磊等[10]和王一铮等[11]研究表明河蚬水提物对小鼠急性乙醇肝损伤具有保护作用,未涉及其解酒功效。刘晶晶等[12]和朱小燕等[13]研究表明河蚬酶解产物具有醒酒功效,但其是否具有抗急性酒精性肝损伤功效尚不清楚。采用酶解技术处理河蚬肉,会得到大量功能性氨基酸和肽,同时能释放多糖等其他活性物质于酶解产物中,本研究拟将从食品化学角度对河蚬肉酶解产物的基本营养成分和氨基酸组成进行分析,并分别采用体外和体内试验法系统研究河蚬肉酶解产物对乙醇脱氢酶(ADH)激活率、对小鼠的防醉醒酒和抗急性酒精性肝损伤的影响,为开发河蚬解酒护肝产品提供理论依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
鲜活河蚬(Corbiculafluminea):购于广州市黄沙市场,开壳取肉后200 g分装,储存于-40 ℃冰箱待用;
雄性昆明小鼠:SPF级,许可证号SCXK(京)2014-0004,质量18~22 g,中国医学科学院医学试验动物研究所;
中性蛋白酶、碱性蛋白酶:2.0×105U/g,广西庞博生物科技有限公司;
乙醇脱氢酶(ADH):300 U/mg,美国Sigma公司;
血乙醇测定试剂盒、乙醇脱氢酶测定试剂盒、丙二醛测定试剂盒、甘油三酯测定试剂盒、还原型谷胱甘肽测定试剂盒:南京建成生物科技有限公司;
红星二锅头:56% vol,北京红星股份有限公司;
阳性药物:河蚬姜黄肝脏水解物糖丸(含肝脏酶解物、河蚬提取物、牡蛎肉浓缩提取物和姜黄浓缩提取物等),日本オリヒロプランデュ株式会社;
其他试剂均为分析纯。
1.1.2 主要仪器设备
旋转蒸发仪:R-1005型,郑州长城科工贸有限公司;
高速落地离心机:Thermo Lynx6000型,赛默飞世尔科技(中国)有限公司;
真空冷冻干燥机:FDU-1100型,东京理化器械株式会社;
高速氨基酸分析仪:835-50型,日立仪器(上海)有限公司;
多功能酶标仪:Varioskan Flash型,赛默飞世尔科技(中国)有限公司。
1.2 方法
1.2.1 河蚬肉酶解产物制备 参照林娈等[15]河蚬肉酶解工艺方法,冷冻河蚬肉解冻后,按料水比1∶3 (g/mL)加水匀浆,调整pH至7.0,按原料质量1.3%加入混合酶(碱性蛋白酶∶中性蛋白酶质量比3∶1),于53 ℃恒温摇床中反应260 min,然后沸水浴灭酶10 min,置冰浴中冷却后以5 000 r/min离心20 min,收集上清液,测得水解度为31.6%,真空浓缩后冷冻干燥得到河蚬肉酶解产物干粉供试验备用。
1.2.2 基本成分测定
(1) 水分:按GB 5009.3—2016的常压干燥法执行。
(2) 粗蛋白:按GB 5009.5—2016的自动凯氏定氮仪法执行。
(3) 粗脂肪:按GB 5009.6—2016的索氏抽提法执行。
(4) 总糖含量:按GB/T 9695.31—2008的苯酚硫酸法执行。
(5) 灰分:按GB 5009.4—2016的高温灼烧法执行。
(6) 非蛋白氮:采用三氯乙酸沉淀法[16]。
1.2.3 氨基酸组成分析 采用氨基酸自动分析仪测定,其中水解氨基酸参照GB 5009.124—2016方法,游离氨基酸测定参照文献[17]。
1.2.4 ADH激活率测定 参照文献[6]17。
1.2.5 小鼠给酒量选择 体重18~22 g SPF小鼠,暂养3 d 后,取30只随机分为3组,禁食(不禁水)12 h后称重,按体重分别灌胃0.14,0.16,0.18 mL/10 g·BW 红星二锅头。参照高加龙[18]的方法,以翻正反射为指标观察小鼠是否醉酒,记录小鼠醉酒只数和死亡只数,选择醉酒率较高、死亡率较低的剂量为最适给酒量。
1.2.6 灌胃剂量确定 阳性对照组药物浓度0.03 g/mL,是成人剂量的10倍,具有蛋白质、氨基酸等含氮物质。河蚬酶解物组灌胃剂量按阳性对照中氮含量进行配置。
1.2.7 小鼠防醉试验和解酒试验 将30只SPF雄性小鼠随机分为3组,即阴性组、阳性组和河蚬组,每组10只,禁食(不禁水)12 h后称重,按照体重分别灌胃0.1 mL/10 g·BW的蒸馏水、阳性药物和河蚬肉酶解产物,其中阳性药物和河蚬酶解产物的浓度分别为0.03,0.01 g/mL;初次灌胃30 min后,灌胃0.16 mL/10 g·BW的红星二锅头。利用翻正试验观察判断小鼠醉酒状态,记录小鼠从灌酒到翻正反射消失(醉酒)所需时间和翻正反射消失(醉酒)到恢复(醒酒)所需时间。
1.2.8 急性饮酒小鼠血液乙醇浓度的测定 将30只SPF雄性小鼠随机分为3组(阴性组、阳性组和河蚬组),每组10只,按照1.2.6方法灌胃。在灌胃60 min后对各组小鼠眼球取血,采用血乙醇测定试剂盒测小鼠血液乙醇浓度。
1.2.9 河蚬酶解产物对小鼠急性酒精性肝损伤预防效果
将40只SPF雄性小鼠随机分为4组(空白组、阴性组、阳性组和河蚬组),每组10只。每天上午灌胃前称量体重。阴性组、阳性组和河蚬组按照1.2.6方法分别灌胃蒸馏水、阳性药物和河蚬肉酶解产物,30 min后灌胃0.12 mL/10 g·BW 的红星二锅头,连续灌胃7 d;空白组每天灌胃蒸馏水。末次灌胃后引颈处死,解剖取肝脏组织,测定丙二醛(MDA)、甘油三酯(TG)、谷胱甘肽(GSH)等生化指标,具体方法参照试剂盒说明书。
1.3 数据处理
2 结果分析
2.1 河蚬肉酶解产物基本营养成分
河蚬肉酶解产物基本营养成分见表1。按干基计,河蚬肉酶解产物同牡蛎肉酶解产物[19]相比,其粗蛋白含量较高,为56.61%;总糖含量低于牡蛎肉酶解产物,为30.82%;粗脂肪和灰分含量与牡蛎肉酶解产物较接近。可见河蚬肉酶解物干粉是一种蛋白含量高,脂肪低并富含丰富矿物质的营养价值很高的酶解蛋白粉。
2.2 河蚬肉酶解产物氨基酸组成
食物蛋白质中的氨基酸是机体不可缺少的营养成分之一,对机体各种生理功能具有重要意义。如表2所示,可以看到河蚬肉酶解产物氨基酸种类齐全,水解氨基酸中必需氨基酸与总氨基酸比值为43.18%,必须氨基酸与非必须氨基酸比值为75.95%,符合FAO/WHO推荐标准中理想蛋白模式[20]。河蚬肉酶解产物中的游离氨基酸含量较高,占总氨基酸的51.86%,说明河蚬肉经过酶解产生了丰富的氨基酸。有报道称赖氨酸[21]、脯氨酸[22]以及丙氨酸[23]等氨基酸可能与醒酒作用有关,牡蛎肉酶解产物[19]游离氨基酸中赖氨酸、脯氨酸和丙氨酸的占比分别为9.54%,5.27%,8.24%,对比可以发现河蚬肉酶解产物中与解酒作用有关的氨基酸含量是相当丰富的。有研究[24]表明目前临床上常用于治疗肝病的药物有天门冬氨酸—鸟氨酸二肽注射液,可改善肝病患者的肝功能,促进肝细胞自我修复和再生。如何使河蚬中富集更多的氨基酸和多肽片段,利用蛋白酶对河蚬肉进行酶解是一个很好的选择。
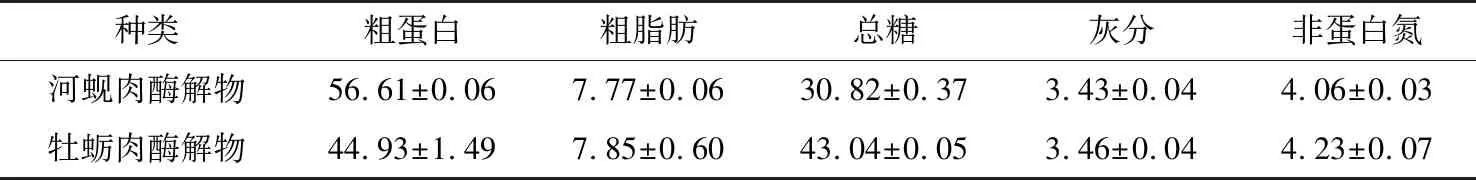
表1 河蚬肉酶解产物与其他贝类酶解产物的一般营养成分含量
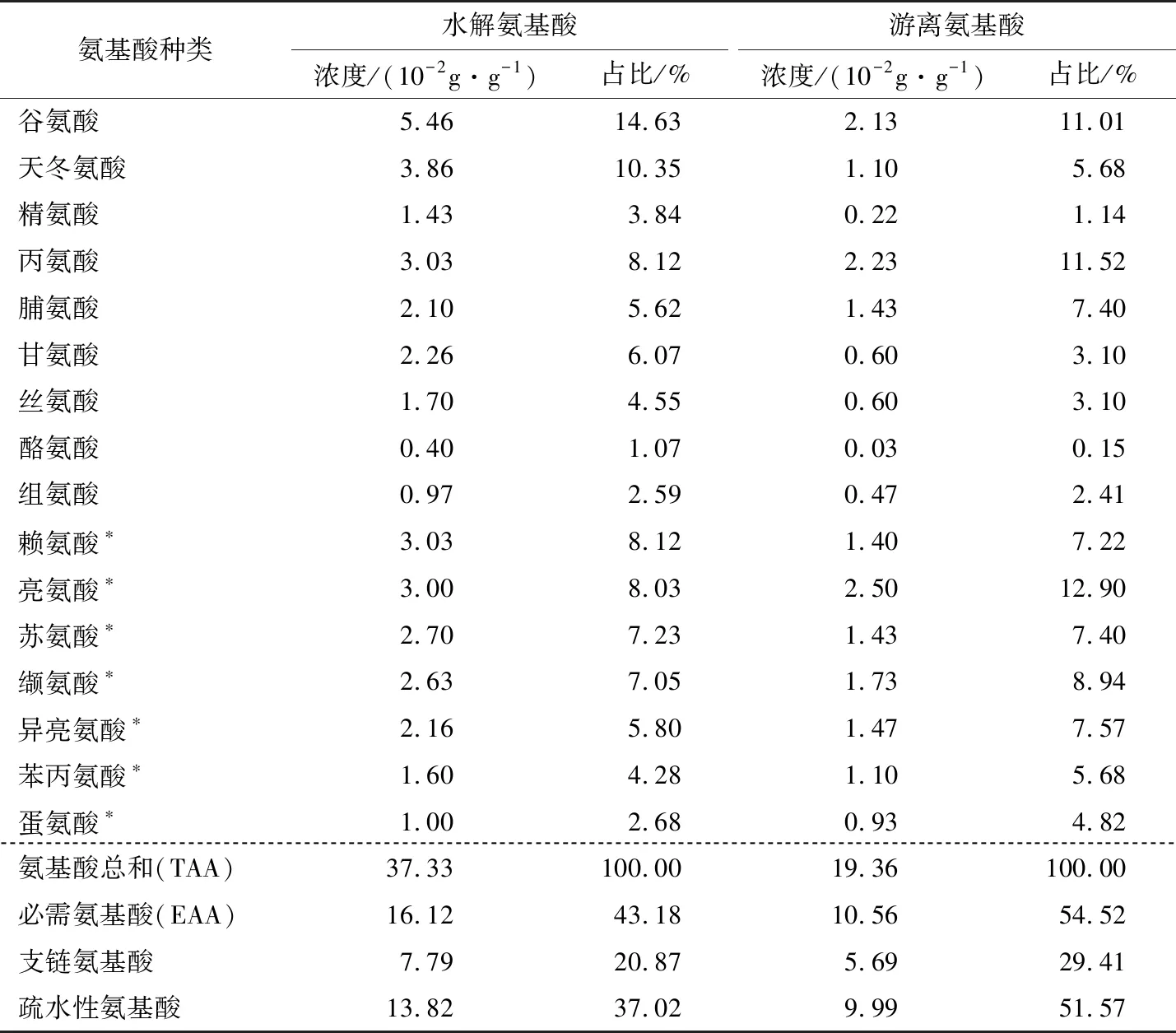
表2 河蚬肉酶解产物氨基酸组成†
† *为必需氨基酸。
2.3 河蚬肉酶解产物体外对ADH活性的影响
解酒护肝研究的经典评价方法是体内试验法(动物模型),但该方法试验周期较长,目前常用瓦勒—霍赫法[25]并稍加改良后测定ADH的活性,来高效快速测定样品是否有解酒活性。刘鹏[6]19-20研究表明大豆肽和玉米肽对ADH的活性具有促进作用。芦洁等[26]利用体外ADH激活率的方法,证实白豆蔻、复方解酒保肝茶、葛花水提物和市售葛花王水提取物对ADH活性具有促进作用。本研究采用体外试验法对受试样品活性进行初步测定,再进一步对样品进行体内活性评价。由图1所示,河蚬组对ADH激活率为52%,且高于阳性组(P<0.05)。从本试验数据得出河蚬肉酶解产物对ADH具有激活作用。
2.4 河蚬肉酶解产物对急性饮酒小鼠的防醉及解酒效果
2.4.1 小鼠给酒量选择 为了确定急性饮酒小鼠的醉酒剂量,将30只小鼠按照1.2.5 中所述方法进行灌酒试验,所得结果如表3所示。
小鼠灌酒剂量过高会酒精中毒死亡,灌酒剂量偏低小鼠不会醉酒或醉酒只数较少。由表3可知,灌酒0.14 mL/10 g·BW 后醉酒只数为6只,灌酒0.16,0.18 mL/10 g·BW 后小鼠全部醉酒。观察发现灌酒0.14 mL/10 g·BW 小鼠醉酒后睡眠浅,心脏跳动加快,个别出现兴奋和急躁,而另外2个剂量的小鼠醉酒后出现沉睡,翻正反射消失,且0.18 mL/10 g·BW组有3只死亡。因此,选择小鼠的醉酒剂量为0.16 mL/10 g·BW。
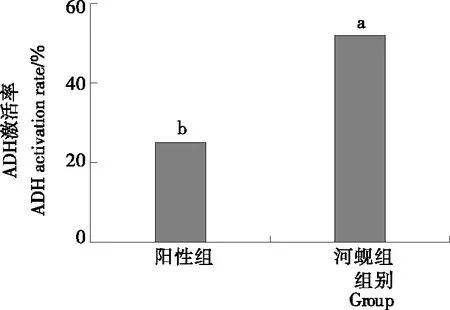
不同字母表示组间差异有统计学意义(P<0.05)
Figure 1 Effect of hydrolysate from soft tissue ofCorbiculaflumineaon ADH activation rate in vitro
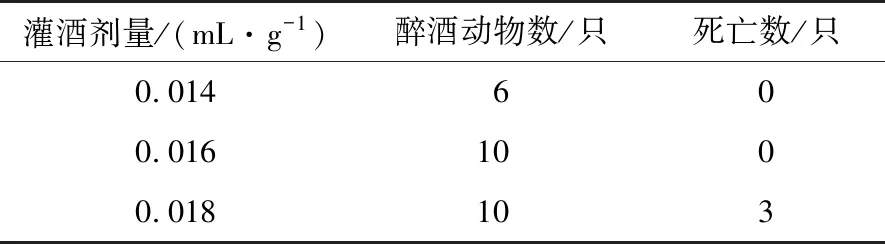
表3 小鼠给酒量选择结果
2.4.2 对小鼠醉酒时间和醒酒时间的影响 如表4所示,与阴性组相比,河蚬组和阳性组均能延长小鼠的醉酒时间(P<0.05),二者无显著性差异;与阴性组比较河蚬组醉酒时间延长率为69.42%。与阴性组相比,河蚬组和阳性组均能缩短小鼠的醒酒时间(P<0.05),二者无显著性差异;与阴性组比较河蚬组醒酒时间缩短率为13.40%。试验结果表明河蚬肉酶解产物能延长小鼠的醉酒时间和缩短醒酒时间。
2.4.3 对急性饮酒小鼠血液乙醇浓度的影响 乙醇经口腔进入胃、小肠、大肠和十二指肠之后,一小部分经胃肠道中的ADH进行第一关卡代谢,然后排出体外;但大部分乙醇会被胃肠道吸收,进入血液,经循环到达肝脏中进行代谢。图2是小鼠在饮酒后第60 min的血液乙醇浓度,与阴性组相比,阳性组和河蚬组均能显著降低小鼠血液乙醇浓度(P<0.05),二者无显著性差异。左光扬等[8]和韩丽娜[27]的研究表明,醒酒物可以通过促进乙醇代谢的方式降低小鼠血液乙醇的含量。本研究结果表明河蚬肉酶解产物可以降低急性饮酒小鼠血液乙醇浓度。
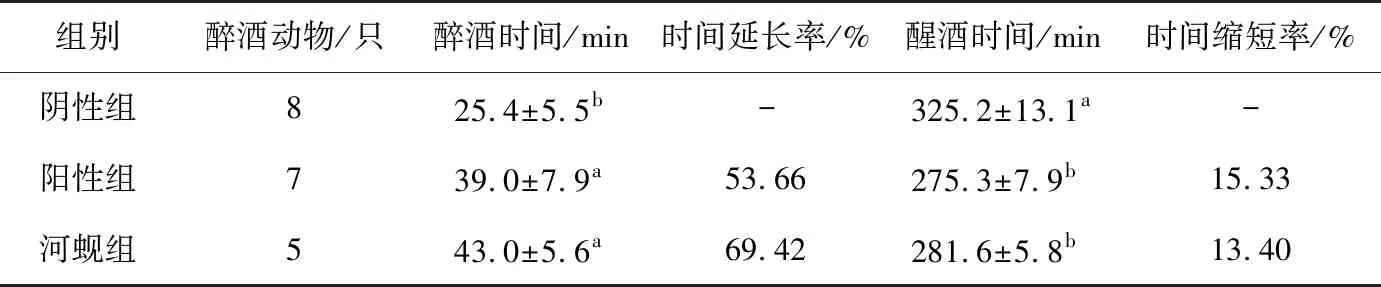
表4 河蚬肉酶解产物对小鼠醉酒和醒酒时间的影响†
† 不同字母表示组间差异有统计学意义(P<0.05)。

不同字母表示组间差异有统计学意义(P<0.05)
Figure 2 Effect of hydrolysate from soft tissue ofCorbiculaflumineaon the concentration of ethanol in serum of acute drunken mice
2.5 对小鼠急性酒精性肝损伤预防效果
饮酒会对机体的肝组织造成损伤,主要是通过乙醇代谢物对肝脏的损伤,如:乙醛的化学性损伤、氧化还原反应的改变、氧化应激与脂质过氧化、线粒体损伤和铁负荷等[28],通过对肝脏生化相关指标的测定,来验证这些损伤反应是否发生,或者有无变化,从而来证明灌胃样品是否对机体急性酒精性肝损伤起着积极的预防效果。根据《保健食品检验与评价规范》的判定方法,肝组织MDA、TG和GSH 3项检测指标其中任意2项结果为阳性,即可判定该物质对酒精性肝损伤具有辅助保护功能[29]。
2.5.1 对肝脏组织中MDA的影响 乙醇在肝脏进行代谢会产生大量的自由基,而自由基会诱导肝细胞脂质过氧化产生MDA等物质[30]。所以MDA作为脂质过氧化的标志性产物,其含量的多少也代表着肝细胞脂质过氧化的程度,从而间接地反映了肝细胞的受损程度。由图3(a)所示,河蚬组小鼠肝脏组织中的MDA含量显著小于阴性组(P<0.05),说明河蚬肉酶解产物能缓解急性饮酒小鼠肝脏组织中MDA的累积。
2.5.2 对肝脏组织中TG的影响 机体在大量饮酒后,乙醇会在乙醇脱氢酶的催化下大量地脱去氢原子被氧化,导致三羧酸循环发生障碍,脂肪酸氧化减弱,从而影响脂肪的代谢,而且乙醇可致磷酸甘油增多而促进甘油三酯的合成,致使脂肪在肝细胞内沉积,TG含量增多[31]。如图3(b)所示,河蚬组小鼠肝脏组织中的TG含量显著小于阴性组(P<0.05),说明河蚬肉酶解产物能降低急性饮酒小鼠肝脏组织中TG的含量。
2.5.3 对肝脏组织中GSH的影响 GSH在机体中起着很多有益的生化作用,它是抗氧化剂同时又是自由基的清除剂,能保护细胞的完整性,对维持细胞的正常代谢起着一定的作用。乙醇经体内代谢后可产生大量的自由基,对机体造成毒害作用,但GSH能清除自由基保护机体不受损伤[32]。由图3(c) 所示,阴性组小鼠肝脏组织中GSH的含量低于空白组(P<0.05),反映了阴性组小鼠因饮酒造成了GSH的大量消耗,含量降低,河蚬组小鼠肝脏组织中GSH的含量多于阴性组(P<0.05),且与空白组无显著性差异(P>0.05)。
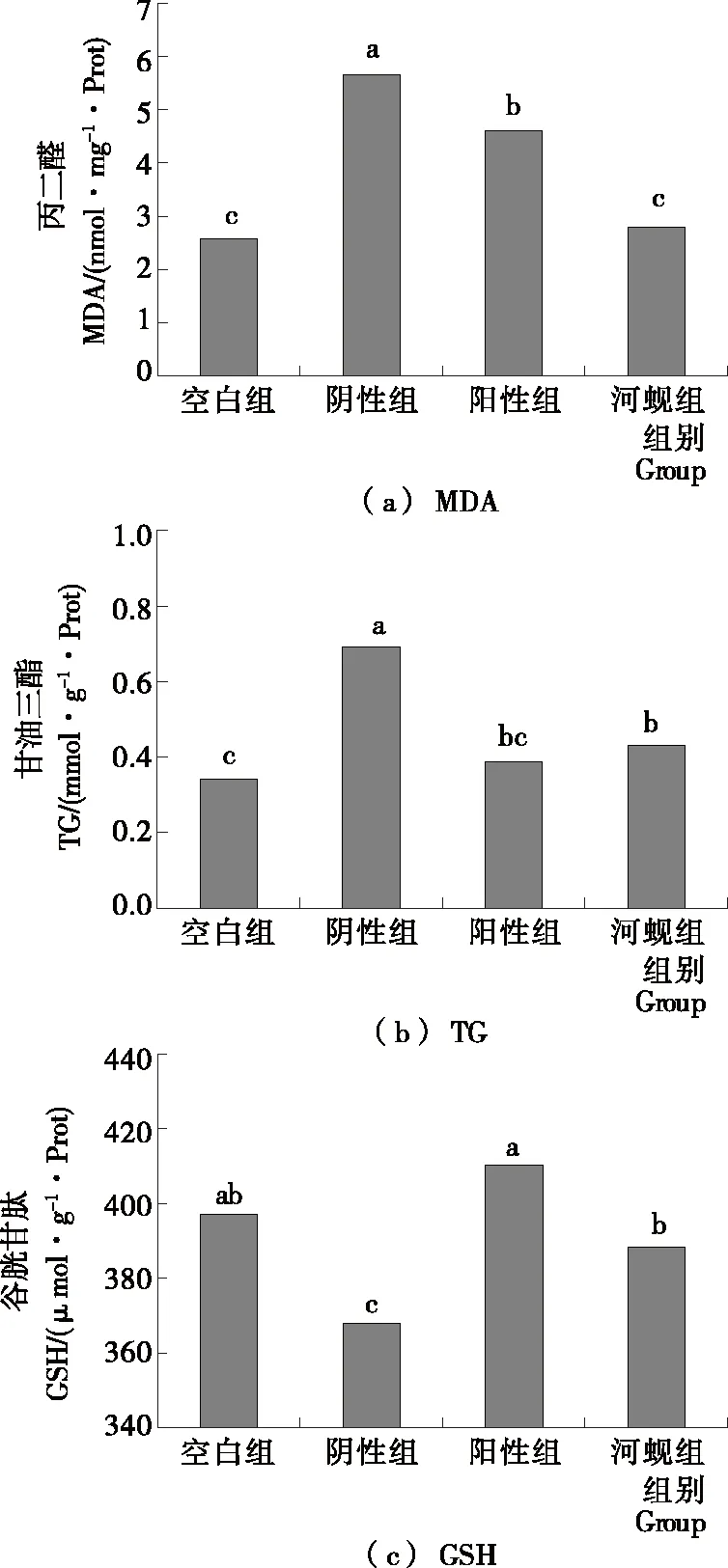
不同字母表示组间差异有统计学意义(P<0.05)
Figure 3 Effect of hydrolysate from soft tissue ofCorbiculaflumineaon liver tissue MDA,TG and GSH of acute drunken mice
3 结论
河蚬肉酶解物是一种蛋白含量高,脂肪低的酶解蛋白粉,其游离氨基酸含量占总氨基酸的51.86%。通过体外测定法检出河蚬肉酶解产物对ADH具有激活作用;通过体内活性评价显示河蚬肉酶解产物可显著延长小鼠的醉酒时间和缩短醒酒时间,证明其具有防醉及醒酒功效。同时相关生化指标表明,其能显著降低小鼠血液乙醇浓度,且能降低小鼠肝组织中MDA、TG的含量,减缓GSH的消耗。表明河蚬肉酶解产物具有解酒护肝的功效,但其具体功效成分有待进一步研究探明。

