支链聚合度对菠萝蜜种子淀粉理化特性的影响
张雨桐张彦军朱科学徐 飞李士泽吴 刚谭乐和
(1. 中国热带农业科学院香料饮料研究所,海南 万宁 571533; 2. 黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
菠萝蜜(ArtocarpusheterophyllusLam.)为桑科(Moraceae),起源于印度,目前在中国海南、广东和广西等地均有种植,主栽品种主要是马来西亚1~6号和11号等。菠萝蜜由外皮、黄色果肉、鳞茎和种子组成,种子富含大量淀粉,占干物质的60%~80%[1]。前期研究发现菠萝蜜种子淀粉(jackfruit seed starch,JFSS)具有特殊的功能特性,例如低黏性、小粒径、高溶解度、强吸水和吸油能力等;并且具有独特的结构,包括高比例的A链(DP 6~12)、低比例的B2链(DP 13~24)和B3链(DP≥37)以及较短的平均链长[2-3]。也有研究[4]报道JFSS是一种包埋微胶囊的新型壁材。因此,JFSS可作为研究淀粉精细结构的优质材料之一。
淀粉作为一种天然高分子物质,广泛应用于食品加工领域,其理化特性直接关系到淀粉质食品的食用品质及贮藏稳定性等,因此受到食品科研人员的广泛关注[5]。近年来研究[6-7]发现,淀粉理化特性受淀粉组成(直链淀粉和支链淀粉的比例、脂质复合物的量)、分子结构(直链淀粉和支链淀粉分子量、支链淀粉链长分布)和结晶结构(结晶类型、结晶区和无定形区的比)等影响。然而,支链聚合度对淀粉理化特性影响的研究未见报道。
本课题组[1]前期研究JFSS性质时发现,分离的支链淀粉具有不同聚合度,且不同品种JFSS的理化特性存在显著差异。本研究拟以不同聚合度的支链淀粉和不同品种JFSS直链淀粉混合成的菠萝蜜淀粉为研究对象,采用差式扫描量热仪(Differential scanning calorimetry,DSC)、快速黏度分析仪(Rapid visco analyser,RVA)、X-射线衍射仪(X-ray diffraction,XRD)和衰减全反射傅里叶变化红外光谱(Attenuated total reflectance-Fourier transformed infrared,ATR-FTIR)比较支链聚合度对JFSS理化特性影响的差异性,为解析JFSS分子结构提供理论借鉴;探究不同支链聚合度与JFSS理化特性间的相关性,并基于不同支链聚合度,分析冻融稳定性、热特性、糊化特性、结晶结构和短程分子有序度间的相关性,为解析支链聚合度对JFSS理化特性的影响机理提供参考,为进一步探究淀粉结构提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
菠萝蜜种子:海南兴隆本地品种(BD)和异国引进品种马来西亚1号(M1)、马来西亚5号(M5)、马来西亚6号(M6)、马来西亚11号(M11),中国热带农业科学院香料饮料研究所;
硫代硫酸钠、盐酸、无水乙醇、甲醇:分析纯,西陇科学股份有限公司。
1.1.2 主要仪器设备
差式扫描量热仪:Q2000型,美国TA公司;
快速黏度分析仪:TechMaster型,澳大利亚Perten公司;
多功能X-射线衍射仪:D1-system型,英国Bede公司;
衰减全反射傅里叶变换近红外光谱:Nicolet 6700型,美国Thermo公司;
离心机:LXJ-IIB型,上海安亭科学仪器厂;
冷冻干燥机:Scientz-18ND型,宁波新芝生物科技股份有限公司;
水浴恒温振荡器:SHZ-C型,上海博迅实业有限公司医疗设备厂;
电热恒温鼓风干燥箱:Blue pard型,上海一恒科学仪器有限公司;
脱壳机:SY-100C型,台州市鲨鱼食品机械有限公司;
多功能磨浆机:HX-PB908型,佛山市海迅电器有限公司;
胶体磨:80型,上海科劳机械厂。
1.2 方法
1.2.1 菠萝蜜种子淀粉的提取 根据文献[8]修改如下:使用脱壳机将种子去壳,用磨浆机粗粉碎,再于胶体磨细粉碎。过200目筛后,水洗去除可溶性糖。5 000 g/min离心10 min,沉淀与0.5 mol/L硫代硫酸钠按质量比1∶1混合搅拌36 h。再次离心(5 000 g/min,10 min),刮去沉淀物上层褐色皮,多次水洗后用1.0 mol/L盐酸中和至pH 7.0。离心(5 000 g/min,10 min),沉淀用质量分数50%无水乙醇进一步洗涤。沉淀物冷冻干燥至水分含量低于13%,得到JFSS。
1.2.2 直链淀粉和支链淀粉的分离 根据文献[2]修改如下:JFSS加蒸馏水配制成质量分数3%,100 ℃水浴摇床加热1 h,5 000 g/min离心10 min,沉淀物保存备用,上清液加入1/2体积无水乙醇,静置12 h后,再次离心(5 000 g/min,10 min),沉淀为湿直链淀粉。上述保存的沉淀物加蒸馏水配制成质量分数3%,100 ℃水浴摇床加热1 h,离心(5 000 g/min,10 min),所得沉淀加入甲醇配制成质量分数80%,涡旋5 min,离心(5 000 g/min,10 min),沉淀即为湿支链淀粉。湿直链淀粉和支链淀粉冷冻干燥至水分含量<13%,即得到直链淀粉和支链淀粉。
1.2.3 支链聚合度的测定 根据文献[2]修改如下:使用高效尺寸排阻色谱—多角度激光光散射—示差折光联用技术测定支链淀粉的重均分子量(weight-average molar mass,Mw)和数均分子量(number-average molar mass,Mn)。重均聚合度(weight-average degree of polymerization,DPw)、数均聚合度(number-average degree of polymerization,DPn)和分散度(dispersity,D)按式(1)、(2)计算。
(1)
(2)
式中:
DPw——重均聚合度,g/mol;
DPn——数均聚合度,g/mol;
Mw——重均分子量,g/mol;
Mn——数均分子量,g/mol;
162——无水葡萄糖分子量[9],g/mol;
D——分散度,g/mol。
1.2.4 重组菠萝蜜种子淀粉的制备 M1直链淀粉和不同聚合度支链淀粉(M1、M5、M6、M11和BD)按质量比1∶1混合。5种重组JFSS样品分别命名为M1′、M5′、M6′、M11′和BD′。
1.2.5 冻融稳定性测定 根据文献[10]修改如下:样品加蒸馏水配制成质量分数6%,100 ℃水浴摇床加热30 min,将糊状物装入称重后的离心管中密封。-18 ℃下冷冻24 h,30 ℃ 解冻6 h进行交替冷冻和解冻。5 000 g/min 离心10 min,沉淀物称重,此冻融循环重复5次。将每个循环后分离水的重量作为脱水收缩的程度。
(3)
式中:
c——脱水收缩,%;
m1——凝胶分离出的液体重量,g;
m2——离心前凝胶总重量,g。
1.2.6 差式扫描量热仪分析 根据文献[1]修改如下:2 mg 样品与4 μL蒸馏水按质量比1∶2混合,铝坩埚密封,室温平衡24 h。以10 ℃/min从10 ℃加热至100 ℃。测定起始温度(To)、峰值温度(Tp)和终止温度(Tc),通过对峰面积积分计算样品凝胶化焓(ΔHg)。
1.2.7 快速黏度分析仪分析 根据文献[7]修改如下:3 g 样品加入铝筒,再加25 mL蒸馏水。前10 s浆速960 r/min 分散样品,整个试验的剩余时间浆速保持在160 r/min。浆液50 ℃平衡1 min后,以6 ℃/min加热至95 ℃,保持5 min,再以6 ℃/min冷却至50 ℃,保持2 min。记录峰值黏度(peak viscosity,PV)、谷值黏度(trough viscosity,TV)、崩解值、最终黏度(final viscosity,FV)、回生值、糊化温度(pasting temperature,PT)和峰值时间。
1.2.8 X-射线衍射仪分析 根据文献[7]修改如下:分析前,样品50 ℃平衡至水分恒定9%。衍射条件为铜靶,电压40 kV,电流200 mA,Cu-Kα辐射波长0.154 nm。起始角度4°,终止角度40°,发散狭峰1°,防发散狭峰1°,接受狭峰0.2 mm,扫描速度4°/min。相对结晶度按式(4)计算。
(4)
式中:
c——相对结晶度,%;
m1——结晶峰面积;
m2——总面积。
1.2.9 衰减全反射傅里叶变化红外光谱分析 根据文献[10]修改如下:分辨率4 cm-1,扫描次数64次,空气为背景。800~1 200 cm-1区域自去卷积。半带宽26 cm-1,增强因子2.4,计算1 047/1 022 cm-1吸光度高度比。
1.3 统计分析
采用SPSS 19.0软件对数据进行统计分析,统计学上P<0.05为显著,P<0.01为极显著;Origin 8.5软件绘图。
2 结果与分析
2.1 支链聚合度
5种支链淀粉的DPw、DPn和D结果见表1,其范围分别为189 506~431 481,120 370~344 444和1.144~1.574,5种支链淀粉的DPw、DPn和D存在显著差异(P<0.05)。M1支链淀粉的DPw和DPn最低,而BD支链淀粉的DPw和DPn最高。菠萝蜜支链淀粉与前人[11]报道大宗作物淀粉的DPw结果相比,蜡质大米淀粉的DPw(442 154~928 000)较高,而小麦支链淀粉的DPw(4 101~6 463)较低[12]。同时,与DPn的研究结果相比,蜡质大米淀粉(47 483)[13]和大麦支链淀粉(5 726~8 000)[14]的DPn较低。产生上述差异的原因可能是不同的淀粉来源、种植环境和淀粉组成等[15]。D表示分子大小差异范围,M1支链淀粉的D最高,M5支链淀粉样品的D最低,这表明M1分子大小差异最大,M5分子大小差异最小。
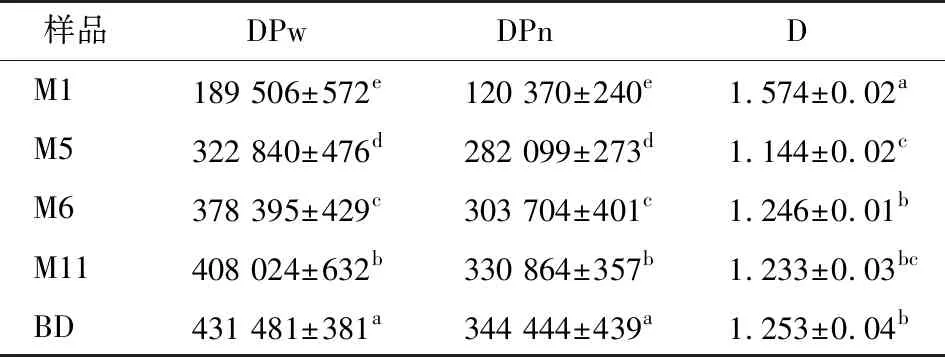
表1 5种JFSS样品的支链聚合度†
† 同列不同字母表示差异显著(P<0.05)。
2.2 冻融稳定性
脱水收缩是反复冻融时水与淀粉凝胶分离的一种现象,可以用于评估淀粉的冻融稳定性[16]。5种JFSS样品的脱水收缩结果见表2,其脱水收缩范围分别为62.47%~72.87%(M1′),61.53%~71.51%(M5′),58.71%~69.69%(M6′),57.23%~68.61%(M11′),56.36%~66.79%(BD′)。以M1′样品为例,冻融循环从第1次到第5次,脱水收缩从62.47%增加到72.87%。根据Katekhong等[17]报道,淀粉凝胶的脱水收缩取决于冻融循环的次数,与本研究结果相同,表明脱水收缩随着冻融循环次数的增加而增加。
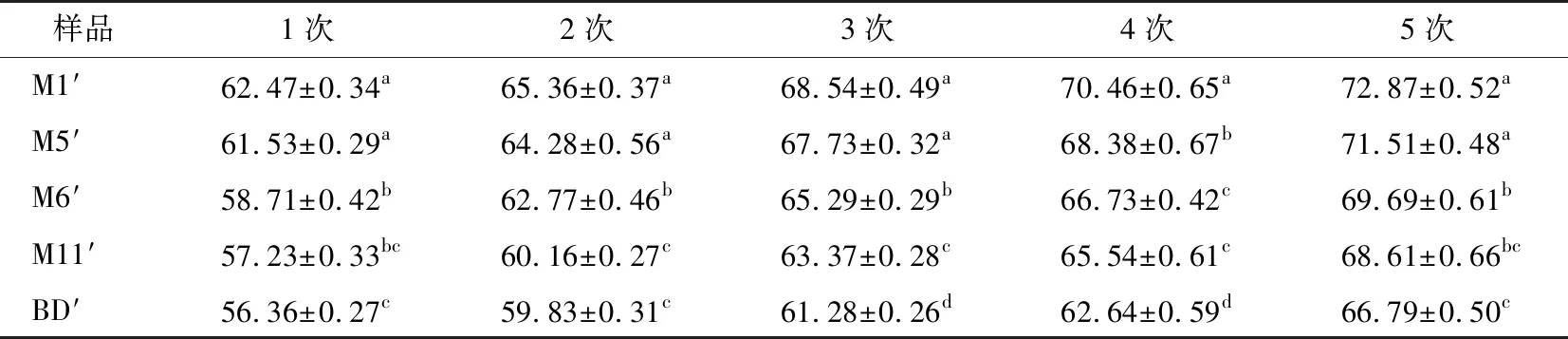
表2 5次冻融循环的脱水收缩†
† 同列不同字母表示差异显著(P<0.05)。
5次冻融循环JFSS样品的脱水收缩范围分别为56.36%~62.47%(1次),59.83%~65.36%(2次),61.28%~68.54%(3次),62.64%~70.46%(4次),66.79%~72.87%(5次)。5种不同支链聚合度的JFSS样品的脱水收缩存在显著差异(P<0.05)。以1次循环为例,M1′的脱水收缩最高(62.47%),BD′的脱水收缩最低(56.36%),其他4次循环中也发现相同的趋势。根据上述研究结果可知,随着支链聚合度降低,脱水收缩逐渐升高。为了更好地解析支链聚合度对JFSS理化特性的影响,本研究通过DSC、RVA、XRD和FTIF进一步分析JFSS的理化特性。
2.3 热特性
5种JFSS样品的热特性见表3和图1,其To、Tp、Tc和ΔHg的范围分别为48.19~52.39,60.39~64.54,75.32~78.47 ℃ 和13.84~15.59 J/g。5种不同支链聚合度的JFSS样品的热特性存在显著差异(P<0.05)。Zhang等[3]报道,天然JFSS的To、Tp、Tc和ΔHg分别为70.49~84.91,76.01~87.83,88.31~96.58 ℃和8.66~16.78 J/g。与上述结果对比,本研究中5种JFSS样品的To、Tp和Tc较低,但ΔHg与天然JFSS相似,可能是由于直链和支链淀粉的比例不同所导致的。已经报道大米[18]和小麦[19]淀粉的To、Tp、Tc和ΔHg分别为55.6~64.4 ℃、63.0~74.0 ℃、70.9~79.6 ℃、9.0~13.0 J/g和55.2~54.1 ℃、59.7~61.0 ℃、74.7~82.7 ℃、16.3~20.9 J/g,JFSS的To、Tp和Tc与大米和小麦淀粉相似,但ΔHg高于大米淀粉、低于小麦淀粉,上述差异可能是不同的种植环境、淀粉来源和淀粉组成所导致[20-21]。
5种JFSS样品的To、Tp和Tc随着支链聚合度增加而增加,ΔHg随着支链聚合度增加而降低。M1′的To、Tp和Tc最低,但ΔHg最高,而BD′的To、Tp和Tc最高,但ΔHg最低。正如Zhang等[1]报道,较低转变温度的JFSS显示较高ΔHg,归因于JFSS形成更多支链微晶,但较为无序,形成的结晶并不完美和稳定。因此,M1′形成的晶体不完美,稳定性不均匀,而BD′显示相反结果。Zhang等[10]表明,ΔHg增加是由于淀粉形成了更多的晶体,因此需要更多能量才能将其熔化。本研究ΔHg的结果表明,与BD′样品相比,需要更多能量破坏M1′样品分子间键实现凝胶化。凝胶化温度范围(R)可以反映凝胶化过程中双螺旋数量和淀粉微晶不均匀性[1]。M1′样品的R最高(27.13 ℃),BD′样品的R最低(26.08 ℃)。因此,M1′样品的双螺旋结构最多但淀粉微晶不均匀,而BD′样品呈现相反结果。
2.4 糊化特性
如表4和图2所示,5种JFSS样品的峰值黏度(PV)、谷值黏度(TV)、崩解值、最终黏度(FV)、回生值和糊化温度(PT)范围分别为2 717~4 755,1 971~3 548,746~1 207,3 158~5 751,1 187~2 203 cP和77.55~81.60 ℃。5种不同支链聚合度的JFSS样品的糊化特性存在显著差异(P<0.05)。天然JFSS的PV、TV、崩解值、FV、回生值和PT分别为2 539~3 233,2 252~2 365,174~981,3 001~4 230,749~1 865 cP和80.15~91.29 ℃[1]。本研究5种JFSS样品的PV、TV、崩解值、FV、回生值高于天然JFSS,但PT低于天然JFSS,这也是由于直链和支链淀粉的比例不同所导致。前人报道小麦[22]和蜡质大米[11]淀粉的PV、TV、崩解值、FV、回生值和PT分别为2 380.5 cP、1 567.3 cP、813.3 cP、3 354.5 cP、1 787.5 cP、70.2 ℃和1 535~2 079 cP、583~769 cP、922~1 351 cP、1 168~1 443 cP、585~787 cP、65.5~71.2 ℃。本研究结果高于小麦和蜡质大米淀粉,原因可能是不同的粒径、膨胀力、直链和支链淀粉组成以及支链淀粉结构等[7, 23]。此外,BD′样品的峰值时间(7.81 min)显著低于其他4种样品的。
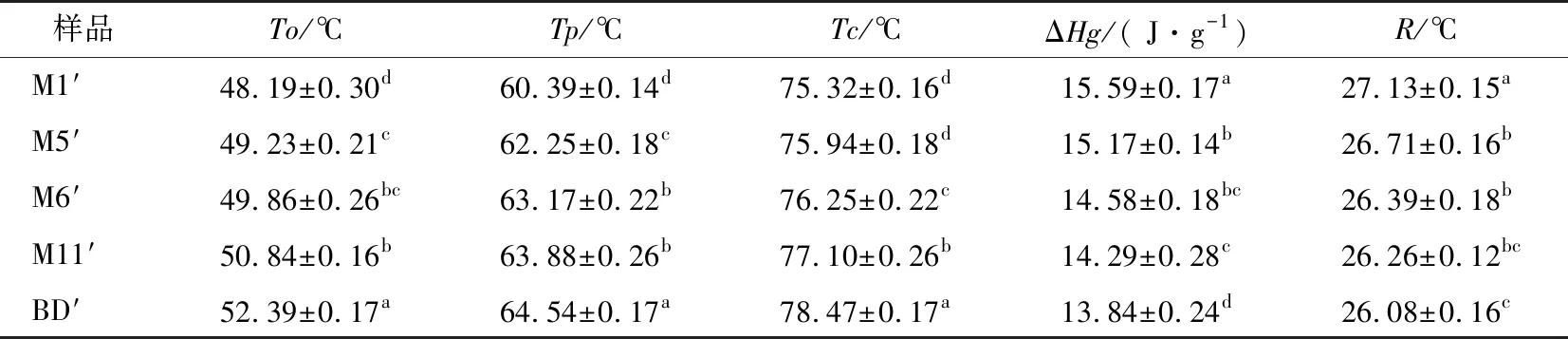
表3 不同支链聚合度JFSS样品的热性质†
† 同列不同字母表示差异显著(P<0.05)。
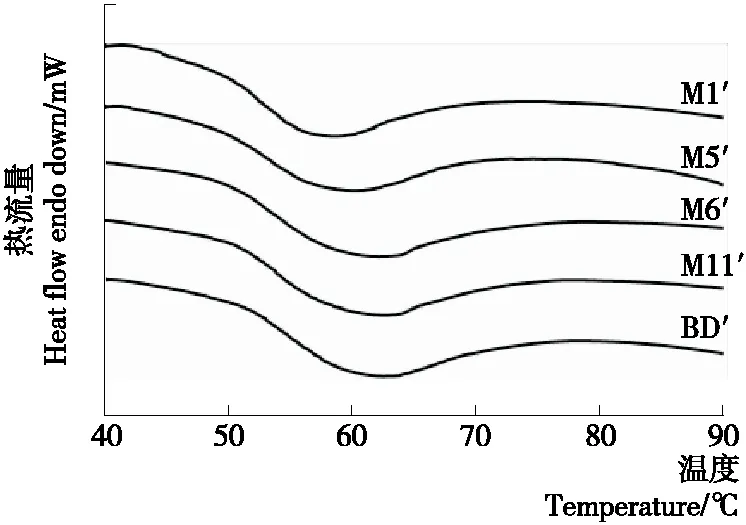
图1 不同支链聚合度JFSS样品的DSC热谱图
Figure 1 DSC thermographs of five JFSS samples with different degree of amylopectin polymerization
M1′样品的PV、TV、崩解值、FV和回生值最高,PT最低,BD′样品的PV、TV、崩解值、FV和回生值最低,但PT最高。糊化温度与DSC检测的转变温度趋势一致。PV低表明淀粉颗粒的硬度较低[11],因此BD′样品比其他样品的硬度更低。TV与膨胀力显著正相关[24],说明BD′样品的膨胀力低于其他样品。崩解值越高,淀粉承受加热和剪切力的能力越低[3],FV高表明加热冷却淀粉糊的稳定性高。因此,BD′样品在高温和机械搅拌下显示比其他样品高的稳定性,但BD′样品加热冷却淀粉糊的稳定性低于其他样品。回生值与淀粉老化显著相关[11],说明BD′样品比其他样品的老化倾向低。BD′样品的糊化温度高于其他样品(表4)。根据上述研究结果发现,5种JFSS样品的支链聚合度增加,PV、TV、崩解值、FV和回生值减小,PT增加,这意味着支链聚合度影响淀粉的糊化特性。RVA结果与DSC获得的结果一致。
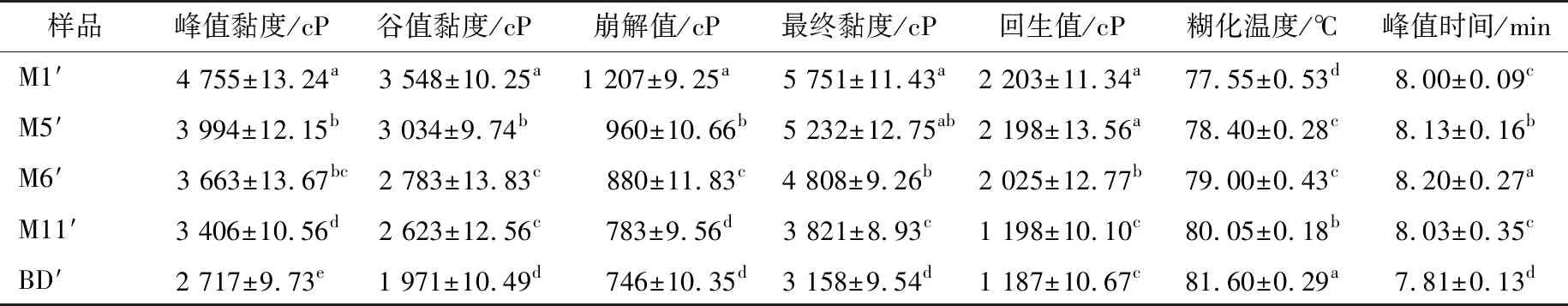
表4 不同支链聚合度JFSS样品的糊化特性†
† 同列不同字母表示差异显著(P<0.05)。
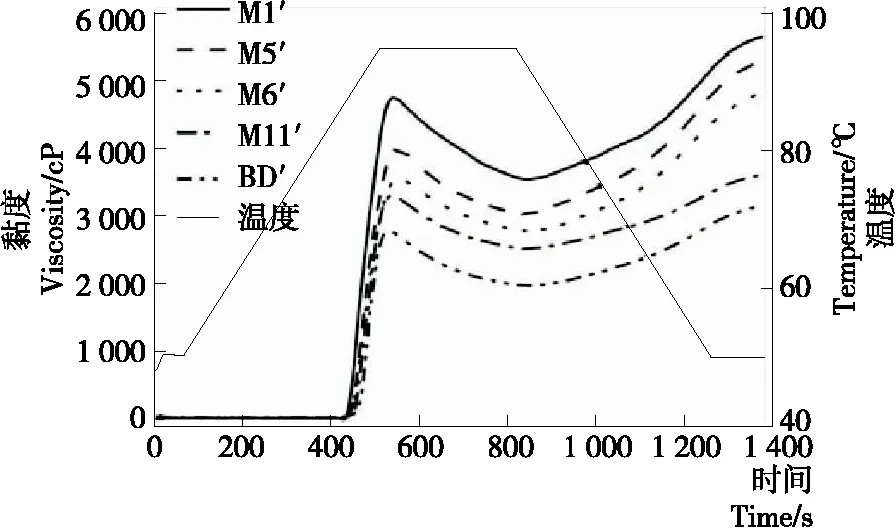
图2 不同支链聚合度JFSS样品的糊化剖面图
Figure 2 Pasting profiles of five JFSS samples with different degree of amylopectin polymerization (n=3)
2.5 结晶结构
5种JFSS样品的结晶结构见表5和图3。Chen等[25]研究表明,2θ角在约15°和23°处显示强衍射峰,并在17°和18°附近显示双重峰,代表典型的A型结晶结构。因此,5种JFSS样品均为A型结晶结构,相对结晶度为27.94%~33.22%。5种不同支链聚合度的JFSS的相对结晶度存在显著差异(P<0.05)。天然JFSS的相对结晶度为24.48%~36.89%,呈现A型结晶结构[1],本研究5种JFSS样品的相对结晶度低于天然JFSS,但结晶结构相同。Zhang等[10]报道,大米淀粉相对结晶度为31.63%,呈现A型结晶结构,这与本研究5种JFSS样品的相对结晶度相似,结晶结构相同。大量文献[26-27]报道支链链长影响淀粉结晶结构,但本研究发现随着支链淀粉聚合度降低,相对结晶度增加。M1′样品相对结晶度最高,BD′样品相对结晶度最低,这意味着支链聚合度也影响淀粉相对结晶度。XRD结果与DSC和RVA的结论一致。
2.6 短程分子序列结构
5种JFSS样品的短程分子序列结构见表5和图4所示。5种JFSS样品的吸光度比值(1 047/1 022 cm-1)为1.45~1.56。5种不同支链聚合度的JFSS样品的吸光度的比值存在显著差异(P<0.05)。Zhang等[10]报道,大米淀粉吸光度比值(1 047/1 022 cm-1)为1.42,5种JFSS样品的吸光度比值高于大米淀粉。根据Wilson等[28]报道,1 047/1 022 cm-1的吸光度比值可用来探测淀粉短程分子序列的有序度,因此JFSS有序淀粉量高于大米淀粉。M1′的吸光度比值最高,BD′的吸光度比值最低,吸光度比值随支链聚合度降低而增加,与DSC、RVA和XRD的结果一致。
表5不同支链聚合度JFSS样品的相对结晶度和吸光度比值†
Table5RelativecrystallinityandabsorbanceratiosoffiveJFSSsampleswithdifferentdegreeofamylopectinpolymerization(n=3)

样品相对结晶度/%吸光度比(1 047/1 022 cm-1)M1′33.22±0.22a1.56±0.02aM5′31.78±0.17b1.53±0.03bM6′30.37±0.26bc1.51±0.02cM11′29.11±0.23c1.49±0.03dBD′27.94±0.18d1.45±0.02e
† 同列不同字母表示差异显著(P<0.05)。
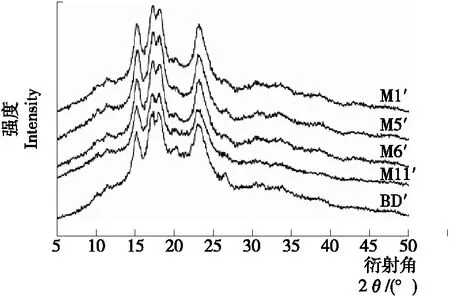
图3 不同支链聚合度的5种JFSS样品的XRD图谱
Figure 3 XRD patterns of the five JFSS samples with different degree of amylopectin polymerization
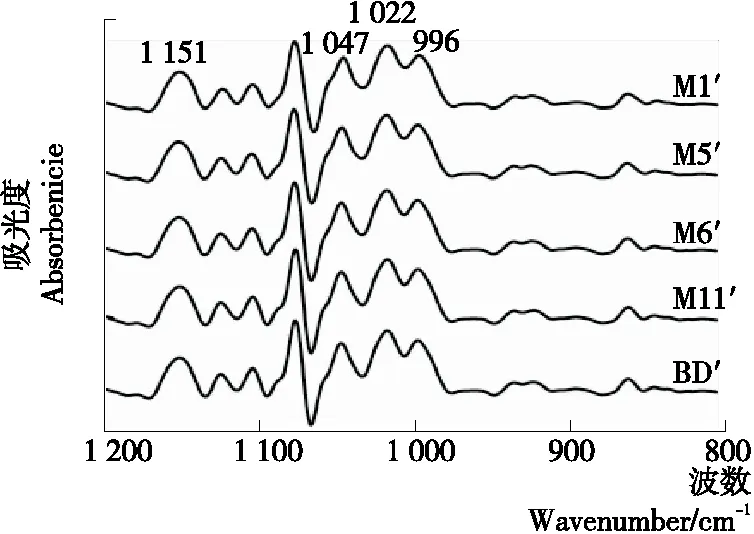
图4 不同支链聚合度JFSS样品的FTIR光谱图
Figure 4 FTIR spectra of five JFSS samples with different degree of amylopectin polymerization
2.7 相关性分析
由表6可知,DPw和To、Tp显著正相关(P<0.05)。DPw和脱水收缩、ΔHg、PV、崩解值、FV、相对结晶度、吸光度比值显著负相关(P<0.05)。上述结果表明,支链聚合度与JFSS理化特性存在显著相关性。
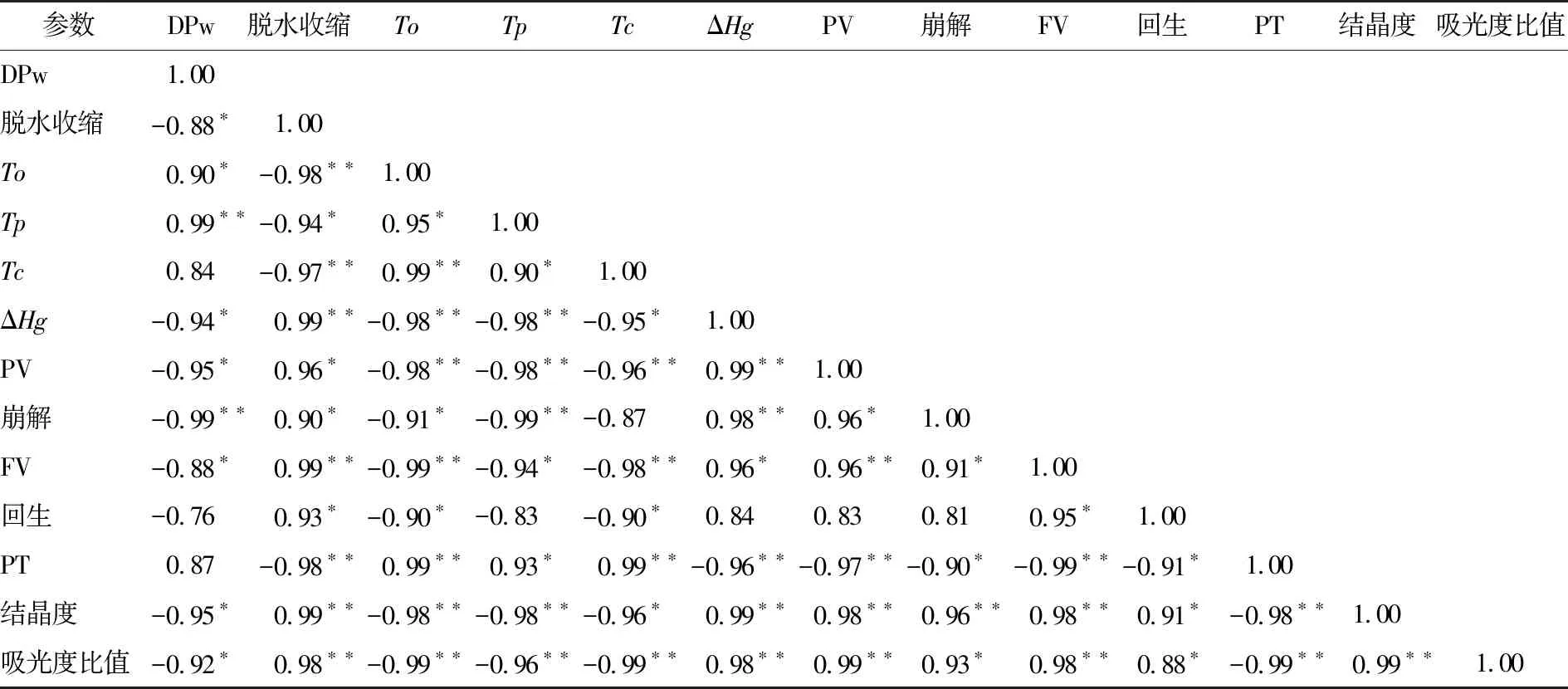
表6 不同支链聚合度的5种JFSS样品和理化特性之间的Pearson相关系数†
† *. 在0.05水平上显著相关;**. 在0.01水平上显著相关。
由表6还可以得出,脱水收缩和To、PT显著负相关(P<0.01);To和ΔHg、PV、崩解值、FV、回生值、相对结晶度、吸光度比值显著负相关(P<0.05);PT和ΔHg、PV、崩解值、FV、回生值显著负相关(P<0.05);相对结晶度、吸光度比值和PT显著负相关(P<0.01);脱水收缩和ΔHg、PV、崩解值、FV、回生值、相对结晶度、吸光度比值显著正相关(P<0.05);To和PT显著正相关(P<0.01);ΔHg和PV、崩解值、FV显著正相关(P<0.05)。PV和崩解值、FV显著正相关(P<0.05);崩解值和FV显著正相关(P<0.05);FV和回生值显著正相关(P<0.05);相对结晶度和ΔHg、PV、崩解值、FV、回生值显著正相关(P<0.05);吸光度比值和ΔHg、PV、崩解值、FV、回生值、相对结晶度显著正相关(P<0.05)。基于不同支链聚合度,5种JFSS样品冻融稳定性、热特性、糊化特性、结晶结构和短程分子有序度之间显示出显著的相关性,同时证实了不同支链聚合度影响JFSS的理化特性。
3 结论
通过冻融稳定性、热特性、糊化特性、相对结晶度和吸光度比值评估了5种不同支链聚合度的菠萝蜜淀粉样品的理化特性。得出结论:随着支链聚合度降低,脱水收缩增加;低支链聚合度的JFSS样品具有高ΔHg、PV、TV、崩解值、FV、回生值和低To、Tp、Tc、PT;支链聚合度逐渐降低,相对结晶度和短程分子有序度增加。Pearson相关分析表明,支链聚合度与JFSS样品理化特性存在显著相关性,理化特性之间存在显著相关性。由于淀粉的使用关键主要在于其糊状物的行为,因此支链聚合度影响淀粉糊化性质还需进一步研究,关于不同来源淀粉理化性质和结构之间的关系也有待进一步深入研究。

