胶原诱导性关节炎病/证模型大鼠血清细胞因子表达谱的初步研究
丁子桐,熊海霞,高琴琴,靖卫霞,袁 芳,侯秀娟,朱跃兰,孙文燕*
(1.北京中医药大学中药学院,北京 102488; 2.北京中医药大学东方医院,北京 100078)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,常表现为持久反复的关节滑膜炎症,导致软骨及骨质破坏,最终造成关节畸形和功能障碍[1]。该病在世界范围普遍存在,严重危害人们的健康,而女性的发病率约为男性的2.5倍。RA的病因及发病机制尚未完全明确,目前尚无根治药物。大量研究证实,RA是一种主要由细胞因子参与介导的慢性炎性疾病。以炎性细胞因子为靶标的生物治疗方法已成为RA研究中的热点。RA属中医“痹证”范畴。痹证病因多为风、寒、湿、热之邪外袭,以致诸邪夹杂痹阻为患[2],寒湿痹、湿热痹是其主要证候类型。抗体芯片技术是通过阵列上的抗体识别样品中的蛋白和其他分子,可以在微小样品中筛查多项指标,具有高度特异性及多样本平行性检测等优势,在疾病诊断和个性化医疗方面已成为可靠的研究手段[3]。本研究应用微阵列抗体芯片检测RA大鼠、寒湿痹大鼠及湿热痹大鼠血清相关炎性细胞因子,分析其细胞因子表达谱的差异。
1 材料和方法
1.1 实验动物
SPF级Wistar大鼠60只,体重160~180 g,左右,由北京维通利华实验动物技术有限公司提供[SCXK(京)2012-0001]。动物饲养于北京中医药大学屏障环境内[SYXK(京)2016-0038],温度21℃~23℃,湿度60%~70%。并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
牛Ⅱ型胶原,美国Chondrex公司,批号130435;弗氏完全佐剂(CFA),美国Sigma公司,批号SLBD8147 V;大鼠RayBio AAR-CYT-G2炎症因子抗体芯片,美国RayBiotech公司。
SHH-500ZSD动物实验箱,重庆市永生实验仪器厂;S10手提式高速分散器,宁波新芝生物科技股份有限公司;Labofuge 400R低温离心机,德国Heraeus公司;电子分析天平,美国Ohaus公司。
1.3 实验方法
1.3.1 RA病/证模型的复制
动物随机分为4组,即正常组、RA组、寒湿痹组、湿热痹组,每组15只。将牛Ⅱ型胶原(type II collagen, CⅡ)与等体积的弗氏完全佐剂(complete Freund’s adjuvant,CFA)充分乳化,制成含CⅡ 1 mg/mL 的乳剂。除正常组外,各组大鼠在无菌条件下,每只左后足底皮内注射100 μL乳剂,7 d后以同种乳剂尾根部100 μL再次免疫,正常组注射生理盐水。
首次免疫第二天,将寒湿痹组和湿热痹组大鼠置于动物实验箱中。其中寒湿痹组设定温度5℃,湿度95%,模拟寒湿外邪;湿热痹组设定温度35℃,湿度80%,模拟湿热外邪。两组均每天刺激4~6 h,连续42 d。
首次免疫后16 d,除正常组外,各组大鼠进行关节炎指数(arthritis index,AI)评分:0分,正常;1分,踝关节出现红斑和轻微肿胀;2分,踝关节到跖关节或掌关节出现红斑和和轻微肿胀;3分,踝关节到跖趾关节或掌关节出现红斑和中度肿胀;4分,踝关节到趾关节出现红斑和重度肿胀[4]。每鼠最大评分16分,大于4分者为模型复制成功。RA组造模成功率约80%,寒湿痹组约73%,湿热痹组约67%。各组造模成功率及AI评分均未见统计学差异。
1.3.2 微阵列抗体芯片检测血清细胞因子表达谱
正常组大鼠及造模后大鼠于首次免疫后第44天,禁食不禁水12 h,腹主动脉采血,3500 r/min 离心10 min,分离血清。每只大鼠取血清50 μL,组内混匀,应用RayBio大鼠炎症细胞因子抗体芯片检测34个细胞因子,主要步骤:①封闭和孵育:将抗体芯片放入试剂盒提供的反应盒中,在每个芯片孔中加入100 μL的1×封闭液,室温孵育30 min。去除封闭缓冲液,每个孔中加入相应的样品100 μL,4℃过夜孵育;去除过量的样品溶液,用不同的洗膜液分别洗玻片。将生物素标记抗体加入相应孔内,每孔70 μL,室温孵育2 h,重复洗膜。每孔加入70 μL的1500倍稀释的荧光剂-链霉亲和素,室温孵育2 h,重复洗膜。②荧光检测:待玻璃芯片完全晾干后用激光扫描仪进行扫描,图像以图片文件保存,荧光信号数据储存为Microsoft Excel 文件。芯片膜上细胞因子名称及位置见表1。将各点测得的原始灰度值除以芯片中的6个阳性对照点平均值,得出标准化后的灰度值,各组间比较,得出表达升高或降低倍数,比值小于0.66或大于1.5者认为有明显差异。
1.4 统计学方法
造模成功率及AI评分采用SPSS 17.0 统计软件进行分析。若数据服从正态分布则选用单因素方差分析(One-way ANOVA),方差齐者用LSD检验;数据不符合正态分布及方差不齐者选用两独立样本的非参数检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 生物学表征观察
正常组大鼠后足踝呈现正常的粉红色,无肿胀,行动自如,舌、耳、尾、爪色泽正常,而单纯RA组大鼠则主要表现为关节红肿,活动受限。除关节肿胀、行走不便外,寒湿痹组大鼠同时有畏寒喜暖,蜷缩少动,大便稀溏,舌、耳、尾、爪黯淡等表现,与中医寒湿痹临床症状相似;湿热痹组大鼠出现躁动,大便粘滞,舌、耳、尾、爪发红等表现,与中医湿湿热痹临床症状相似。
2.2 RA病/证大鼠血清细胞因子表达谱
2.2.1 RA病/证大鼠与正常组大鼠比较
微阵列抗体芯片扫描结果见图1。
由表2可见,与正常组比较,RA病/证组大鼠均出现了细胞因子表达紊乱状态,其中RA组Activin A、CNTF、IFN-γ、TNF-α上调,MIP-3α、MMP-8下调;寒湿痹组CINC-2α、GM-CSF、IFN-γ上调,MIP-3α下调;湿热痹组ICAM-1上调,IFN-γ、MIP-3α、RAGE下调。
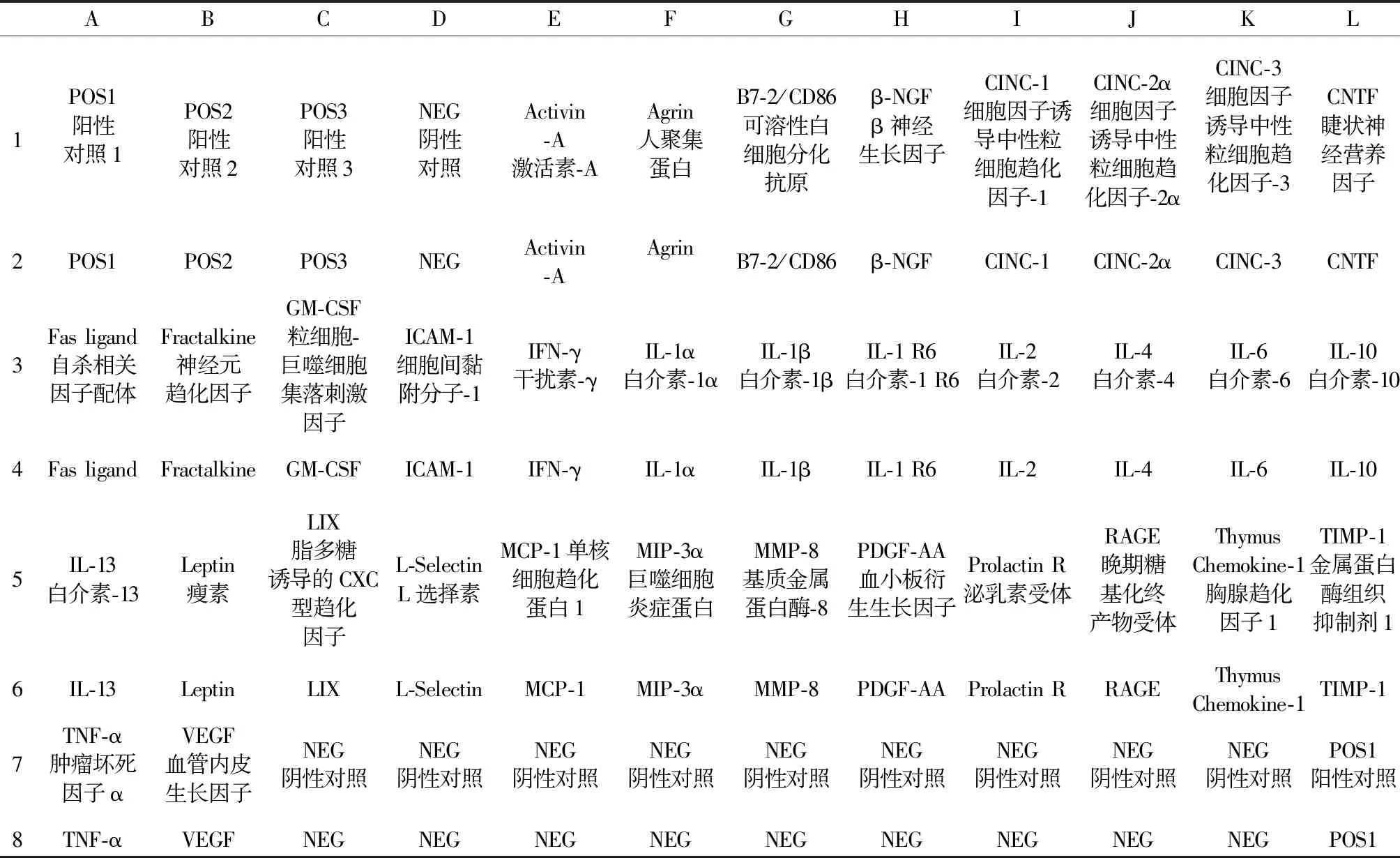
表1 大鼠细胞因子抗体芯片
图1 各组抗体芯片扫描结果Figure 1 Results of antibody chip scanning of each group
2.2.2 RA病/证大鼠各组间比较
由表3可见,与RA组比较,寒湿痹组β-NGF、CINC-2α、MMP-8、PDGF-AA上调,Activin A、TNF-α下调;湿热痹组MMP-8上调,Activin A、CNTF、IFN-γ、IL-1α、IL-6、MIP-3α、RAGE、TNF-α下调。寒湿痹组与湿热痹组比较,CINC-2α、IFN-γ、IL-1α、MIP-3α、PDGF-AA、RAGE蛋白均上调,无明显下调蛋白。
2.3 RA病/证大鼠血清IFN-γ/IL-4比值变化
与正常组相比,RA组及寒湿痹组的IFN-γ/IL-4比值升高,湿热痹组比值明显降低;与RA组比较,寒湿痹组比值升高,湿热痹组比值明显下降。见图2。
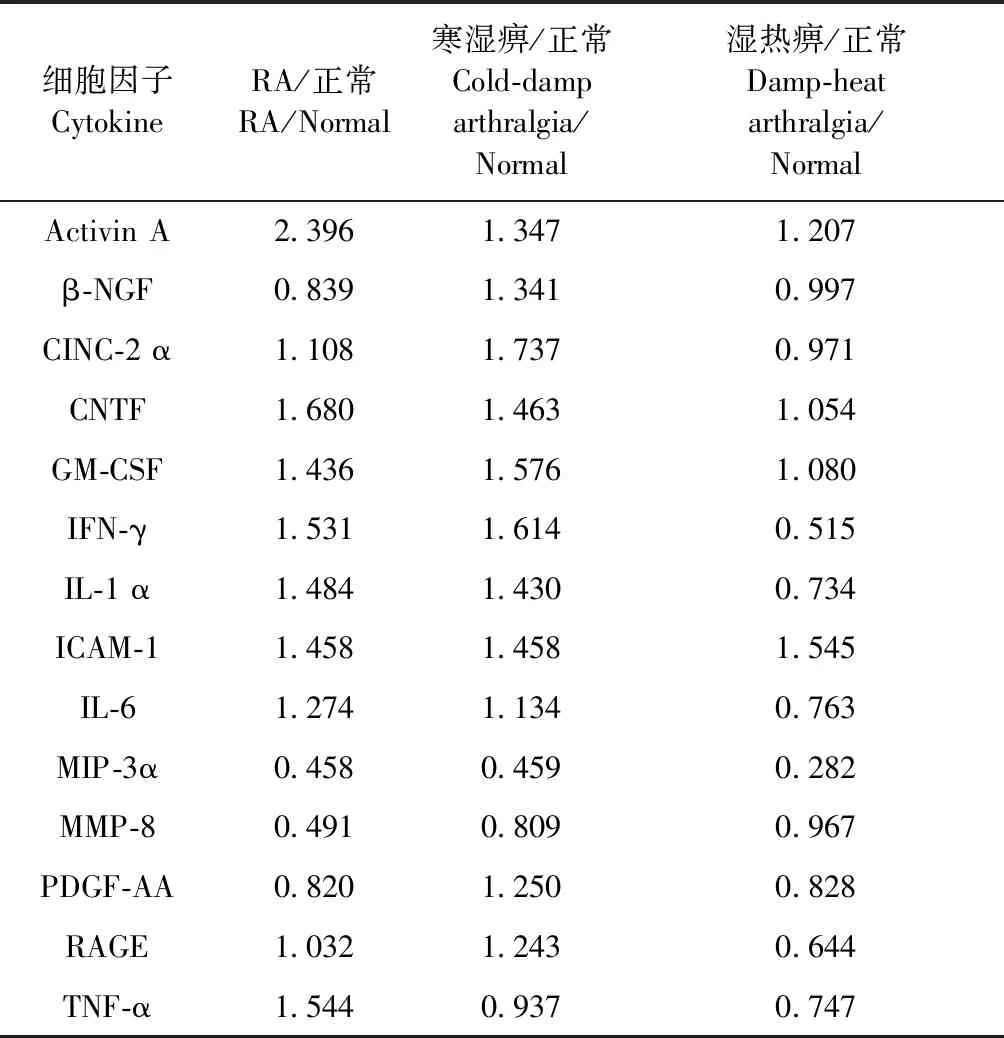
表2 RA病/证大鼠与正常组大鼠的差异表达蛋白
注:Fold change阈值大于1.5,小于0.66者为差异表达蛋白。
Note.Fold change of greater than 1.5 or less than 0.66 represents a differentially expressed protein.
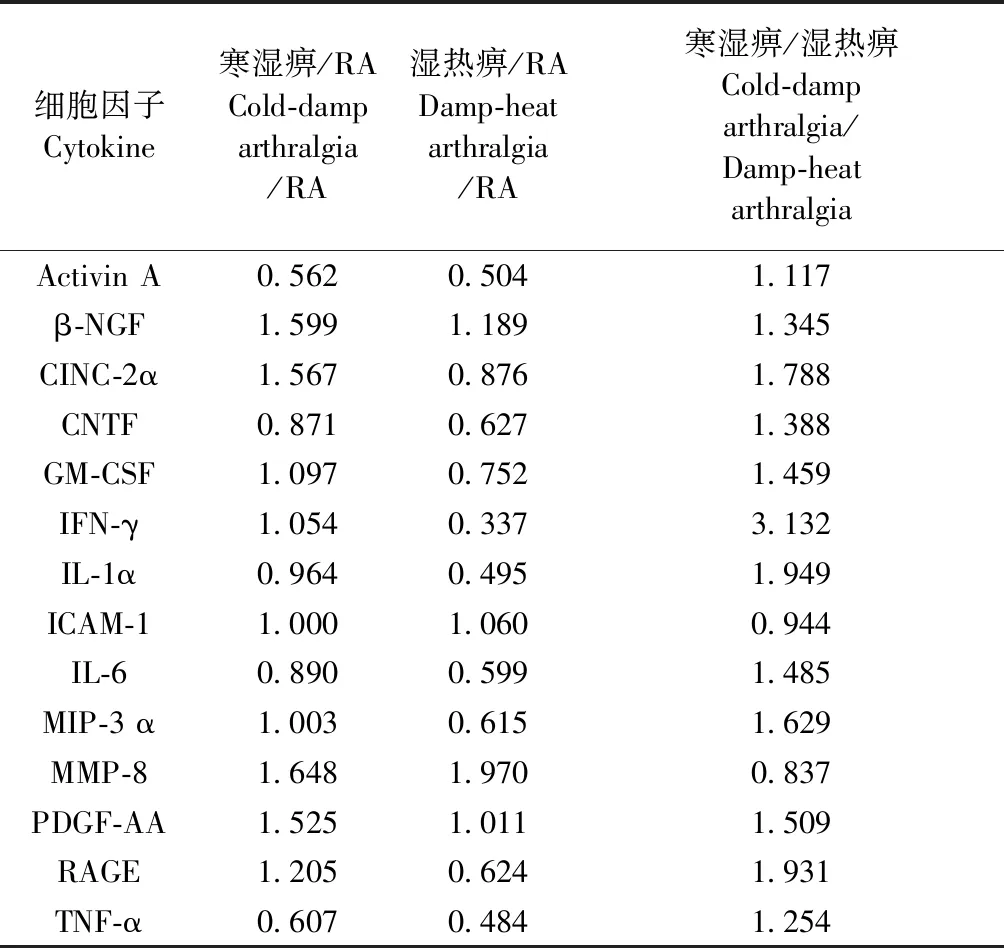
表3 RA病/证组间差异表达蛋白
注:Fold change阈值大于1.5和小于0.66者为差异表达蛋白。
Note. The fold change threshold greater than 1.5 or less than 0.66 is considered as differentially expressed protein.
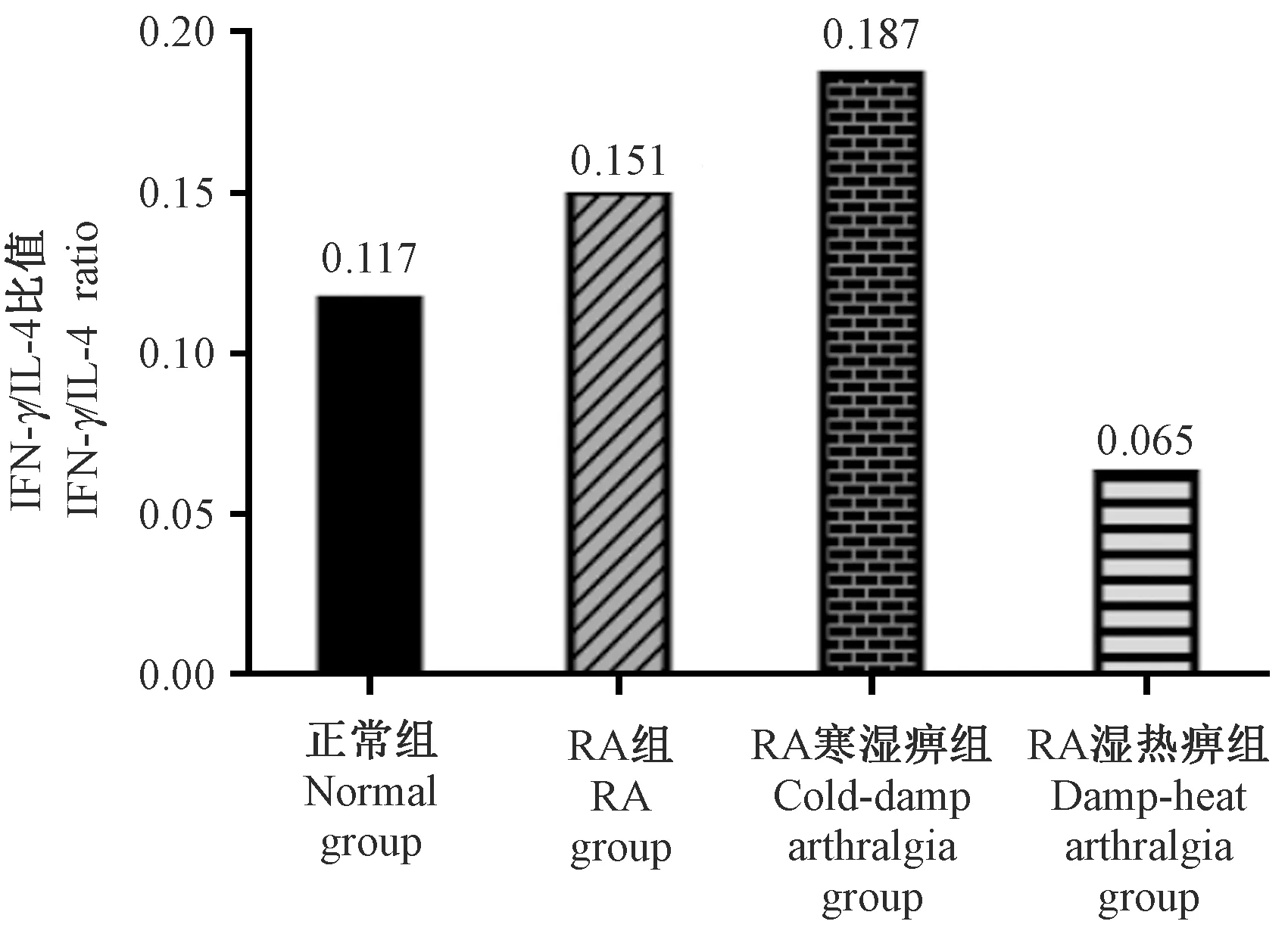
注:各组IFN-γ/IL-4比值为标准化后灰度值的比值。图2 RA病/证大鼠IFN-γ/IL-4比值的变化Note. The ratio of IFN-γ/IL-4 of each group is the ratio of the normalized gray value.Figure 2 Changes in the IFN-γ/IL-4 ratios of the rats in each group
3 讨论
抗体芯片是蛋白质芯片的一种,其技术原理是有序的将各种抗体固定在滤膜、载玻片等载体上,利用抗原-抗体特异性结合反应来捕捉样本中待检测的抗原,然后用标记的有特定荧光物质的抗体与芯片上对应的蛋白质结合,抗体上的荧光将指示对应蛋白质的表达情况。该技术利用少量样本可筛选多项指标,具有高灵敏性、高特异性、高通量性的优点,临床上在疾病诊断、发现疾病标志物和评价治疗效果等多方面有着广泛的应用。
Ⅱ型胶原诱导性关节炎(CIA)和佐剂性关节炎(AA)是目前最常用的类风湿关节炎动物模型。CIA建立较早,也较为成熟,且与人类RA具有很多的相似性,是目前比较公认的研究RA的理想模型[5]。单纯的CIA模型证候特征不明确,难以模拟“风寒湿三气杂至,合而为痹”的证候特点,而单纯的风寒湿和风湿热环境因素并不能引起RA的病理学改变。然而,CIA动物模型在某些证候干预因素作用下,具备证候的潜质,随复加于CIA大鼠干预措施的不同,可将单纯CIA模型转化为肾虚、风寒湿、风湿热等多种证候[6]。因此本实验采用牛Ⅱ型胶原与弗氏完全佐剂皮内注射复制大鼠类风湿关节炎模型,在RA模型基础上采用条件可控的动物实验箱模拟寒湿、湿热环境因素,建立寒湿痹、湿热痹病证结合模型。
目前,有关(风)寒湿痹、(风)湿热痹病证模型的特异性评价指标尚处于探索阶段,缺乏公认的评价标准。有研究发现,单纯Ⅱ型胶原注射或Ⅱ型胶原加风寒湿环境刺激大鼠血清LDH含量较正常组大鼠明显升高,而Ⅱ型胶原加风湿热组低于正常组和Ⅱ型胶原加风寒湿组;Ⅱ型胶原注射加风寒湿环境刺激组血清IgG含量高于正常组,而单纯Ⅱ型胶原注射或Ⅱ型胶原加风湿热组与正常组无明显差异[7]。CFA复加风寒湿刺激大鼠踝关节PGE2含量明显高于正常组大鼠[8],CFA及环瓜氨酸多肽(CCP)足跖注射复加寒湿、湿热环境大鼠血清类风湿因子(RF)、anti-CCP滴度明显高于单纯CFA及CCP足跖注射大鼠,但湿热与寒湿之间比较无统计学差异;单纯造模或造模复加寒湿或湿热环境均能使大鼠血清抗角蛋白抗体(AKA)、抗核周因子(APF)阳性率高于正常对照组,其中造模加湿热环境的阳性率最高,造模加寒湿环境次之,但与单纯造模无显著性差异[9]。细胞因子是引起类风湿关节炎炎症及关节损伤的重要介质,故本研究从细胞因子表达谱着手,观察寒湿痹、湿热痹及单纯RA大鼠相关细胞因子表达的情况,对上述模型的特征进行初步探索。结果显示,RA病/证各组大鼠均出现了血清细胞因子表达谱紊乱状态。与正常组比较,RA组及寒湿痹组多数细胞因子上调,如促炎因子IL-6、IFN-γ及GM-CSF等;湿热痹组ICAM-1上调,IFN-γ、MIP-3α、RAGE下调。GM-CSF可刺激活化巨噬细胞分泌多种促炎性细胞因子如IL-6、TNF-性等,能促进炎症的发展,加速细胞外基质降解和细胞凋亡,并调节Th1型免疫应答。CINC及MIP-3α为趋化因子,是可诱导的、分泌型的前炎症细胞因子[10],其中CINC与人IL-8有着类似的功能,介导细胞在炎症部位聚集、活化以及组织损伤;但RA病/证模型与正常组相比,MIP-3α蛋白表达均下调,与文献存在不一致性,有待进一步研究。CNTF能够微弱抑制外周单核细胞产生IL-8和前列素E2,可在急性炎症反应中诱导肝细胞表达急性期反应蛋白;ICAM-1对炎性反应的发生起到一定作用,二者皆可反映炎症情况。与RA组比较,寒湿刺激后β-NGF表达上调。有研究表明β-NGF被认为是疼痛发生过程中的重要因子,在创伤和炎症部位其表达增加,提示寒湿刺激可增强RA模型的炎症反应[11]。MMP-8是Ⅱ型胶原降解的关键酶[12],其在生理状态下分泌很少,当受到炎性因子刺激后会大量产生,最终导致炎症反应。本研究显示,在RA基础上复加寒湿及湿热刺激均可增强该酶的活性。Activin A可活化炎性细胞释放促炎性因子,还可抑制M2型巨噬细胞分泌促炎因子PDGF[13]。本研究也发现RA复加寒湿模型中activin A和PDGF表达呈负相关。RAGE作为调控炎症因子重要信号通路HMGB1/NF-κB的关键蛋白[14],在湿热刺激下表达下调,具体环节还需进一步探究。
类风湿关节炎的病因和发病机制尚未完全明确,但T细胞功能紊乱,尤其是辅助性CD4+T细胞异常活化,是RA发病过程中的重要机制[15]。在不同的特异性转录因子调控下,辅助性T细胞(Th)分化为不同的细胞亚群,Th1/Th2两种细胞亚群之间存在动态平衡及交互抑制,这种动态平衡一旦被打破,机体则处于Th1占优势或Th2占优势的Th1/Th2失衡状态,并由此而发病。许多研究表明,RA属Th1型疾病,Th1/Th2细胞失衡与RA发病机制密切相关。Th1分泌白介素-2(IL-2)、干扰素-γ(IFN-γ)和肿瘤坏死因子(TNF-α)等细胞因子。IFN-γ是Th1细胞的特征性细胞因子,具有双向的免疫调节作用,它既是单核巨噬细胞主要活化因子,间接发挥促炎作用,又可抑制滑膜成纤维细胞合成基质金属蛋白酶等减少软骨基质降解发挥保护作用[16]。Th2则分泌白介素-4(IL-4)、IL-6等细胞因子,其中IL-4是Th2细胞分泌的特征抗炎性细胞因子,它有抑制Th1合成炎性细胞因子等功能。因此,通常用IFN-γ/IL-4的比值来代表Th1和Th2的比例。本研究中RA组及寒湿痹组促炎因子IFN-γ的表达上调,但湿热痹组表达下调;RA病/证模型组与正常组相比IFN-γ/IL-4比值均出现明显变化,RA组、寒湿痹组大鼠IFN-γ/IL-4比值明显升高,湿热痹组大鼠该比值则明显降低。有研究证实,Th1/Th2细胞及细胞因子在类风湿关节炎不同的发展阶段呈现不同的变化规律,在发病早期阶段Th1细胞高于正常水平,Th2细胞随着Th1细胞的升高而升高,随着病程发展Th1细胞逐渐下降,Th2细胞反而升高从而抑制病情的发展[17]。本研究初步提示CIA大鼠寒湿刺激6周后Th1/Th2失衡加剧,湿热刺激6周则可逆转此失衡并向Th2型转变。导致该变化的确切机制以及造模不同阶段Th1/Th2变化规律尚需探究。
综上,本研究应用微阵列抗体芯片技术检测了胶原诱导性关节炎病/证模型大鼠血清细胞因子表达谱的变化,结果提示病/证因素可影响相关细胞因子的表达,可为深入探讨RA病/证特点及干预靶标提供一定参考,而细胞因子表达谱的动态变化规律尚需进一步研究。

