依达拉奉对缺氧缺血性脑病新生大鼠脑水肿及CD163/HO-1信号通路的影响
韩遵华,段 淼,李清香
(贵州省遵义市第一人民医院新生儿科,贵州 遵义 563002)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是新生儿在围生期因缺氧而引起的缺氧缺血性脑损伤(hypoxic ischemic brain damage,HIBD),临床上常表现为意识障碍、脑水肿、高颅压、肌张力改变等神经系统症状[1]。脑水肿、出血是新生儿HIE早期重要的病理变化,也是导致病情进展和恶化的重要因素[2]。清道夫受体蛋白CD163/HO-1(heme oxygenase-1)信号通路在血红蛋白(haemoglobin,Hb)分解代谢中起着关键作用,还具有抗脂质过氧化和抗炎作用[3-4]。研究发现,CD163、HO-1在脑出血所致脑损伤组织中的表达明显升高,可促进脑水肿吸收,减轻脑组织损害[5]。依达拉奉是一种自由基清除剂,主要用于治疗脑梗塞急性期患者,它可通过清除自由基,避免脂质过氧化,抑制脑、血管内皮和神经细胞的氧化损伤,进而缓解脑缺血引起的脑水肿、脑梗塞[6]。但依达拉奉是否可用于治疗新生儿HIE尚无具体报道。因此,本研究通过建立新生大鼠HIBD模型,探究依达拉奉对HIE新生大鼠脑水肿及CD163/HO-1信号通路的影响,以期为依达拉奉临床应用提供理论指导。
1 材料和方法
1.1 实验动物
SPF级7日龄SD新生大鼠11窝共120只,体重12~16 g,雌雄不限,由重庆第三军医大学野战外科研究所动物室提供[SCXK (渝) 2012 - 0001],饲养于SPF级实验室[SYXK (渝) 2017-0012]。饲养的环境温度: (22±2)℃,相对湿度 50% ~ 60%,光照 12 h /12 h 明暗交替,每笼 5 只。实验过程中按实验动物使用的 3R原则给予人道主义关怀。
1.2 主要试剂与仪器
550D数码相机(日本佳能公司),Image J软件(National Institutes of Health,美国);GIS-2020数码图像分析系统(宁波新芝生物科技股份有限公司)。依达拉奉注射液(规格号:国药准字H200502820,购自南京先声东元制药有限公司),Rat Brain Matrix(Zivic Instruments,USA);2,3,3-三苯基氯化四氮唑(TTC,美国Sigma-Aldrich公司);NCBI Primer Blast设计定量引物序列(由上海生工生物工程有限公司合成);RNA提取试剂盒(美国Invitrogen公司);反转录试剂(宝生物大连公司);实时荧光定量PCR仪(Beckman Couhe公司);组织蛋白提取试剂(南京凯基生物公司);BCA法进行蛋白定量(南京建成生物工程研究所);硝酸纤维素膜(上海基因公司);β-actin兔抗大鼠IgG溶液(美国Sigma公司);二抗稀释液(1∶1000碱磷酶标记山羊抗兔IgG溶液,美国Sigma公司)。
1.3 实验方法
1.3.1 动物模型建立
根据Rice等[7]方法建立HIBD模型,将7日龄SD新生大鼠麻醉后,仰卧固定于手术台,颈部用75%酒精消毒,于颈部正中切口,游离左侧颈总动脉并在远、近心端进行双结扎,缝合伤口并消毒后放回母鼠旁恢复2 h。然后将新生大鼠放入的缺氧玻璃舱内,缺氧舱浸泡在37℃恒温水浴中,同时向舱内不断通入8% O2和92% N2混合气体,持续缺氧2 h。最后将新生大鼠放回母鼠处继续喂养。假手术组新生大鼠只游离左侧颈总动脉穿线但不结扎,缝合伤口后不进行缺氧处理。
1.3.2 分组与给药处理
将术后的90只HIBD新生大鼠随机分为依达拉奉治疗组(即依达拉奉组)和模型组各45只,另取30只新生大鼠行假手术作为假手术组。各组又分为6个亚组即6 h、12 h、24 h、2 d、3 d、5 d组。将依达拉奉注射液用生理盐水(体积比1∶4)稀释为0.3 mg/mL,依达拉奉组在术后立即给予腹腔注射依达拉奉2 mg/kg,间隔24 h给药1次,连续5 d。模型组和假手术组给予腹腔注射等量生理盐水。
1.3.3 脑组织标本的处理
各组新生大鼠在术后相应时间点断头取出脑组织,用10%多聚甲醛在室温下固定24 h,沿左侧脑组织视交叉处冠切,做成石蜡包块,连续冠状切片,进行相关检测。另取每组新生大鼠左侧脑组织于液氮中冻存,待标本集齐后进行后续qRT-PCR和Western blot实验。
1.3.4 2,3,5-三苯基四氮唑一水合物(TTC)染色
造模后24 h,各组随机取4只新生大鼠断头取出脑组织,浸泡在4℃ 0.15 mol/L PBS中5 min,采用Rat Brain Matrix沿大脑冠状面进行切片,切片厚2 mm;将切片浸泡在含2%TTC的0.15 mol/L PBS中,室温孵育30 min;用4℃ PBC冲洗两遍后,于4℃ 10%福尔马林缓冲液中避光固定。照相后,用Image J 1.8.0软件测量梗死面积。红色为正常脑组织,白色为梗死区脑组织。统计参数用梗死面积占同侧脑半球总面积百分比来表示。
1.3.5 脑组织含水量测定
用干湿比重法[8]进行测定,每组新生大鼠在术后时间点处死,断头开颅后迅速将脑组织取出,用电子天平称脑组织湿重(精确到0.1 mg)。然后置于100℃恒温烘箱中24 h左右,待质量恒定后称脑组织干重。按Elliot公式,脑含水量=(湿重-干重)/湿重×100%。脑水肿程度用脑含水量来表示。
1.3.6 qRT-PCR实验
以β-actin作为内参基因,用NCBI Primer Blast设计定量引物序列,引物序列如下:
CD163:上游引物(5′ to 3′):AGCATGGAAG CGGTCTCTGTGATT,下游引物(5′ to 3′):AGCTG ACTCATTCCCACGACAAGA。HO-1:上游引物(5′ to 3′):A CCGCCTTCCTGCTCAACAT,下游引物(5′ to 3′):GGGCGTCTCTGCAGAGGTAG。β-actin:上游引物(5′ to 3′):TAAAGACCTCTATGCCAACACAGT,下游引物(5′ to 3′):CACGATGGAGGGGCCGGA CTCATC。
取出每组液氮冻存的脑组织,利用Trizol法提取RNA,经琼脂糖凝胶电泳检测其完整性,并用紫外分光光度计检测其纯度及浓度。取1 μg总RNA,用反转录试剂合成cDNA。合成cDNA第一链后,取5 μL cDNA(稀释20倍)为模板,加入10 μL 2×SYBR Green qPCR Super Mix、0.5 μL GAPDH(或CD163、HO-1)上下游引物、4.0 μL ddH2O至20 μL,在实时荧光定量PCR仪上扩增。反应条件:预变性95℃ 30 s;扩增40个循环95℃ 5 s,60℃ 35 s。实验进行3次生物学重复。采用2-ΔΔCT法分析qRT-PCR结果,ΔCT=CT目的基因- CT内参基因,ΔΔCT=ΔCT目的基因- ΔCT内参基因。
1.3.7 Western blot分析
取每组大鼠脑组织充分研磨,用组织蛋白提取试剂常规提取蛋白。每组取4 μL蛋白样品,用BCA法进行蛋白定量,调节好蛋白浓度;将蛋白样品与等体积2× SDS缓冲液混合后加热变性;接着通过SDS-PAGE电泳分离上清液;把分离的蛋白质转印到硝酸纤维素膜上;将膜洗涤后在5%牛血清蛋白溶液中室温封闭1 h;洗涤后将膜置于一抗稀释液(1∶100的CD163、HO-1、β-actin兔抗大鼠IgG溶液中,4℃孵育过夜;次晨将膜快速清洗后,转移到二抗稀释液中,在室温下孵育2 h;清洗后用新配制的显色液进行显色,待出现清晰的条带后终止;最后使用GIS-2020数码图像分析系统扫描并分析蛋白杂交条带。
1.4 数据统计分析

2 结果
2.1 SD新生大鼠模型行为观察
术前所有SD新生大鼠生物学行为正常。术后模型组和依达拉奉组新生大鼠在低氧舱中10~15 min后开始出现烦躁不安;缺氧30 min后呼吸频率加快,不能站稳,翻滚,逐渐出现全身震颤,不能翻身,夹尾左旋;1 h后出现嗜睡,不爱活动,精神萎靡,少数出现抽搐情况,均未死亡,呈现先兴奋后抑制行为。假手术组新生大鼠的行为无明显异常。造模后置于正常环境,发现模型组新生大鼠症状逐渐加重,2~3 d时最为严重,6~7 d时症状减轻;依达拉奉治疗后症状也加重,2 d时最为严重,但较模型组明显减轻,3 d内症状改善。
2.2 SD新生大鼠脑组织形态观察
TTC染色结果发现,造模后24 h模型组新生大鼠大脑左半球皮层、海马、纹状体等区域出现水肿、颜色苍白,左半球体积比右半球稍大,而依达拉奉治疗后脑组织损伤程度显著降低。结果见图1A。经定量分析发现,与假手术组相比,模型组和依达拉奉组新生大鼠大脑左半球梗死面积均显著增加(P<0.05)。与模型组相比,依达拉奉治疗后脑梗死面积显著减小(P<0.05)。结果见图1B。
2.3 SD新生大鼠脑组织含水量变化
术后6 h,与假手术组相比,模型组、依达拉奉组新生大鼠脑组织含水量均明显升高(P<0.05),2 d时脑含水量最高。依达拉奉治疗后新生大鼠脑组织含水量明显低于模型组(P<0.05)。结果见表1。
2.4 SD新生大鼠脑组织CD163、HO-1 mRNA表达水平
qRT-PCR结果显示,与假手术组相比,模型组、依达拉奉组新生大鼠脑组织CD163、HO-1 mRNA表达水平均显著升高(P<0.05),在24 h时,CD163 mRNA表达水平达到最高随后趋于平稳,而HO-1 mRNA表达水平达到最高时逐渐下降。但依达拉奉治疗后新生大鼠CD163、HO-1 mRNA表达水平显著高于模型组(P<0.05)。结果见图2。
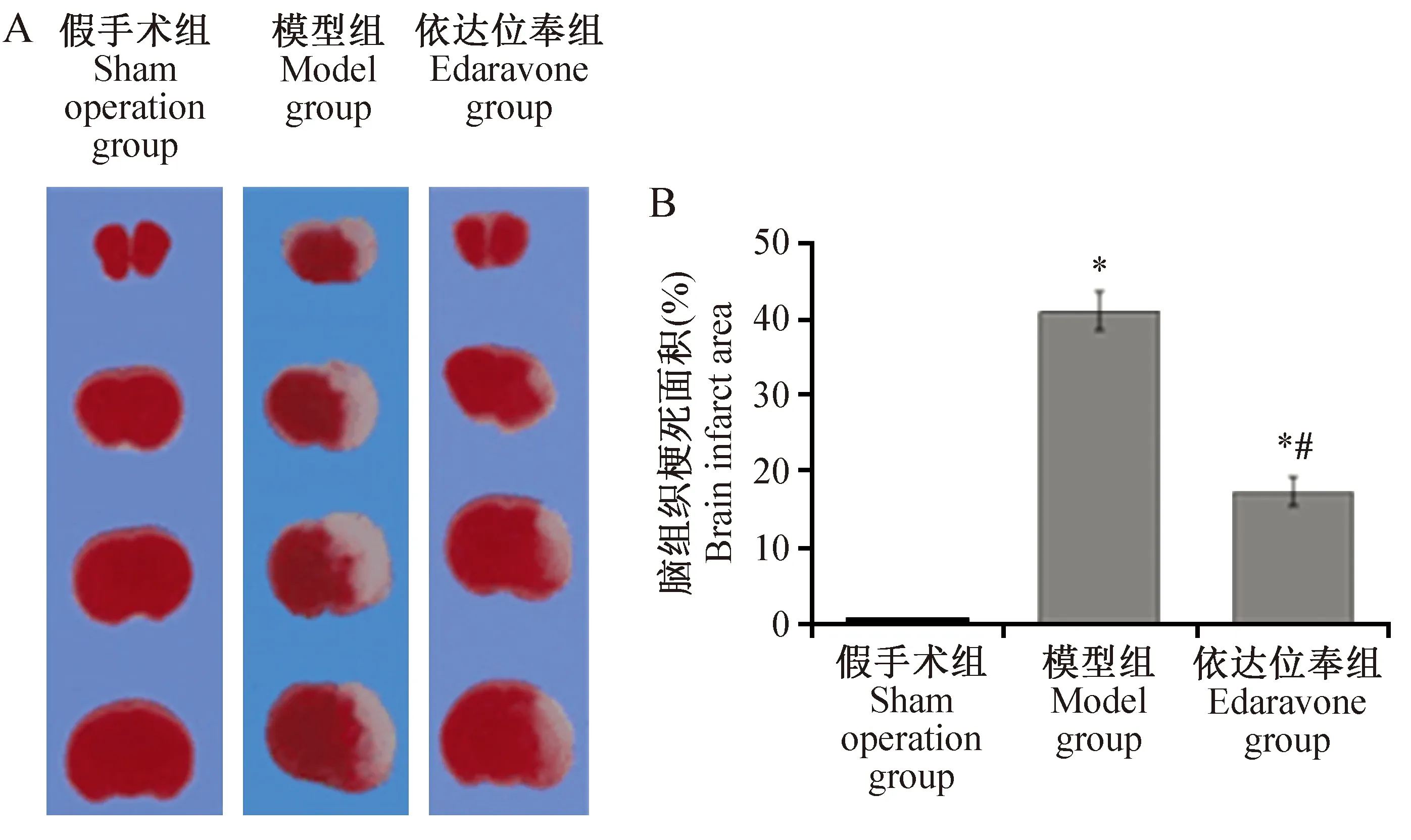
注:A:各组典型脑梗死图片。B:各组脑组织梗死面积。与假手术组相比,*P<0.05;与模型相比,#P<0.05。图1 造模后24 h各组SD新生大鼠脑梗死情况(n=4)Note. A,Typical pictures of brain infarct in each group.B, Brain infart area of each group. Compared with the sham operation group,*P<0.05. Compared with model group,#P<0.05.Figure 1 Infarct size of each group of neonatal rats at 24 h after model establishment
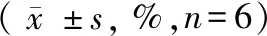
表1 各组SD新生大鼠在不同时间点脑组织含水量变化
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。
Note. Compared with the sham operation group,*P<0.05. Compared with the model group,#P<0.05.
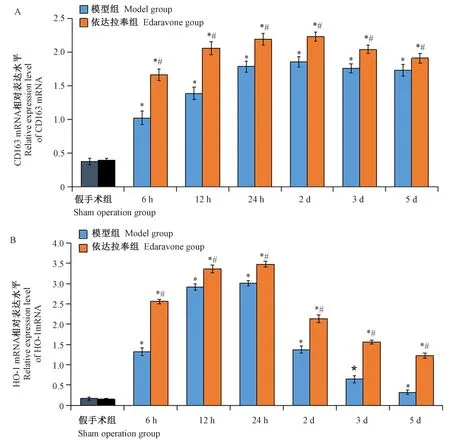
注:A:CD163 mRNA表达变化。B:HO-1 mRNA表达变化。与假手术组相比,*P<0.05;与模型相比,#P<0.05。以β-actin作为内参基因。图2 各组新生大鼠不同时间点脑组织CD163、HO-1 mRNA表达变化(n=6)Note. A,The expressing of CD163 mRNA.B,The expressing of HO-1 mRNA.Compared with the sham operation group,*P<0.05. Compared with the model group, #P<0.05.Figure 2 Changes of the expression of CD163 and HO-1 mRNA in each group of the neonatal rats at different time points
2.5 SD新生大鼠脑组织CD163、HO-1蛋白表达水平
Western blot结果显示,与假手术组相比,模型组、依达拉奉组新生大鼠脑组织CD163、HO-1蛋白表达水平均显著升高(P<0.05),依达拉奉治疗后,新生大鼠CD163、HO-1蛋白表达水平显著高于模型组(P<0.05),与qRT-PCR结果一致。结果见图3。

注:与假手术组相比,*P<0.05。与模型组相比,#P<0.05。图3 各组新生大鼠不同时间点脑组织CD163、HO-1蛋白表达变化(n=6)Note. Compared with the sham operation group,*P<0.05. Compared with the model group, #P<0.05.Figure 3 Changes of the expression of CD163 and HO-1 proteins in each group of the neonatal rats at different time points
3 讨论
新生儿HIE是围生期的常见病,其发病率仅次于新生儿黄疸和肺炎,易造成新生儿死亡,且幸存儿常伴有智力低下、脑瘫、癫痫等神经系统后遗症[8-11]。研究发现脑组织缺氧缺血后,花生四烯酸被环加氧酶、脂氧化酶氧化是引起脑损伤的初步反应,进一步导致氧自由基、一氧化氮、炎症因子等产生增加,胞膜脂质被过度氧化,膜上离子泵遭到破坏,钠离子、钙离子、水分子等进入胞内,导致神经细胞水肿、凋亡以及坏死[12-13]。新生儿HIE目前尚无既安全又有效的治疗手段,因此根据其发病机理寻找新的治疗药物尤为重要。
依达拉奉是临床常用的脑保护剂,其在治疗急性脑梗死、脑出血及其相关疾病具有很好的疗效,它可通过清除自由基防止脂质过氧化;保护脑组织、血管内皮免受氧化损伤,从而减轻脑缺血引起的脑水肿、脑梗塞[14-15],故在理论上它能够治疗新生儿HIE。本研究参照Rice等[7]HIBD模型经典创建方法,选用与新生儿神经发育类似的7日龄新生大鼠,术后缺氧过程中新生大鼠出现呼吸加快、发绀、站立不稳,随后新生大鼠行为能力发生障碍,夹尾旋转;显微镜观察发现结扎侧大脑形态异常,出现脑含水量增加,脑组织肿胀,脑梗死等。与前人造模结果[7]一致。经依达拉奉治疗HIBD新生大鼠后,上述行为学症状明显改善;模型组新生大鼠大脑左侧脑含水量显著增加,脑肿胀程度严重,梗死区域较大,而依达拉奉治疗后左侧脑含水量显著减少,脑肿胀程度减轻,梗死面积显著减小,说明依达拉奉治疗能明显减轻HIBD新生大鼠脑水肿、脑梗死程度。
研究发现,缺氧缺血脑损伤组织中CD163、HO-1的表达明显增加[16-17]。CD163属于富半胱氨酸清道夫受体家族(SRCR)成员,通常分布于单核-巨噬细胞膜表面,在单核细胞发育成巨噬细胞过程中,其表达持续上升。小胶质细胞在生理条件下不表达CD163,在受到Hb刺激后才开始表达CD163。血浆中Hb的主要结合蛋白是触珠蛋白(Hp),Hb-Hp结合物能被单核或巨噬细胞膜上CD163受体摄入胞内,其在内质体中分解为强氧化物——血红素,其生成后可由内质体转移至溶酶体,血红素氧化酶(HO)可催化其代谢为亚铁离子、一氧化碳以及胆绿素,血红素具有很强的神经毒性,易造成继发性脑损伤。HO包括两种亚型:HO-1和HO-2,脑损伤后HO-1在神经系统起关键作用,因此脑损伤后CD163/HO-1途径为Hb分解代谢的重要途径[18-19]。在正常生理条件下,每天约10%红细胞发生退化,退化红细胞内的Hb可通过CD163/HO-1途径分解清除。然而,在病理条件下,CD163/HO-1途径分解Hb的作用加强,CD163、HO-1在脑损伤引起的脑水肿组织中的表达明显增加[20]。此外,CD163还具有抗脂质过氧化、抗炎作用[21]。因此,本研究通过双结扎新生大鼠左颈总动脉并缺氧制作HIBD模型,比较依达拉奉治疗组和模型组中脑水肿组织周围CD163与其下游蛋白HO-1的转录和蛋白表达变化,对依达拉奉治疗与脑水肿组织CD163、HO-1转录和蛋白表达的相关性做了基本的研究和探讨。本研究结果显示模型组、依达拉奉组新生大鼠脑组织中CD163、HO-1的表达水平显著高于假手术组,而且依达拉奉治疗后新生大鼠脑组织中CD163、HO-1的转录和蛋白表达水平明显高于模型组,说明依达拉奉可能通过激活CD163/HO-1信号通路来减轻HIBD新生大鼠脑水肿、脑梗死程度。这充实了CD163/HO-1途径在缺氧缺血脑损伤方面实验研究,为依达拉奉临床治疗新生儿HIE提供了实验依据和理论指导。
模型组新生大鼠脑损伤组织中CD163、HO-1 mRNA和蛋白表达水平显著增加;依达拉奉治疗后新生大鼠脑组织中CD163、HO-1的转录和蛋白表达水平明显增高,且依达拉奉治疗能明显减轻HIBD新生大鼠脑水肿、脑梗死程度。新生儿HIE发生发展的相关因素很多、相关机制复杂,依达拉奉最终在临床上能否治疗新生儿HIE,还需继续深入的研究。

