山羊环状RNA circ_ZCCHC24的鉴定和表达分析
陶 虎,何 雷,熊 琪,张 年,刘 洋,陈明新*
(1.湖北省农业科学院畜牧兽医研究所/动物胚胎工程及分子育种湖北省重点实验室,湖北 武汉 430064;2.华中农业大学动物科技学院,湖北 武汉 430070)
【研究意义】动物组织中存在各种RNA,包括信使RNA、核糖体RNA、非编码RNA等,它们结构不同,功能各异,但都在生命活动中发挥重要作用。【前人研究进展】环状RNA(Circular RNA, circRNA)是一类新型的内源性非编码RNA,具有环状稳定结构和组织表达特异性等特性。目前山羊卵泡circRNA的研究还处于初始阶段,研究其调控山羊卵泡发育的调控作用,可以进一步阐明circRNA的功能和机制,为家畜育种提供理论基础和新见解。CircRNA是在mRNA前体剪切过程中,外显子和(或)内含子的5’端与3’端以反向剪切(Back Splicing)形式连接,最终形成共价闭合环状结构[1-2]。circRNA广泛存在于真核细胞内,具有物种保守性、组织特异性和稳定性等特性[3]。主要通过3种机制发挥调控作用:①CircRNA作为miRNA海绵调控基因的表达;②CircRNA结合RNA结合蛋白(RBP)形成RNA-蛋白复合物,调控线性亲本基因的转录[4];③CircRNA可以编码蛋白质,发挥生物学功能[5-6]。CircRNA调控卵泡发育的研究较为有限。Capel等人在小鼠精子决定基因SRY中发现了circRNA[7],并且SRY也被证实可以吸附miR-138,发挥“miRNA海绵”作用[8]。【本研究切入点】继miRNA和lncRNA后,circRNA已成为非编码RNA研究领域的新热点。近年来对于circRNA的研究日益增多,但是对circ_ZCCHC24在山羊卵泡中的作用机制还未见详细研究。【拟解决的科学问题】本研究以高低繁殖力山羊排卵前卵泡中差异表达的circ_ ZCCHC24为研究对象。对circ_ ZCCHC24是否正确成环进行鉴定,分析它的组织表达特异性,为揭示circ_ ZCCHC24的遗传调控机理提供理论依据。
1 材料与方法
1.1 样品采集
山羊组织(肾、心、肌肉、肝、脾、卵泡和肺)样品采集自湖北省农业科学院种羊场和湖北波尔山羊保种场,山羊选择18月龄的成年母羊;屠宰后10 min内采集肾、心、肌肉、肝、脾、卵泡和肺组织各3份,经PBS清洗后放入去RNA酶的样品采集管内,置于液氮带回实验室进行总RNA的提取,剩余样本放置在-80℃冰箱保存。
1.2 总RNA的提取及反转录
利用天根RNA simple总RNA提取试剂盒来山羊不同组织样品中总RNA的提取,操作按照试剂盒说明书进行,使用NanoDrop 2000型DNA/RNA浓度测定仪,测定DNA浓度和OD值,利用1%琼脂糖凝胶电泳检测RNA的完整性。采用Takara的PrimeScript®RT reagent Kit with gDNA Eraser反转录试剂盒获得cDNA模板。操作按照试剂盒说明书进行,反转录后的cDNA放置于-80 ℃冰箱保存备用。
1.3 生物信息学分析
采用转录组测序技术分析了波尔山羊和麻城黑山羊排卵前卵泡组织中的circRNA,利用生物信息学手段分析转录组测序数据,获得山羊circ_ZCCHC24的全长序列、接头序列和形成结构。
1.4 引物设计
以circ_ZCCHC24的全长序列为模板,利用Primer 5软件设计鉴定山羊circ_ZCCHC24的引物,预期扩增片断长度为78 bp,相关引物信息详见表1,引物由北京奥科鼎盛生物科技有限公司合成。
1.5 PCR扩增
PCR反应总体系50 μl,其中山羊cDNA模板2 μl,I-5TM2×High Fidelity Master Mix试剂 25 μl,上、下游引物(0.4 μM)各2 μl,去离子水加至50 μl。PCR扩增程序为98 ℃预变性2 min,98 ℃变性10 s,60 ℃退火10 s,72 ℃延伸10 s,40个循环;72 ℃延伸5 min,16 ℃保存。PCR仪为Mini CyclerTM基因扩增仪,PCR扩增产物用1.5 %琼脂糖凝胶电泳检测。利用DNA快速纯化回收试剂盒回收目的片段,具体操作按产品说明书进行。
1.6 目的片段测序验证
将PCR产物胶回收产物连接pMD18-T 线性载体质粒,连接反应体系:8 μl纯化后的PCR产物,10×Ligation Buffer 1 μl,pMD18-T质粒1 μl,反应体系于16 ℃金属浴条件下连接1 h。随后加入50 mL DH5α感受态细胞,均匀涂布于LB固体培养基上于37℃培养箱中过夜,阳性菌液送北京奥科生物科技公司测序。
1.7 实时荧光定量PCR(qRT-PCR)
qRT-PCR反应总体系20 μl,其中山羊不同组织cDNA模板各1 μl,SYBR®Green Supermix 10 μl,上、下游引物(0.4 μM)各0.25 μl,去离子水加至20 μl。PCR扩增程序为94 ℃预变性4 min,94 ℃变性15 s,59 ℃退火15 s,72 ℃延伸15 s,40个循环;72℃延伸45 s。仪器采用Mini CyclerTM基因扩增仪,利用2-ΔΔCT方法进行分析。
1.8 荧光原位杂交(FISH)
将麻城黑山羊卵泡组织放入固定液中固定6 h,经梯度酒精脱水后浸蜡包埋,石蜡经切片机切片,62 ℃烤片2 h;切片于修复液中煮沸15 min,滴加蛋白酶K(20 μg/mL)37 ℃消化30 min;滴加预杂交液,37 ℃孵育1 h;滴加含探针circ_ZCCHC24-Probe的杂交液(8 ng/μl),37 ℃杂交过夜后进行洗涤,探针序列详见表1;切片滴加DAPI(4',6-diamidino-2-phenylindole)染液,避光孵育8 min,冲洗后滴加抗荧光淬灭剂封片;处理后的切片利用尼康ECLIPSE CI正置荧光显微镜下观察并采集图像。
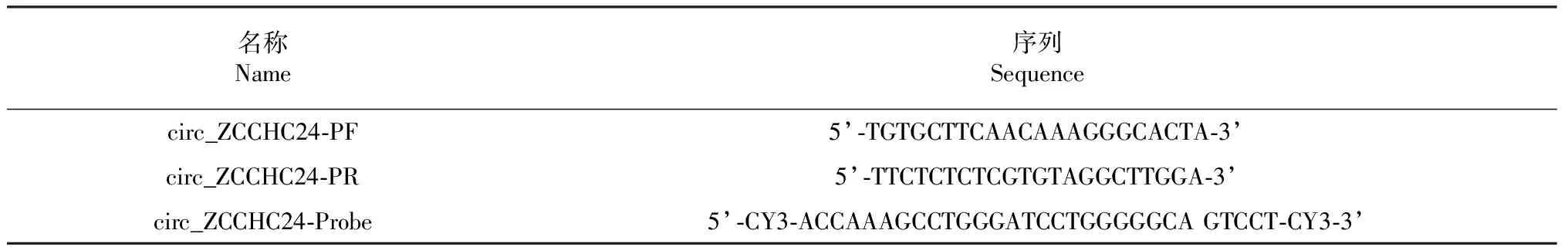
表1 引物与探针信息
2 结果与分析
2.1 山羊circRNA circ_ZCCHC24的生物信息学分析
前期利用转录组测序技术分析了繁殖力显著差异的波尔山羊和麻城黑山羊排卵前卵泡组织中的circRNA,筛选出circ_ZCCHC24在2个山羊品种中的表达存在显著差异。根据转录组测序得出circ_ZCCHC24碱基全长为2045 bp(图1A),接头序列信息如图1B所示。将测序所得circ_ZCCHC24的序列信息在NCBI数据库中进行检索,circ_ZCCHC24的全长序列是由山羊ZCCHC24基因(GenBank登录号:NC_030835.1)的部分第1内含子和全部第2外显子碱基序列环化而成(图1C)。表明circ_ZCCHC24是由外显子和内含子共同组成的circRNA。

图1 山羊circ_ZCCHC24序列信息(A)、接头序列信息(B)及结构示意图(C)Fig.1 Information of goat circ_ZCCHC24 sequence (A), junction sequence (B) and schematic of goat circRNA circ_ZCCHC24 (C)

图2 利用分散引物检测circRNA的示意图(A),分散引物扩增的circ_ZCCHC24 PCR产物电泳图(B)及采用分散引物PCR扩增circ_ZCCHC24接头序列的测序结果(C)Fig.2 Schematic representation of the detection circRNAs using divergent primer (A), electrophoretogram of the circ_ZCCHC24 PCR products obtained with divergent primers (B), sanger sequencing of circ_ZCCHC24 PCR products resulting from amplification using divergent primers confirms head-to-tail splicing (C)
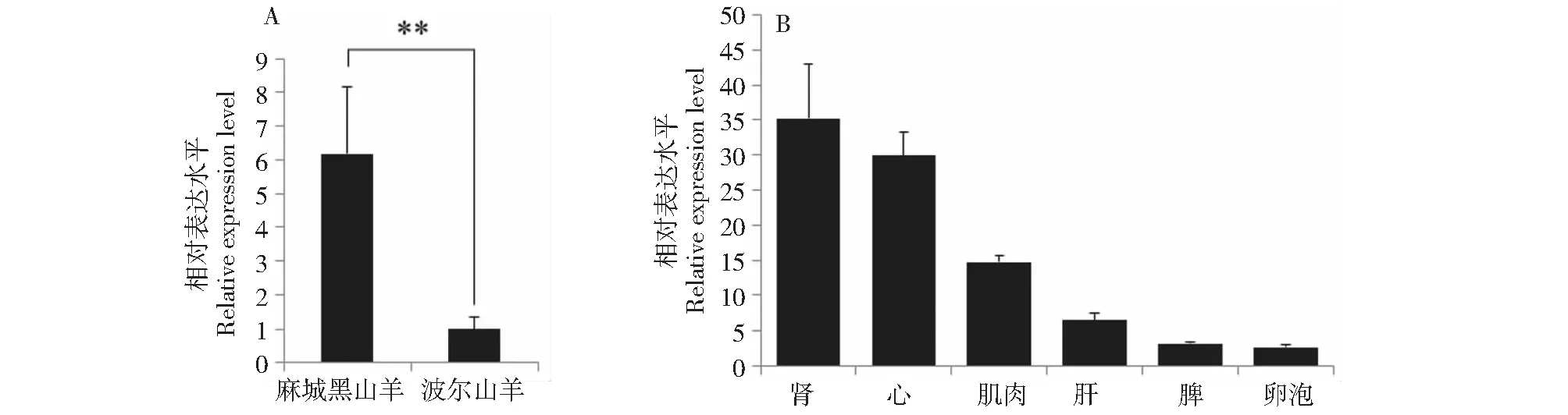
图3 山羊circ_ZCCHC24在不同山羊品种中的表达水平(A)及在波尔母羊不同组织中的表达水平(B)Fig.3 Expression level of circ_ZCCHC24 in two different goat breeds (A) and seven tissues of Boer ewes (B)
2.2 山羊circRNA circ_ZCCHC24的鉴定
为了确定山羊circRNA circ_ZCCHC24是否正确成环,设计了分散引物(Divergent Primer)用于扩增circ_ZCCHC24的接头序列,从而进行成环鉴定(图2A)。利用分散引物的PCR扩增获得了circ_ZCCHC24接头序列产物,经凝胶电泳结果显示circ_ZCCHC24的接头序列顺利扩增,扩增产物长度为78 bp(图2B),再利用Sanger测序进一步证实了接头序列中存在环化位点(图2C)。上述结果表明circ_ZCCHC24在山羊卵泡组织中能够正确成环。
2.3 山羊circRNA circ_ZCCHC24的表达模式分析
通过qRT-PCR分析了circ_ZCCHC24在2个山羊品种中的表达水平,发现circ_ZCCHC24在麻城黑山羊中的表达量远高于波尔山羊(P≤0.01,图3A)。此外,研究了circ_ZCCHC24在波尔母羊肾、心、肌肉、肝、脾和卵泡等不同组织中的相对表达水平,结果发现,circ_ZCCHC24在上述6种组织中均有表达,其中在肾中表达量最高,卵泡中表达量最低(图3B)。表明circ_ZCCHC24的表达水平具有组织特异性。
2.4 山羊circRNA circ_ZCCHC24的细胞定位
为了检测山羊circ_ZCCHC24在山羊卵泡颗粒细胞中的细胞定位情况,针对接头序列设计了CY3标记的探针,利用荧光原位杂交(FISH)技术进行了细胞定位分析,结果显示,circ_ZCCHC24定位于山羊卵泡颗粒细胞的胞质中(图4)。表明circ_ZCCHC24可能发挥作用的形式是通过吸附miRNA来完成的。
3 讨 论
哺乳动物卵泡的产生是一种由原始卵泡发育成排卵前卵泡的连续复杂过程[9]。其中,卵泡颗粒细胞在卵泡发育过程中发挥重要作用,为卵母细胞提供必需的生长因子和特定蛋白质,卵泡颗粒细胞的增殖可诱导卵泡的生长和卵母细胞的成熟[10]。卵泡发生的复杂性表现在卵母细胞的发育需要众多基因组成的调控网络来发挥作用[11]。然而,动物卵泡发育和颗粒细胞增殖的决定性调控机制仍需要进一步研究。
长久以来,非编码RNA被认为是一种转录垃圾,不发挥任何作用。然而越来越多的研究表明,包括miRNAs、circRNAs、piRNA和lncRNA等在各种生物学过程中发挥重要的调控功能[1, 12-14]。尤其circRNA更是成为现在基础研究领域的热点,因此,我们以高低繁殖力山羊排卵前卵泡中差异表达的circRNA circ_ ZCCHC24为主要研究对象,对其进行成环鉴定,分析其结构和表达分布情况。
通过生物信息学分析发现circ_ ZCCHC24由山羊ZCCHC24基因的部分第1内含子和第2外显子环化而成。circRNA的成环来源类型分类,包括外显子来源的circ RNA、内含子来源的circRNA和外显子和内含子共同组成的circ RNA[15]。本研究证实的由部分内含子和完整外显子组成的circ_ ZCCHC24,则可能是一种新的circRNA来源类型。利用sanger测序技术明确了circ_ ZCCHC24的接头序列,从而证明circ_ ZCCHC24是真正的circRNA。利用测序技术明确接头序列是检验circRNA是否正确成环的金标准[1]。分析了circ_ ZCCHC24的表达模式,发现其具有显著的组织特异性,其中在波尔山羊的肾脏中表达最高,在脾和卵泡中表达最低,由于circ_ ZCCHC24本身实在波尔山羊卵泡中低表达,因此上述表达模式结果符合预期。
CircRNA在生物体内发挥重要的调控作用,CircRNA在细胞核内调控来源基因(Host gene)的表达[16],在细胞质内则发挥内源性竞争RNA(competing endogenous RNAs, ceRNA)的作用[17]。为了检测circ_ZCCHC24在山羊卵泡颗粒细胞中的细胞定位情况,利用FISH技术对circ_ZCCHC24进行了颗粒细胞定位分析,结果显示circ_ZCCHC24定位于山羊卵泡颗粒细胞的胞质中(图4),表明circ_ZCCHC24可能发挥“miRNA海绵”的功能。后续将开展与circ_ZCCHC24具有结合关系的miRNA的筛选和验证工作。
4 结 论
本研究首次对山羊卵泡差异表达的circRNA circ_ZCCHC24进行了初步研究,对其进行了成环验证、表达分析和细胞定位。为后期进一步研究circ_ZCCHC24调控母羊卵泡发育的分子机理,挖掘出高产母羊的特有调控通路奠定了基础,也为高繁殖力山羊品种的培育提供新靶点。

