Lp(a)对老年慢性心力衰竭患者发生心房颤动的预测价值
朱慎慎,吴照科,胡艳敏
近几年,随着我国老龄化进程的加快以及社会和工作压力越来越大,心脑血管疾病的发生率逐年上升并呈年轻化趋势,严重威胁国民的生命健康和生活质量。慢性心力衰竭(CHF)属于心血管疾病的终末病症之一,是由于心脏结构或功能严重损伤,导致心输出量明显降低,无法满足机体需求,从而引发一组复杂的临床综合征,是造成患者残疾甚至死亡的主要原因,多伴发心律失常[1]。心房颤动(AF)是临床上危害性较大的室上性心动过速,而AF长时间的心室率不规则以及心房收缩功能不全会进一步加重心衰[2]。因此积极探索AF的发病机制以及敏感的预测指标成为心血管治疗领域的重要课题之一。血清脂蛋白a[Lp(a)]是上个世纪发现的与多种心血管疾病密切相关的炎性因子[3],但是目前关于Lp(a)与CHF患者不良事件发生风险以及治疗转归的相关性研究尚少。基于上述理论分析,笔者希望通过本项研究探讨Lp(a)对CHF患者发生AF的预测价值,为临床用药指导提供理论依据。现研究报告如下:
1 资料与方法
1.1 研究对象与分组连续入选2014年2月~2017年2月于郑州大学第二附属医院老年医学科确诊并接受治疗的老年CHF患者162例,其中男性83例,女性79例,年龄为65~86(74.21±3.30)岁,根据纽约心脏协会(NYHA)关于心功能分级标准[4],Ⅱ级29例,Ⅲ级96例,Ⅳ级37例。纳入标准:经二维超声心动图、心电图、实验室检查以及X线胸片检查等确诊为心力衰竭患者;所有患者符合2014年由中华医学会心血管病学分会颁布的《中国心力衰竭诊断和治疗指南》关于CHF的诊断标准[5];所有患者符合纽约心功能分级(NYHA)Ⅱ~Ⅳ级;具有完整的临床资料;由患者或家属签署知情同意书。排除标准:不符合上述纳入标准的患者;发病前合并低血压、心源性休克、脑卒中、原发性肺动脉高压者;合并多脏器功能障碍综合征者;合并严重肝肾功能衰竭、恶性肿瘤、神经系统疾病、血液系统疾病、严重出血倾向、甲状腺功能异常者;需要行机械通气者;对他汀类药物过敏及不能耐受者;临床资料不全者。
根据既往有无AF病史和入院时心电图检查结果,47例患者为CHF合并AF(AF组),115例患者未合并AF(非AF组)。本项研究已获得我院伦理委员会的审查批准。
1.2 方法
1.2.1 治疗方式所有入选患者入院后均接受规范的抗心力衰竭药物治疗,包括洋地黄类药、利尿剂、硝酸甘油、血管紧张素转化酶抑制剂或血管紧张素Ⅱ受体拮抗剂等。另外还包括对因治疗(治疗基础疾病和消除诱因)和常规护理干预(休息和控制钠盐的摄入等),患者病情好转出院后,如无禁忌,均适量服用心力衰竭的治疗药物如血管紧张素转换酶抑制剂(依那普利等)、β受体阻滞剂(美托洛尔等)、醛固酮受体拮抗剂(安体舒通、呋塞米等);、血管紧张素Ⅱ受体拮抗剂(氯沙坦、替米沙坦等)等治疗。
1.2.2 样本采集所有受试者经过夜禁食12 h后,次日清晨取坐位,取肘静脉血,加入枸橼酸钠抗凝,4℃ 3000 r离心10 min,分离血浆,于-80℃冰箱保存,采集血标本完毕后测量身高、体重及血压。
1.2.3 血液生化指标及Lp(a)检测采用AU5821全自动生化分析仪(美国Beckman Coulter公司)检测总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)等血脂指标;采用离子交换高压液相色谱法、上海华臣生物试剂有限公司的MQ6000及配套试剂盒测定糖化血红蛋白(HbA1C);采用德国IBL公司的ELISA试剂盒检测血浆Lp(a);采用葡萄糖氧化酶法测定空腹血糖(FPG)和餐后2 h血糖(2 hPG)。
1.2.4 心功能检查采用HV-Preirus超声诊断仪(日本日立)检查,检测患者左室射血分数(LVEF)、左心房内径(LAD)、每博量(SV)等。
1.3 统计学处理所有数据均采用SPSS 17.0统计学软件分析,计量资料采用均数±标准差(x±s)表示,两组间均数的比较采用t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验;采用多因素logistic回归模型分析CHF合并AF发生的危险因素;采用受试者工作特征(ROC)曲线确定Lp(a)的诊断价值。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较两组患者年龄、性别构成比例、体质指数(BMI)、心功能分级、基础血压值、合并高血压病、糖尿病、吸烟史比例比较,差异均无统计学意义(P均>0.05)(表1)。
2.2 两组患者血糖和血脂水平比较入院时,两组患者FPG、2hPG、TC、HDL-C水平基本一致,无统计学差异(P均>0.05)。但是AF组患者HbAlc、TG、LDL-C和Lp(a)水平与非AF组患者比较,差异有统计学意义(P<0.05)(表2)。
2.3 两组患者心功能比较入院时,AF组患者LVEF和SV均低于非AF组患者,而LAD值高于非AF组患者,差异有统计学意义(P均<0.05)(表3)。
2.4 多因素Logistic回归分析CHF合并AF的发生风险以CHF合并AF的发生作为因变量,将HbAlc、TG、LDL-C、Lp(a)、LVEF、LAD和SV作为自变量,采用多因素logistic回归模型分析CHF合并AF发生的危险因素,Lp(a)水平升高、LVEF、LAD均是CHF患者发生AF的独立危险因素(P<0.05),(表4)
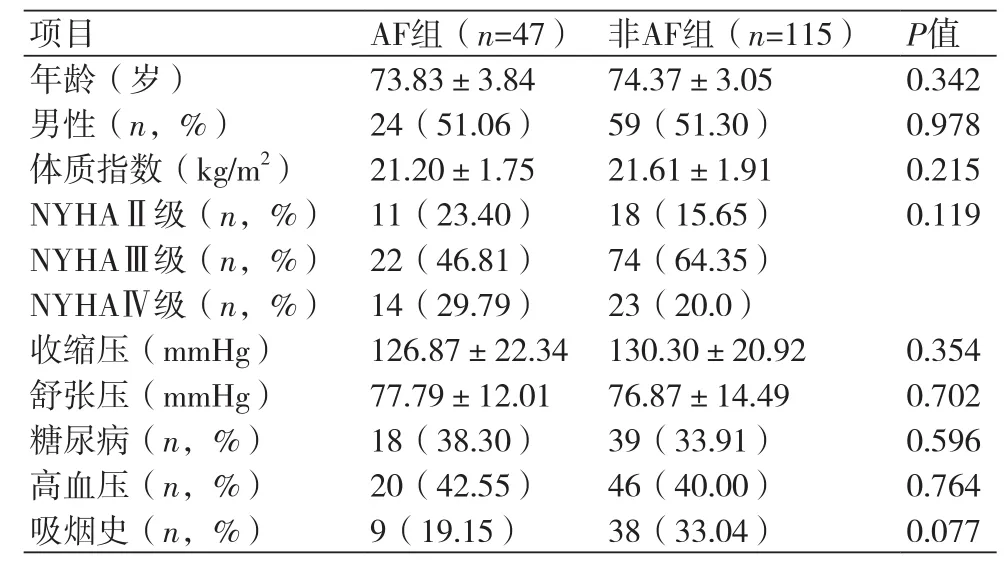
表1 患者的一般临床资料分析

表2 两组患者血糖和血脂水平比较(x±s)
2.5 ROC曲线分析Lp(a)对CHF合并AF的诊断价值经ROC曲线分析,曲线下面积为0.826(95%CI:0.748~0.903,P<0.01),截断值为345 mg/L,提示血清Lp(a)水平可用于判断CHF患者是否合并AF(图1)。

表3 两组患者心功能比较(x±s)
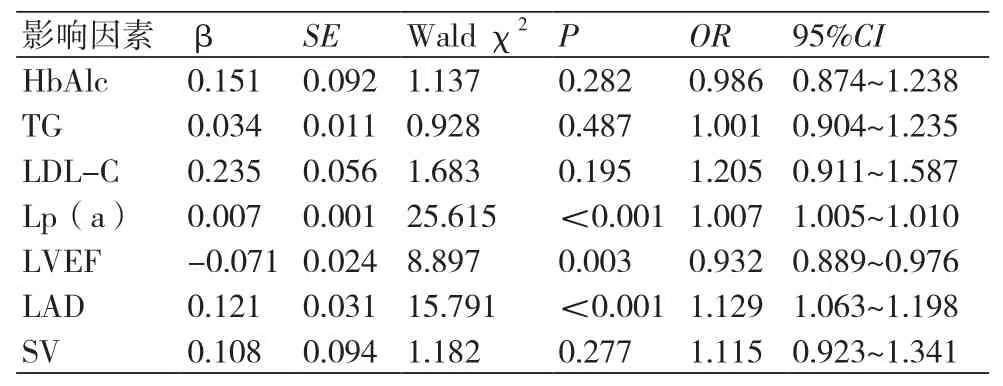
表4 多因素logistic回归分析

图1 CHF合并AF患者血清Lp(a)水平的ROC曲线图
3 讨论
心力衰竭是由心脏结构或功能异常引起的一系列血流动力学障碍综合征,尤其是慢性心力衰竭是心肌梗死、心肌炎等大多数心血管疾病的终末期表现,患者预后较差,大大增加我国的医疗负担。有研究显示,大部分CHF患者伴有不同程度的心律失常[6]。AF是最常见的室上性心动过速型心律失常,是导致卒中、痴呆甚至死亡的最主要的风险因素[7]。AF发生机制复杂且不明确,但与心房重构和炎症反应的相关性已经得到大量研究的证实和认可[8]。血清脂蛋白a属于研究较为成熟的一类LDL样脂蛋白,由肝脏合成,且在外周血循环中的含量较为稳定,可作为冠心病发展和转归的重要指标[9,10]。但是目前国内外尚未见研究探讨血清Lp(a)水平与AF发生的相关性。Lp(a)作为一类重要的促炎性因子,与心肌细胞电生理活动紊乱以及心功能受损密切相关。有研究认为,Lp(a)结构中有与血小板受体特异性结合的区域亚基,因此可能会促使心房附壁血栓的形成[11]。但也有研究认为,Lp(a)并不是血栓形成的独立危险因素[12]。因此关于Lp(a)水平升高是否可引起不良心血管事件一直存有争议。在本项研究中,笔者通过ELISA法检测CHF患者外周血Lp(a)水平,发现Lp(a)水平升高与LVEF、LAD都是CHF患者发生AF的独立危险因素。笔者认为这主要是与Lp(a)可造成炎症反应以及对纤溶系统的干扰作用有关。
进入本世纪以来,随着我国老龄化进程的加快,加之环境因素的影响和生活工作压力的增大,冠心病的发病率呈逐年增加的趋势,其慢性并发症逐渐成为威胁人类健康的主要原因之一[12]。AF主要表现为心房不协调地快速蠕动,从而影响心功能,并形成心房内附壁血栓[13]。目前临床上主要依靠常规心电图、动态心电图和超声心动图作为AF最主要的诊断手段,但是由于AF患者临床表现各异,有的甚至无症状,延误就诊,另外有些患者为阵发性AF,即使就诊也并不能找到确切的心电图证据,易导致漏诊[14],因此,寻找敏感、便捷、快速的血清学检测指标对于AF的早期诊断具有十分重要的临床意义。关于Lp(a)对CHF患者发生AF风险的预测值也是心血管领域专家一直探讨但仍存有争议的问题。既往一项涉及130多万人的大型荟萃分析结果显示,Lp(a)>30 mg/dl是心肌梗死发生的风险阈值[15]。但是欧洲动脉粥样硬化协会建议Lp(a)的安全阈值为50 mg/dl[16]。因此关于Lp(a)诊断阈值在多种心血管疾病领域都存在一定的争议。但是目前尚未见有文献明确报道关于Lp(a)对CHF患者发生AF的诊断阈值讨论。在本项研究中,通过对ROC曲线分析,Lp(a)的截断值为345 mg/L,即Lp(a)>345 mg/L的CHF患者发生AF的风险大大增加,建议行动态心电图等检查进行确诊。
综上所述,笔者着重探讨了外周血Lp(a)表达水平与老年CHF患者AF发生风险的相关性,建议临床密切监视老年CHF患者外周血Lp(a)的表达水平,若出现异常升高,建议临床医生给予相关的干预措施,以降低AF的发生率。

