人参皂苷Rb3通过Neuregulin-1/ErbB信号通路对心肌梗死大鼠VE-cadherin,NRG-1,ErbB2,ErbB4表达的影响
韩凌,张晶晶,秦立
心肌梗死(MI)是在冠状动脉粥样硬化狭窄基础上,发生的急性、持续性的缺血、缺氧导致的心肌缺血性坏死[1],常引起心律失常、休克或心力衰竭等合并症,且发病快、死亡率高,对人们的生命健康造成了极大的威胁[2]。随着医学技术的发展,MI的病死率虽有所降低,但对心肌细胞造成的损伤却是不可逆的,因此,尽可能地减轻心肌不可逆的损伤是现在临床急需解决的问题,那么,深入的研究MI的发病机制十分重要。
人参皂苷Rb3是从五加科植物人参的根、花蕾、茎叶和西洋参的根、茎叶及三七的茎叶中分离提取的三萜类中药单体[3]。有研究报道,人参皂苷Rb3可改善神经功能缺损,缩小脑梗死面积,缓解脑水肿,可通过抗氧化作用保护脑缺血损伤,阻滞钙通道,且对MI后心室重构具有明显的保护作用[4,5],但其具体的作用机制并不明确。神经调节蛋白-1(NRG-1)是一种表皮生长因子,在心血管系统中广泛表达,其通过与酪氨酸激酶受体ErbBs结合调节心血管系统[6]。有研究表明,NRG-1可激活多重下游信号通路,进而维持心肌细胞的正常功能[7]。保护内皮细胞结构及功能的完整性可有效预防动脉粥样硬化,而血管内皮细胞钙黏蛋白(VE-cadherin) 是内皮细胞特异性钙黏蛋白,参与血管内皮细胞(EC)之间粘着连接[8],其通过与VEGFR2、PI3K、VE-PTP和NRG-1等信号传递蛋白结合,调控EC内多条信号通路与基因的表达[9],且另有研究表明,VE-cadherin是血管生成和维持血管稳定的主要分子[8]。因此,本研究拟通过建立大鼠MI模型,观察人参皂苷Rb3通过Neuregulin-1/ErbB信号通路对MI大鼠VE-cadherin,NRG-1,ErbB2,ErbB4表达的影响,以期从Neuregulin-1/ErbB分子信号通路揭示人参皂苷Rb3对MI的作用机制,为减轻MI的损伤提供新的途径和靶点。
1 材料和方法
1.1 药物、试剂及仪器人参皂苷Rb3,白色粉末,20 mg/支,纯度98.7%(北京索莱宝科技有限公司);Masson三色染色试剂(南京森贝伽生物科技有限公司);NRG-1、ErbB2单克隆抗体、ErbB4单克隆抗体(Abcam公司);VE-cadherin试剂盒、化学发光试剂盒(美国R&D公司);山羊抗小鼠IgG(北京索莱宝科技有限公司)。YB-6LF组织石蜡切片机(OLYPUS公司);低温离心机(赛默飞世尔科技有限公司);电泳槽(Thermo Stratos公司);HMIAS彩色医学图文分析系统(武汉千屏影像技术有限责任公司);光学显微镜(GE公司);外科手术器械(北京中元健邦医疗器械有限公司)。
1.2 实验动物8周龄健康雄性SD大鼠60只,清洁级,体重220±20 g,购自北京维通利华实验动物技术有限公司。采用标准的饲养条件喂养,在新环境中适应1周后进行实验。
1.3 制备动物模型及分组给药使用Olivetti方法建立AMI大鼠模型[10]:腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉大鼠,将大鼠仰卧位固定,经气管插管实施机械通气,打开胸腔使心脏暴露,用无创丝线于左心耳和右心室流出道之间结扎冠状动脉左前降支(LAD),当前降支供血区变苍白,且ECG有2个或2个以上导联J点抬高>0.2 mm时,急性心肌梗死(AMI)模型建立成功,后挤压胸腔排出空气,关闭胸腔。
5 0只S D大鼠造模后随机分为5组:模型组(M o d l e)、人参皂苷R b 3低剂量组(G-R b 3-L)、人参皂苷R b 3中剂量组(G-R b 3-M)、人参皂苷R b 3高剂量组(G-Rb3-H)及阳性药物组(地尔硫卓),另10只大鼠为假手术组(Sham),假手术组大鼠的所有手术过程同上,但不结扎。
术前1周至手术当天,对6组大鼠进行称重并灌胃给药,1/d:G-Rb3-L组给予10 mg/kg的人参皂苷Rb3,G-Rb3-M组给予20 mg/kg的人参皂苷Rb3,G-Rb3-H组给予40 mg/kg的人参皂苷Rb3,阳性药物组给予20 mg/kg的地尔硫卓,且于术后4 h和10 h再分别给药一次,Model组和Sham组大鼠于同时间点给予等体积生理盐水。
1.4 心肌组织病理学检查造模24 h后戊巴比妥麻醉大鼠,眼眶静脉采血2 ml备用,后断头处死大鼠,取心尖部位组织,4%多聚甲醛固定,石蜡包埋,切片约厚4 μm,通过HE、Masson染色分别观察心肌组织的病理变化与心肌纤维化程度。利用光学显微镜观察心肌组织的病理变化。使用HMIAS彩色医学图文分析系统定量分析心肌胶原容积分数(CVF=同一图像中胶原面积/所测视野面积)。每张切片选取5个视野,取其均数,并依据病理诊断进行梗死面积的估测[11]:MI面积百分比=(缺血心肌质量/ 左心室湿质量)×100%
1.5 采用ELISA法检测血浆中的VE-cadherin的水平将眼眶血以3000 r/min离心10 min,取血清,-20℃保存。检测步骤严格按照酶联免疫检测试剂盒说明书进行操作, 使用双孔测定,测量各孔的吸光度(OD) 值,依据标准曲线计算VE-cadherin的浓度。
1.6 Western blotting法检测NRG-1、ErbB2和ErbB4蛋白的表达取大鼠左心室组织100 mg,制成匀浆,裂解,12 000 r/min低温离心25 min,取上清液,进行总蛋白质定量。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后,电转至硝酸纤维膜,TBST缓冲液4℃封闭过夜,加入一抗(即鼠抗人NRG-1、ErbB2及ErbB4)。TBST洗膜,然后加入二抗(山羊抗小鼠 IgG),室温下孵育1h,TBS洗膜后,使用化学发光试剂盒显色,曝光显影。以β-actin为内参,计算各组灰度值比。
1.7 统计学分析所得数据采用SPSS 20.0软件进行分析,Image J 4.2对图片进行扫描处理。计量资料用(x±s)表示,多组间均数比较采用oneway ANOVA检验,两两比较采用LSD-t检验;计数资料用百分比表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠心肌组织病理学变化的比较HE染色结果如图1所示,Sham组大鼠心肌组织纤维层次明显,呈均匀分布,未见梗死病灶,无心肌纤维化及炎症浸润现象;Model组大鼠心肌组织纤维消失,缺血坏死处心室壁变薄,有大量局灶性梗死、瘢痕以及炎性细胞浸润;G-Rb3-L组大鼠心肌组织出现局部坏死,心肌细胞排列不清晰,界限模糊;G-Rb3-M组大鼠心肌细胞核聚集,细胞边界模糊,有炎性浸润现象;G-Rb3-H组大鼠心肌细胞完整,排列整齐,界限清晰,细胞间质有空泡样改变;阳性药物组大鼠心肌细胞完整,排列规整,细胞间质可见轻度水肿,结果表明,大鼠心梗后出现心肌细胞坏死及炎性浸润,人参皂苷Rb3可减少心肌坏死面积,减轻炎性浸润。
Masson三色结果如图2所示,Sham组大鼠心肌纤维细胞呈暗红色,间质胶原均匀分布,呈蓝色;Model组大鼠胶原组织蓝染部分较多,心肌组织纤维化明显;G-Rb3-L组、G-Rb3-M组、G-Rb3-H组及阳性药物组大鼠中胶原组织蓝染部分明显少于Sham组,纤维化程度明显减轻,上述结果表明,MI可诱发大鼠心肌纤维化,而人参皂苷Rb3可减轻心梗导致的心肌纤维化的程度。
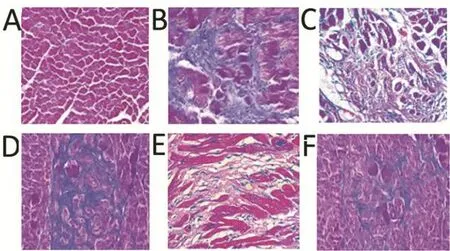
图2 各组大鼠心肌组织Masson三色结果(×200)
2.2 各组大鼠MI面积百分比的比较由表1可知,Sham组大鼠心肌组织正常,无梗死面积。Model组大鼠MI面积百分比最大,阳性药物组MI面积百分比最小,两组比较差异有统计学意义(P<0.05);G-Rb3-L组梗死面积百分比与Model组差异无统计学意义(P>0.05),即10 mg/(kg·d)的G-Rb3给药剂量对减轻大鼠MI损伤无明显作用;G-Rb3-M组及G-Rb3-H组梗死面积百分比均低于Model组(P<0.05),但G-Rb3-M组与G-Rb3-H组相比无差异(P>0.05);与阳性药物组相比,G-Rb3-L组、G-Rb3-M组及G-Rb3-H组的MI面积百分比均明显增大(P<0.05)。此结果表明,G-Rb3在给药剂量为20 mg/(kg·d)与40 mg/(kg·d)时能明显减小大鼠MI面积。
2.3 各组大鼠血清中VE-cadherin的表达ELISA检测结果见表2所示,与Sham组比较,其他各组大鼠血清中VE-cadherin的表达均升高(P<0.05)。与Model组大鼠比较,G-Rb3-L组VE-cadherin的表达水平无明显差异(P>0.05),而G-Rb3-M组,G-Rb3-H组及阳性药物组中VE-cadherin的水平均降低(P<0.05)。人参皂苷Rb3各剂量组大鼠中VE-cadherin的水平均高于阳性药物组(P<0.05)。此结果表明,MI会导致血清VE-cadherin水平增高,在给药剂量为20 mg/(kg·d)与40 mg/(kg·d) 时,G-Rb3可降低VE-cadherin的表达,在一定程度上发挥促进血管形成及保护血管内皮功能的作用。
2.4 大鼠心肌组织中NRG-1,ErbB2,ErbB4蛋白的表达Western blotting 检测结果如图3A,B显示,Model组与G-Rb3-L组大鼠心肌组织中的NRG-1蛋白表达量无差异(P>0.05),均低于其他四组(P<0.05),G-Rb3-M组与G-Rb3-H组亦无差异(P>0.05),且均低于阳性药组(P<0.05)。上述结果表明,MI可导致NRG-1蛋白表达降低,而G-Rb3可增加NRG-1蛋白的表达,具有一定的心肌保护作用。
图4~5结果显示,与Sham组比较,各组中ErbB2、ErbB4的蛋白表达量均显著降低(P<0.05); 与Model组相比较,G-Rb3-M组、G-Rb3-H组及阳性药物组中ErbB2、ErbB4的表达量均明显增加(P<0.05),而Model组与G-Rb3-L组ErbB2、ErbB4的表达无差异(P>0.05),G-Rb3-M组与G-Rb3-H组ErbB2、ErbB4的表达无差异(P>0.05),且均低于阳性药物组(P<0.05)。上述结果表明,MI可降低ErbB2、ErbB4蛋白的表达,而G-Rb3可增加ErbB2、ErbB4蛋白的表达,G-Rb3可以通过调节NRG-1/ErbB信号通路中的相关蛋白保护心肌细胞,减轻MI引起的损伤。

表1 各组大鼠心肌梗死情况的比较(x±s)
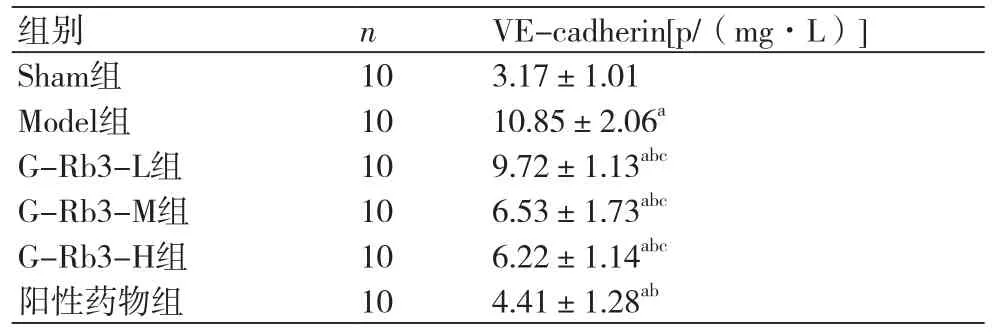
表2 各组大鼠血清中VE-cadherin水平的比较(x±s)
3 讨论
MI是由冠状动脉粥样硬化形成血栓,导致冠状动脉堵塞,心肌缺血而引起的心肌坏死,是临床常见的心血管疾病[2,12]。其高发人群为中老年人,且预后效果不佳。近年来,MI检出率在我国逐年攀升,每年以至少50万例递增,严重危害人们的生命健康[13],但实际上有效的预防措施可以避免心肌梗塞的发生或减轻其带来的损伤,减少心肌坏死范围,改善症状[14],因此寻找一种减轻MI损伤的药物成为临床研究的热点。
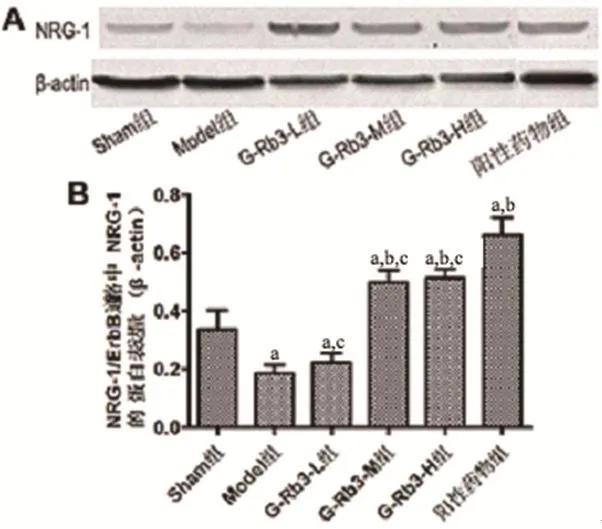
图3 A,B 各组大鼠心肌组织中NRG-1蛋白的表达
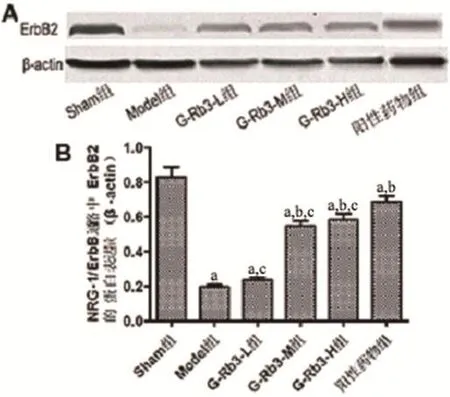
图4 A,B各组大鼠心肌组织中ErbB2蛋白的表达

图5 A,B 各组大鼠心肌组织中ErbB4蛋白的表达
人参皂苷Rb3是从人参、西洋参、三七等提取出的主要活性成分,具有保护脑组织、内皮细胞及心血管系统的生理活性[15]。有研究发现,人参皂苷Rb3可以降低低氧损伤导致的细胞膜通透性,减少NOS表达,抑制NOS的活性,保护缺血低氧性脑损伤[3]。另有研究发现,人参皂苷Rb3具有抗细胞过脂质化、抗炎、抗自由基及影响心肌酶参与体内能量代谢的作用,可减轻大鼠的心肌缺血再灌注损伤[16]。本研究结果显示,人参皂苷Rb3可以降低MI面积,减轻心肌纤维化程度,对心肌细胞具有一定的保护作用。
相关研究表明,NRG-1/ErbB信号通路具有保护心肌细胞结构和功能、促进细胞增殖和存活、抑制细胞凋亡、增强心肌细胞对葡萄糖摄取能力、抑制氧化应激、促进炎症修复、抑制心肌纤维化及促进血管新生等作用[6,17],可见NRG-1/ErbB信号通路是心肌细胞内重要的信号通路,与心肌细胞功能的正常发挥,心梗后心肌细胞的损伤均有密切的关联,NRG-1与ErbB2,ErbB4是该通路中的重要信号因子,NRG-1是心脏中主要表达于心内膜和微脉管内皮细胞的一种表皮生长因子[18],ErbB2和ErbB4受体则分别分布于心房肌和心室肌细胞[6]。有研究结果显示,在糖尿病心肌病变的动物模型中发现,心肌细胞NRG-1蛋白的表达水平、ErbB2、ErbB4磷酸化及mRNA表达均减少[19],另有研究表明,小鼠在应对急性缺血性损伤转为心衰时,与对照组相比,ErbB2,ErbB4的mRNA和蛋白水平均下降[6]。VE-cadherin属于Ⅱ型钙粘蛋白,对血管的形成以及维持血管内皮的正常功能具有重要作用[8,20],有研究显示,MI组VE-cadherin的水平明显高于对照组[21]。本研究结果表明,MI大鼠中,NRG-1,ErbB2和ErbB4蛋白表达量显著减少,VE-cadherin蛋白表达显著增加;经过人参皂苷Rb3干预后增加了NRG-1,ErbB2和ErbB4的蛋白表达量,降低了VE-cadherin的表达量,由此可见,人参皂苷Rb3可能通过Neuregulin-1/ErbB信号通路减少了MI面积,减轻了心肌细胞梗死后损伤,对心肌细胞具有一定的保护作用,但其是否具有浓度依赖性,仍需进一步深入研究。
综上所述,MI可诱导心肌纤维化,通过改变VE-cadherin,NRG-1,ErbB2和ErbB4的表达造成损伤,而人参皂苷Rb3则可通过调控Neuregulin-1/ErbB信号通路降低心肌纤维化程度,减少MI面积,减轻心梗后心肌损伤,保护心肌细胞。

