阑 尾 黏 液 性 肿 瘤 的 超 声 表 现 特 征
张 敏 林 海 覃伶伶 吴汤娜 符小艳 石 莉
(海南省人民医院超声科,海口市 571100,电子邮箱:6zm6@163.com)
阑尾黏液性肿瘤(appendiceal mucinous tumour,AMT)从病理上可分为阑尾黏液性囊腺瘤(appendiceal mucinous adenoma,AMA)、阑尾低级别黏液性肿瘤(low-grade appendiceal mucinous neoplasm,LAMN)及阑尾黏液腺癌(appendiceal mucinous adenocarcinoma,AMAC)3类。在切除的阑尾标本中,AMT占0.2%~0.5%[1]。AMT临床表现无明显特异性,容易误诊为阑尾炎、卵巢肿瘤、肠道肿瘤等,术前正确诊断有利于手术方式的选择,防止术中肿瘤破裂引起腹膜假性黏液瘤(pseudomyxoma peritonei,PMP)。本研究回顾性分析23例经手术及病理证实为AMT的超声表现,旨在提高对该病的认识。
1 资料及方法
1.1 临床资料 收集2003年1月至2018年8月在我院治疗并经手术及病理证实为AMT的23例患者的临床资料,年龄28~63(50.4±12.9)岁,男9例,女14例。临床表现:右下腹痛13例,腹胀7例,右下腹触及肿块6例,无明显不适偶然发现5例。癌胚抗原升高4例,糖类抗原125升高1例,糖类抗原199升高7例。
1.2 方法 (1) 收集临床资料:包括性别、年龄、治疗方法、手术方式、病理结果等。(2)超声检查:采用Mindray DC-8、GE Logiq E9、GE E8及东芝Aplio 500彩色多普勒超声诊断仪,使用腹部凸阵探头及浅表线阵探头,探头频率分别为3~5 MHz、7~10 MHz,首先检查腹部盆腔各器官,然后重点扫查右下腹,沿结肠向下找到回盲部,反复连续多切面扫查,高低频探头并用,仔细观察阑尾结构,有无肿大,有无异常包块,记录病灶的位置、大小、形态、囊壁结构、内部回声及血流情况。观察病变与周边组织的关系,有无腹腔积液。
2 结 果
本组病例中,经手术及病理结果诊断为AMA 12例,LAMN 6例,AMAC 5例。其中:(1) 12例AMA患者超声明确诊断5例,诊断符合率为42%,1例误诊为肠系膜囊肿,1例误诊为肠重复畸形,1例误诊为卵巢黏液性囊腺瘤,1例误诊为阑尾炎,1例误诊为阑尾周围脓肿,2例仅提示右下腹囊性包块。超声表现:所有患者均表现为右中、下腹囊性包块,呈腊肠形、长茄子形及类圆形。9例根部与盲肠紧贴,3例可探及阑尾结构并显示包块与阑尾相延续。大小:短径2.3~12.2 cm,长径4.8~15.4 cm,长径与短径比值为1.1~2.7,平均2.0。囊壁厚度2.3~7.5 mm,壁上未见明显实性结节,2例囊壁呈“强-弱-强”三层消化道壁结构(图1)。8例囊腔内可见细点状及絮状低回声;4例囊腔内可见高低相间的回声分层排列,呈现典型的“洋葱皮”样改变(图2)。8例囊壁完整,与周边组织分界清楚,4例边缘欠整,与回盲部、末端回肠及侧腹壁粘连。(2)6例LAMN中3例合并PMP。超声误诊5例,漏诊1例。2例误诊为卵巢黏液性囊腺癌,均表现为右中下腹腔巨大囊性为主混合性包块(图3),大小分别约262 mm×99 mm×188 mm、141 mm×68 mm×84 mm,包膜不完整,与周边肠管及子宫粘连,前者腔内布满细点状低回声,并见多条密集分隔光带,部分呈放射状排列,后者腔内布满稠厚絮状低回声,彩色多普勒血流显示囊壁上及其内实性部分可见少许血流信号;腹盆腔内可探及大量及中等量积液低弱回声区。2例误诊为阑尾周围脓肿,表现为右下腹阑尾区不规则低回声包块,其内可见增粗的阑尾结构,外径分别为11 mm、13 mm,壁毛糙增厚欠规整,与周边肠管及腹壁粘连,阑尾周边可见片状低弱回声区包绕(图4)。1例误诊为化脓性阑尾炎,表现为阑尾明显增粗肿胀,外径约15 mm,与周边组织粘连,壁不规则增厚,最厚处3 mm,边缘欠整,腔内布满絮状低回声。1例仅诊断肠套叠,未能提示原发病变。(3)5例AMAC中超声明确诊断2例,2例误诊,1例未定性诊断,诊断符合率为40%。明确诊断AMAC的2例患者中1例伴PMP和卵巢转移,表现为阑尾增粗,外径约11 mm,形态僵硬,边缘欠整,壁不规则增厚(图5),卵巢、阑尾根部周边、大网膜、右下腹及盆腔腹膜上可见数个实性低回声团,大小约50 mm×30 mm,边缘欠整,内回声不均匀,伴腹盆腔内大量积液,内布满细点状及絮状低回声;另1例伴末端回肠转移,超声表现为右下腹回盲部囊实混合性包块,大小约52 mm×40 mm,边缘欠整,与末端回肠及腹壁粘连,囊壁不规则增厚,较厚处3.5 mm,壁上多发实性低回声团,腔内可见稠厚的细点状及絮状低回声,包块一端似可见一管样结构连于回盲部,末端回肠可见一实性低回声团,大小约17 mm×10 mm,边界模糊,内回声不均匀(图6)。1例AMAC表现为右下腹回盲部囊实性包块,超声仅提示回盲部肿瘤性病变未明确来源。1例误诊为阑尾AMA,表现为紧贴阑尾类圆形囊性包块,大小约48 mm×46 mm,囊壁不规则增厚,与阑尾远端相通,腔内布满絮状低回声。1例误诊为化脓性阑尾炎,表现为阑尾增粗肿大扭曲,外径15 mm,边缘欠整,周边可见大网膜稍强回声包裹,壁不规则增厚,腔内布满细点状低回声。彩色多普勒血流显示包块囊壁及其内实性部分血流信号较丰富。
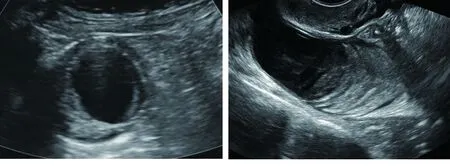

图1 AMA横切面显示为厚壁囊腔,形态规则,壁厚薄均匀,呈“强-弱-强”三层消化道壁结构图2 AMA囊腔内可见高低相间的回声分层排列,呈“洋葱皮”样改变
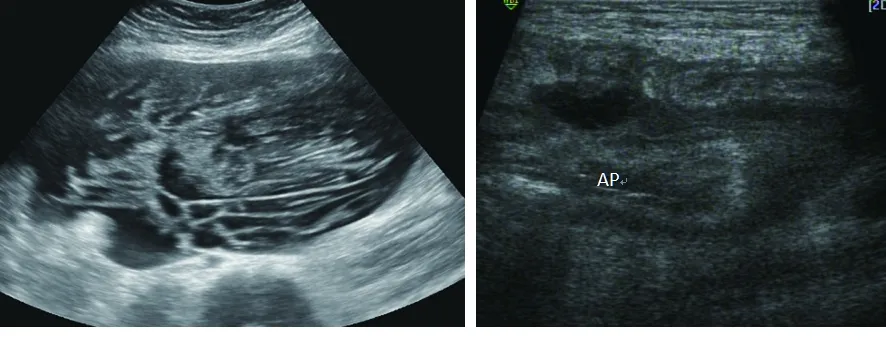

图3 LAMN右中下腹腔巨大囊性为主混合性包块,包膜不完整,与周组织粘连,腔内见多条密集分隔光带图4 LAMN右下腹阑尾区不规则低回声包块,其内可见增粗的阑尾结构,与周边肠管粘连,周边可见片状低弱回声区包绕
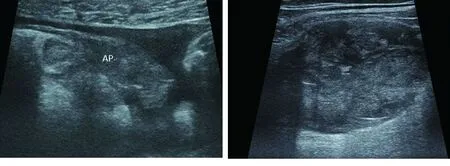
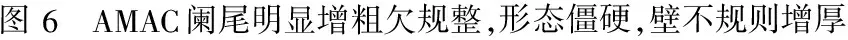
图5 A图6 AMAC阑尾明显增粗欠规整,形态僵硬,壁不规则增厚
3 讨 论
2010年世界卫生组织将AMT分为AMA、LAMN和AMAC,其中LAMN属于难以分类、交界性或难以明确生物学性质的黏液性肿瘤[2]。AMT少见,无特异性临床表现,诊断准确率低,容易误诊和漏诊。AMA病变一般仅局限于阑尾内,较少累及腹腔脏器。LAMN及AMAC病变均可突破浆膜层形成PMP及腹腔种植灶,因此术前正确诊断尤其是对良、恶性的判断有利于手术方式的选择,减少二次手术(如右半结肠切除术)或术后严重并发症(如PMP)的发生率。
本组AMT病例中,AMA比例最高,约占55%,术前超声诊断符合率不高,但大部分病例的超声图像具有明显的声像表现,即右中、下腹囊性包块,一端与阑尾相延续或与盲肠紧贴,形态呈腊肠形、长茄子形或类圆形,短径大于2 cm,大部分病例囊壁完整且较厚,壁上无实性结节,与周边组织分界清,少数与周边肠管粘连,囊腔内囊液多见细点状及絮状低回声,或为高低相间的回声分层排列,呈现典型的“洋葱皮”样改变,Caspi等[3]认为右下腹腔“洋葱皮”样改变包块,同时可探及正常的右侧卵巢是AMT的特征性超声表现。本组AMA病例误诊原因考虑主要与超声医师对该病的声像图特点缺乏认识有关。相对于卵巢黏液性肿瘤,阑尾AMA囊壁较厚,部分表现为“强-弱-强”消化道壁的结构,因此亦容易误诊为回盲部的囊肿型肠重复畸形,后者与邻近肠管共壁,囊腔内少见黏液性液体,可探及正常的阑尾结构。AMA阻塞阑尾腔后易继发感染,临床症状与阑尾炎相似,容易误诊,尤其是腊肠形态的AMA。有文献报道阑尾短径大于15 mm,壁厚度大于6 mm,可作为鉴别AMA与阑尾炎的阈值[4]。
LAMN黏液可突破黏膜肌层到达阑尾壁内,肿瘤上皮具有低级别细胞学特征;AMAC为浸润性病变,肿瘤细胞异型性明显;两者均可突破浆膜形成PMP,与周边组织粘连,可伴远处腹膜、大网膜及肠系膜等多发种植转移病灶,超声表现多样,包块大小、形态差异较大,容易误诊。LAMN突破阑尾浆膜层后病变局限于右下腹时超声表现与阑尾周围脓肿相似,需结合临床症状鉴别,前者多为老年患者,表现为反复发作的慢性右下腹痛,抗感染效果不佳;后者表现为明显压痛及反跳痛,常伴发热及白细胞明显增高,阑尾腔内常见粪石强回声,周边包裹大网膜,抗感染治疗后包块缩小明显。本组3例合并PMP的LAMN中,2例直径>10 cm,瘤体破裂包膜不完整,与周边肠管及子宫附件粘连,伴腹盆腔积液,难以判断来源而误诊为卵巢黏液性肿瘤。文献报道PMP主要来源于阑尾,仅少数来源于卵巢,后者常为继发性[5-6]。因此合并PMP的患者检查时应有目的地仔细探查阑尾,以明确来源。
AMAC肿瘤细胞异型性明显,极易在早期侵犯黏膜肌层或管壁穿孔形成PMP,本组1例以大量腹水为首发症状,检查时发现腹腔多发种植转移灶,腹水内可见较多细点状及絮状低回声,考虑为黏液性质,由此仔细扫查阑尾时发现阑尾明显增粗形态僵硬,壁不规则增厚,据此考虑腹腔病灶来源于阑尾。与LAMN相比,AMAC原发及腹腔种植病灶有更多的实性成分,血流信号较丰富,同时可伴有血清癌胚抗原、糖类抗原199等指标升高[7]。本组病例中有1例AMAC表现为回盲部紧贴阑尾的类圆形厚壁囊性包块,与AMA超声表现相似,容易误诊,需仔细观察包块的囊壁结构。AMA黏膜层轻度异型增生,不向腔内突出,不累及肌层及浆膜层,根据该病理改变影像上表现为囊壁厚薄较均匀,光滑完整;而AMAC黏膜向腔内突出,可见游离实质性成分及漂浮异型细胞,并向肌层及浆膜层浸润生长,表现为囊壁厚薄不均,毛糙不光滑[8]。随着肿瘤实性成分增多,超声表现为形态不规则的囊实混合性包块,常侵及周边肠管及邻近组织,血流信号丰富,此为AMAC较为多见的超声类型,超声检查时需评估肿瘤对周围脏器侵犯的程度、腹腔播散的范围,指导临床选择最佳手术方案。
总之,AMT超声表现多样,不同病理类型图像各异。AMA超声图像表现具有一定特征性;LAMN和AMAC常合并PMP。掌握AMT不同类型肿瘤的病理特点及超声图像特征有助于提高其超声诊断符合率。

