透析单质与化合物推断问题及教学思考
山东 李 波
有关化学中的元素单质及化合物推断题是高考试卷中的主流题型,也是为数不少的学生感到入手容易,但答不完整的“令人头疼”的一种题型。此类问题综合性强、能力要求高,不仅能全面考查学生的化学基础知识,而且能深度地考查学生的化学核心素养和综合分析能力,因而颇受命题者青睐,是近年乃至今后高考命题的重点、热点和焦点。
以下从基础知识归纳和典型问题解析两方面来谈谈这类问题。
一、基础知识归纳
由于元素单质及化合物推断题的特点是条件隐含、综合性强和思维容量大,所以熟练理解和掌握比较系统的基础知识,对解题是大有裨益的。
(1)不稳定(易分解)的酸:H2CO3、H2SO3、HNO3、HClO、H2O2、H4SiO4(习惯上写成H2SiO3)等。
(2)既能与酸反应又能与强碱溶液反应的物质:弱酸的酸式盐(如NaHCO3、NaHS等)、(NH4)2CO3(或NH4HCO3)、Al、Al2O3、Al(OH)3等。其中Al、Al2O3、Al(OH)3又称为能溶于强碱溶液的固体。
(3)可溶性的非金属元素的氢化物水溶液呈酸性。唯有N元素的氢化物(NH3)水溶液呈碱性、O元素的氢化物(H2O)呈中性。
(4)酸溶液在一定条件下均能与活泼金属反应,不能与非金属反应,但HI、HBr、H2S、H2SO3、HNO3、浓H2SO4容易跟某些非金属单质反应。
(5)能跟水反应的单质一定位于元素周期表中的ⅠA、ⅡA和ⅦA族。
(6)常见的酸都能溶于水,而硅酸(H2SiO3)不溶于水,其在水中呈白色胶状沉淀。
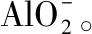
(8)在无机化学中,加热有升华现象的物质是I2和NH4Cl,但前者只发生物理变化,而后者发生了物理、化学变化。
(9)会发生歧化反应(反应后同种元素的化合价既升高又降低)的物质是Cl2和NO2等。
(10)CO2既不能燃烧,也不支持燃烧,而镁带能在CO2中燃烧。
(11)如果两种气体相遇时冒白烟,则它们是HCl和NH3。

(14)金属元素只能显正化合价,而非金属元素既有正化合价也有负化合价。可变化合价最多的元素是N、S、Cl。
(15)两种气体混合时有黄色粉末(或沉淀)生成,则它们是H2S和SO2。
(16)若气体X能在气体Y中燃烧并产生苍白色火焰,则X是H2,Y是Cl2。
(17)遇水即迅速产生气体的物质有Na2O2、Mg3N2、CaC2、Al2S3等。
(18)既不溶于水也不溶于稀酸(稀盐酸、稀H2SO4、稀HNO3等)的白色沉淀有AgCl、BaSO4、H2SiO3。
(19)向某澄清溶液中通入足量CO2时有沉淀出现,则某溶液可能是①饱和Na2CO3溶液;②澄清石灰水;③NaAlO2溶液;④Na2SiO3溶液。
(20)常温下能使酚酞溶液变红而微热后红色又消失的气体是NH3;常温下能使石蕊试液变红而微热后红色又消失的气体是SO2或CO2。
二、高考题型解析
解答元素单质及化合物推断题,首先要牢固掌握上面归纳的基础知识,其次抓住推断题中所给出的题眼——“四特征”,即现象特征、结构特征、反应特征和变化特征,并采用顺推、逆推、猜测、验证方法,便能顺利求解问题。
下面举例解析几种常见题型。
1.定性判断推断题
【例1】(2018·全国卷Ⅰ·12)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
( )
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W和Y具有相同的最高化合价
【解析】W与Z形成的化合物与浓硫酸作用生成能腐蚀玻璃的物质HF,则W为F;因为W与Y同主族,则Y为Cl;Z的原子序数大于17且不大于20,且与F组成的物质与浓硫酸反应生成HF,则Z为K或Ca;再根据W、X、Z最外层电子数之和为10,X的原子序数大于F,则X为Mg或Na。A选项,常温常压下,Mg、Na均为固体,错误;B选项,K、Ca的氢化物分别为KH、CaH2,均为离子化合物,正确;C选项,Y与Z形成的化合物为KCl或CaCl2,其水溶液均呈中性,错误;D选项,Cl的最高化合价为+7价,F没有正价,错误。故选B。
【点评】本题是考查有关常见元素和物质性质的定性判断推断题,其特点是涉及的知识点多、知识跨度大,属于典型的化学学科内综合题。解答该题,先综合题中信息,结合对物质性质的理解,猜测出一些物质,再顺推、逆推和逐个验证,即可推断出答案。
2.定量计算推断题
【例2】有一种无色混合气体,可能由NO、O2、NH3、CO2、HCl中的一种或几种组成。取50 mL该混合气体,通过足量的浓硫酸,体积减少至40 mL;再通过足量的NaOH溶液,体积减少到20 mL,余下的气体接触空气后立即变色。原混合气体中一定不存在;一定含有,其体积比是。

【答案】O2、HCl NO、NH3、CO22∶1∶2
【点评】本题是以混合气体组成为载体的定量计算推断题。解此类问题时,除了必要的定性判断外,关键是根据有关化学方程式进行定量计算,而有时还需根据相关量的多少来判断某种成分的存在与否,这是此类题的一大特色,也是难点所在。解此类题时同样应该注意在确定了某种气体的存在之后,应立即对原有混合气体中的其他成分逐一予以肯定或否定,否则会使计算陷入无序而影响后续答题。
3.信息推断题
【例3】根据X、Y、Z、W四种常见元素的下列信息,回答有关问题:
信息1.上述四种元素均为短周期元素,其原子序数依次增大,且原子核外最外层电子数均不小于2。
(1)根据信息1,X一定不是(填序号)。
A.氢 B.碳
C.氧 D.硫
信息2.上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素?(填“是”或“否”)。
信息3.向上述四种元素的单质组成的混合物中加入足量稀盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)生成白色沉淀物的化学式为。
信息4.向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入足量的稀盐酸,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的化学式为。
【解析】(1)四种元素原子核外最外层电子数均不小于2,因此X不可能是IA族元素,又由于原子序数依次增大,X不可能是硫,否则W为钾,最外层电子数小于2,且也不是短周期元素,符合题意的是AD。(2)四种元素的氧化物中两种能溶于稀H2SO4,三种能溶于浓NaOH溶液,必有一种既溶于酸,又能溶于碱,说明四种元素中一定有Al元素。(3)加过量的烧碱溶液仍能析出白色沉淀的只有 Mg(OH)2。(4)加足量的稀盐酸能析出白色沉淀的只有H2SiO3。
【答案】(1)AD (2)是 (3)Mg(OH)2(4)H2SiO3
【点评】本题考查的重点是原子结构的基础知识。原子结构知识简单,从高考命题趋势看一定会考查方式上寻求变化。本题给出四个方面的信息,通过解读信息进而作出推断,是一种耳目一新的考查方式,因此,应引起同学们的重视。
三、教学思考
1.上述例题,体现了高考命题的趋势。在题目设计上,不给学生入手设置过多的难度,但在试题层次上则有一定的难度和区分度;在问题设计上,给学生留有充分发挥自己个性的时间和空间。这类的推断题对我们的启示还有很多,值得我们在化学复习中深入研究和思考。


