非小细胞肺癌患者凝血功能变化与肿瘤恶性程度相关性分析
刘 娜 闫 可 卞家蓉 桑琳莉
肺癌是目前全球范围内位列第一的常见新发和死亡恶性肿瘤,确诊时80%肺癌患者已属晚期,5年生存率低于15%,严重威胁人类的健康[1-2]。恶性肿瘤患者普遍存在高凝状态,易导致血栓形成,比如肺栓塞,是导致恶性肿瘤患者死亡的重要因素之一[3-5]。近年来研究发现,凝血功能的紊乱可能与恶性肿瘤的发生发展相关,与临床疗效及预后有一定的相关性[6-7]。因此,恶性肿瘤凝血功能的变化及是否早期需要抗凝治疗,越来越受到国内外临床医生的重视[8-9]。恶性肿瘤的高凝状态发生机制复杂,主要是与肿瘤的生物学特征密切相关,从而导致凝血纤溶系统紊乱[10]。肿瘤细胞能分泌较多的组织因子、促进促凝活性物质释放,并且通过与血管内皮细胞、血小板、单核巨噬细胞相互作用,导致机体的高凝状态。研究表明,高凝状态下纤维蛋白原(fibrinogen, FIB)、血小板(platelet, PLT)与癌细胞可形成微血栓,肿瘤细胞可因此逃避免疫攻击,导致肿瘤转移[11-12]。本文回顾性分析非小细胞肺癌(nonsmall cell lung cancer, NSCLC)患者凝血指标变化的特点,探讨凝血指标与非小细胞肺癌临床病理特征的关系,及化疗对肿瘤高凝状态的影响。
资料与方法
一、一般资料
选择2017年1月至2018年10月在江苏省苏北人民医院住院治疗的首诊NSCLC患者99例作为观察组,其中男55例,女44例,平均年龄(60.72±9.29)岁。同时选取同期于本院体检且合格的40例健康者纳入对照组,男36例,女4例,平均年龄(41.25±6.02)岁。观察组中,鳞癌23例,腺癌76例。无淋巴结转移(N0)患者50例,淋巴结转移(N1-3)患者49例。肺/胸膜转移患者14例,肺/胸膜外转移患者13例。根据第八版的TNM肺癌分期[国际抗癌联盟(Union for International Cancer Control, UICC)2017分期标准]分为Ⅰ期(26例)、Ⅱ期(22例)、Ⅲ期(24例)、Ⅳ期(27例)。Ⅲ期、Ⅳ期患者均经常规化疗(培美曲塞+铂类/多西他赛或吉西他滨+铂类)2周期后,根据RECIST标准评估疗效,临床获益组(CR+PR+SD)42例,临床进展组(PD)9例。近期发生脑梗、心梗及原发或继发血液性疾病等疾病,口服抗凝剂、阿司匹林,静滴肝素等情况不纳入。
二、观察方法
收集患者首次入院时凝血指标:凝血酶原时间(prothrombin time, PT)、纤维蛋白原(fibrinogen, FIB)、凝血酶时间(thrombin time, TT)、活化部分凝血活酶时间(activated partial thromboplastin time, APTT)、凝血酶原时间国际标准化比率(international standardized ratio of prothrombin time, INR)、D-二聚体(D-dimer, D-D)、血小板(platelet, PLT),化疗2周期后各项凝血指标。
仪器与试剂:凝血试验由日本 SYSMEX 公司生产的 CS-5100全自动血凝仪。血小板计数由迈瑞公司生产的BC-6800血细胞分析仪。
三、统计学方法
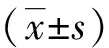
结 果
一、两组凝血指标比较
与对照组相比,观察组PT、INR明显缩短,FIB、D-D水平明显升高,见表1。
二、NSCLC患者凝血指标与临床病理特征的关系
NSCLC患者中,鳞癌比腺癌PT、FIB、APTT、INR水平明显升高,而TT、D-D、PLT差异无统计学意义;Ⅳ期比Ⅰ-Ⅲ期患者PT、FIB、APTT水平明显升高,其他凝血指标TT、INR、D-D、PLT差异无统计学意义;与N0患者比较,N1-3患者PT、FIB、APTT明显升高,TT、INR、D-D、PLT差异均无统计学意义;NSCLC存在胸膜/肺外转移患者凝血功能指标与未发生胸膜/肺外转移患者相比,差异无统计学意义,见表2。
三、NSCLC患者化疗前后凝血功能指标比较
在临床获益的NSCLC患者中PT、INR、D-D化疗后缩短,TT化疗后延长,FIB、APTT、PLT差异均无统计学意义,见表3。在临床进展的NSCLC患者中,化疗前后PT、FIB、TT、APTT、INR、D-D、PLT差异均无统计学意义,见表4。
讨 论
正常机体的凝血系统与抗凝血系统处于一个动态平衡状态,病理情况下,这种动态平衡被打破,导致机体的高凝状态,继发血栓形成或出血,影响预后[13]。肿瘤患者中95%以上会出现凝血系统相关检查的异常,在晚期肺癌、胃肠道恶性肿瘤中更加明显[14-15]。恶性肿瘤患者病程中会出现凝血及纤溶功能的异常,其发生机制复杂,部分仍没有完全阐明。但已有研究发现,凝血功能异常可能与恶性肿瘤发生及进展过程有关[16-18]。

表2 NSCLC患者临床病理特征与凝血功能相关指标的关系
注:PT:凝血酶原时间;FiB:纤维蛋白原;TT:凝血酶时间;APTT:活化部分凝血活酶时间;INR:凝血酶原时间国际标准化比率;D-D:D-二聚体;PLT:血小板
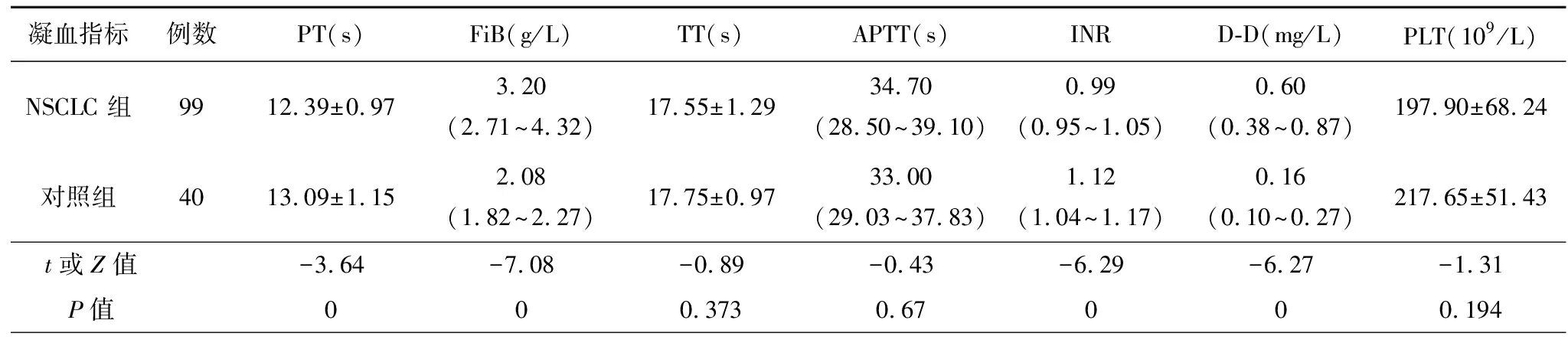
表1 两组凝血功能相关指标的比较
注:PT:凝血酶原时间;FiB:纤维蛋白原;TT:凝血酶时间;APTT:活化部分凝血活酶时间;INR:凝血酶原时间国际标准化比率;D-D:D-二聚体;PLT:血小板
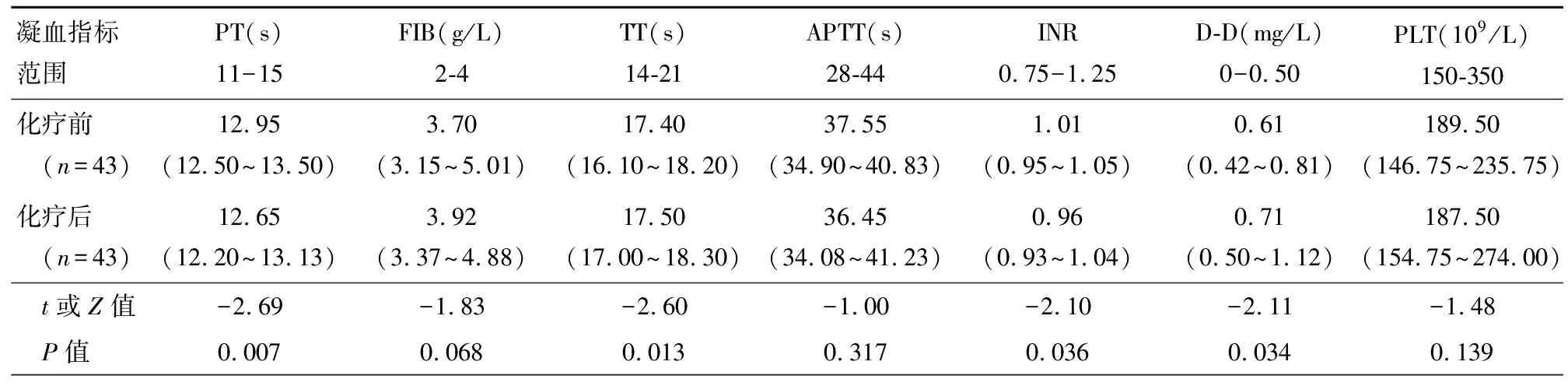
表3 NSCLC临床获益组化疗前后凝血功能相关指标比较
注:PT:凝血酶原时间;FiB:纤维蛋白原;TT:凝血酶时间;APTT:活化部分凝血活酶时间;INR:凝血酶原时间国际标准化比率;D-D:D-二聚体;PLT:血小板

表4 NSCLC临床进展组化疗前后凝血功能相关指标的比较
注:PT:凝血酶原时间;FiB:纤维蛋白原;TT:凝血酶时间;APTT:活化部分凝血活酶时间;INR:凝血酶原时间国际标准化比率;D-D:D-二聚体;PLT:血小板
肿瘤细胞在转移过程中,一方面浸润血管入血形成转移灶,另一方面破坏血管内皮基底膜,导致其抗血栓能力下降,促进血液的高凝状态[19-20]。而高凝状态下的机体,血液粘稠度增高,正常组织的血流灌注减少,出现一系列代谢障碍,更有利于肿瘤细胞的生长和浸润[21]。因此,在临床中对NSCLC患者凝血功能进行检测和分析,可间接反映肿瘤的活动状态,为接下来的诊疗方案提供依据。
本文结果显示,与对照组相比观察组PT、INR明显缩短,FIB、D-D水平明显升高。PT是外源性凝血系统功能的指标,INR是国际标准化比率,FIB是纤维蛋白原量的指标,D-D是交联纤维蛋白降解产物,这四项指标的异常表明NSCLC患者体内的高凝状态,更容易形成静脉血栓栓塞(venous thromboembolism, VTE)[22]。本文进一步对NSCLC患者按病理类型进行分析,发现肺鳞癌较肺腺癌患者APTT、PT、FIB、INR更高,差异具有统计学意义;研究报道肺鳞癌患者的VTE发病率高于肺腺癌患者[23]。这与本文中肺鳞癌患者APTT、PT、INR更高是一致的,而FIB的升高可能与收集的肺鳞癌患者多为Ⅳ期有关,尚需更大样本阐述FIB与NSCLC病理类型之间的关系。在相关肺癌静脉血栓栓塞危险因素研究中发现,肺癌分期是肺癌患者发生VTE的危险因素之一,肺癌晚期患者发生VTE的风险较高[24-25]。本文中NSCLC患者Ⅳ期比Ⅰ-Ⅲ期FIB水平高,且FIB均值大于4 g/L,比正常值高,表明Ⅳ期NSCLC患者凝血水平更加异常,肺癌分期晚凝血指标存在异常,与相关研究结论一致[26]。与此同时NSCLC患者淋巴结转移情况中,N1-3患者FIB比N0患者明显升高,且FIB均值大于4 g/L。FIB是一种急性期反应凝血蛋白,作为重要的凝血因子参与内外凝血系统,促进血栓形成。同时亦有报道证实FIB通过促进肿瘤细胞与血小板之间的粘附力,使肿瘤细胞逃脱机体的免疫监视,形成远处转移。本文认为FIB的水平对于预测NSCLC分期及淋巴结转移中具有一定的作用。Ⅳ期NSCLC患者中有无肺/胸膜外转移,尚无法预测肺恶性肿瘤与凝血水平异常的关系。血小板作为血栓形成的重要成员,有研究表明血小板可与前列腺素作用于血管,增加血管通透性,促进肿瘤细胞转移到血管外的正常组织;此外,高凝状态下的血小板可增加肿瘤周围组织血管分布,增加肿瘤组织血供,促进肿瘤进展。本文中与健康对照组相比,观察组PLT的升高虽没有统计学意义,但Ⅲ、Ⅳ期经常规化疗2周期临床获益组其PLT的水平有下降的趋势。经常规化疗2周期后的Ⅲ、Ⅳ期NSCLC患者中,临床获益组凝血PT、INR较化疗前缩短,TT较化疗前延长,P值均<0.05,差异有统计学意义。本文发现化疗虽能使一部分患者获益,但同时可增加患者继发VTE的风险。
综上所述,NSCLC患者多数合并血液高凝状态,且与肿瘤的浸润转移、病理类型有一定的相关性。对于化疗获益的患者,化疗后血液高凝状态并未得到缓解,可能进一步增加,因此对于晚期NSCLC患者化疗的同时使用抗凝治疗可为患者带来更大的获益。

