活化的Treg细胞对NKT细胞迁移的调节作用
卢燕鸣 李亚琴 周文静 李小燕 于 清
支气管哮喘(简称哮喘)是一种儿童常见的慢性气道炎症性疾病,近年来因环境污染等因素的影响,其发病率逐年增高,给患儿及家长带来沉重的经济和社会负担。其病理机制的本质是炎症引起的气道高反应性和气道重塑[1-2]。且目前普遍认为,Th1/Th2失衡是哮喘发病的关键因素[3-5]。其中CD4+CD25+调节性T细胞(regulatory T cell, Treg)和自然杀伤T细胞(natural killer T cell, NKT)是两种重要的免疫调节细胞。Treg细胞以Foxp3为特征性的标记,具有免疫抑制功能。大量的临床及基础研究显示Treg细胞功能异常导致Th1/Th2失衡是支气管哮喘发病的中心环节[6-7]。NKT细胞可同时表达NK细胞标志和T细胞标志,被CD1d呈递的糖脂类抗原激活后迅速分泌大量IL-4和IFN-γ。本实验早期对52例儿童NKT进行分析,结果显示支气管哮喘的外周血NKT水平大幅下降;屋尘螨致敏哮喘小鼠模型中发现哮喘发病过程中脾脏NKT水平也下降;提示哮喘发病过程中有显著的NKT细胞迁移,过敏性哮喘与NKT 细胞失调相关[8-9]。
有临床研究显示,过敏性哮喘中NKT可以杀灭Treg细胞,这可能是哮喘患者Treg细胞水平低下的原因之一[10]。Thorburn等[11]发现诱导Treg细胞可以抑制iNKT,进而控制哮喘。我们在动物哮喘实验中首次发现,通过Foxp3基因转移可以活化Treg细胞,从而抑制iNKT的活化而减轻嗜酸性细胞的浸润和气道高反应(AHR)[12]。目前有限的数据显示,Treg细胞和NKT细胞在哮喘发病中相互影响,但是二者之间的相互调节方式和调节机制尚不清楚。回答这一科学问题,不仅可以帮助我们更准确地把握哮喘的免疫学发病机制,而且有可能可以指导我们更精确有效地治疗这种疾病。
结合以上实验背景及本实验室早期的研究,本文拟通过体外共培养Treg细胞和NKT细胞,并建立OVA致哮喘小鼠模型在体内探索Treg细胞对NKT细胞的调控作用,尤其是调节NKT细胞迁移/体内分布的可能性。
材料和方法
一、材料与试剂
1. 主要试剂: 卵清蛋白(OVA,Ⅴ级)购自美国Sigma公司;IL-4、IFN-γ 、IL-10及TGF-β ELISA试剂盒购自美国eBioscience公司;荧光标记抗体(CD4、CD25、CD3、CD161)购自美国BD Bioscience 公司;Foxp3和α-tubulin抗体购自美国Cell Signaling公司;RNeasy试剂盒及引物均购自德国Qiagen公司;其余试剂均为国产市售。
2. 实验动物: 实验所用动物为10周龄雄性健康清洁级BALB/c小鼠,由上海交通大学医学院附属仁济医院实验动物中心。所有动物实验操作均经仁济医院实验动物管理及伦理委员会批准。
二、实验方法
1. Treg细胞、NKT细胞分选及纯化: 参照我们已建立的方法[12],70目尼龙网分离小鼠脾细胞,采用免疫磁珠吸附阴性选择方法,分离CD4+CD25+CD127low细胞作为Treg细胞,分离CD4+CD25-的T细胞为效应T细胞(Teff细胞)。制备α-GalCer-CD1d-PE四聚体,而后用anti-PE和anti-TCRβ经流式细胞仪分选表达CD1d和TCRβ的NKT细胞,所得NKT细胞用α-GalCer扩增分离。
2. Foxp3修饰Treg细胞: 表达小鼠Foxp3的慢病毒由本实验室早期构建成功[12],用纯化的重组慢病毒感染Treg细胞,Polybrene的浓度为6 μg/ml,细胞随机分组:空白对照组(Ctrl);空载体转染组(Le-scr);Foxp3转染组(Le-Foxp3,MOI=0.5, 1, 2, 5, 10)。测定转染效率后用于后续实验分析。
3. CFSE标记法测定Treg细胞对Teff细胞增殖的抑制作用: Treg细胞和Teff细胞经培养液重悬并调整细胞浓度为1×106个/ml。而后将Treg细胞(Le-scr或Le-Foxp3)和Teff细胞各100 μl加入包被抗CD3抗体(5 μg/ml)的48孔培养板中,并向每孔加入抗CD28抗体(2 μg/ml),置于培养箱中继续培养60 h。用流式细胞仪检测各组CFSE标记的Teff细胞增殖率(PR)并评估Treg细胞对Teff细胞增殖的抑制作用。
4. INF-γ,IL-4及TGF-β,IL-10 的检测: 各组细胞经相应处理后,IL-4、IFN-γ、IL-10及TGF-β的检测依据美国eBioscience公司提供的ELISA试剂盒检测说明书进行。
5. Treg-NKT体外共培养实验: Treg细胞和NKT细胞经培养液重悬并调整细胞浓度为1×106个/ml。24孔Transwell板下室中接种Treg细胞(Le-scr或Le-Foxp3),5 μm孔径的transwell insert中接种NKT细胞。将培养板置于37 ℃,含5% CO2的恒温培养箱中混合培养72 h,共培养结束后将下室的细胞转移至流式管,抗体标记(anti-CD3和anti-CD161)后经流式细胞仪检测NKT细胞的数量。而后收获上清液,检测细胞因子的水平。
6. RT-PCR检测Foxp3 mRNA的表达: RNeasy试剂盒抽提细胞内RNA,经逆转录酶逆转录为cDNA,然后采用QuantiTect SYBR Green PCR的方法检测Foxp3 mRNA的表达。引物购自德国Qiagen公司;以α-tubulin为内参,采用2-ΔΔCT法分析基因的相对表达量。
7. Western Blot实验: 用RIPA于冰上裂解收集细胞蛋白, BCA蛋白定量试剂盒测定蛋白浓度,调整各孔上样蛋白量并按1︰3的比例加入蛋白上样缓冲液,100 ℃加热5min变性后用SDS-PAGE进行凝胶电泳。之后将蛋白电转至PVDF膜,用5%脱脂牛奶室温条件下封闭90 min。依据说明书要求先后孵育入一抗和辣根过氧化物酶标记的二抗,撒化学发光液于暗室中显影,定影后冲洗胶片。结果采用Image J行灰度半定量分析。
8. OVA致小鼠哮喘模型
参照本实验室已建立的方法制备OVA致小鼠哮喘模型[12]。取32只野生型BALB/c小鼠,按照随机数字表法将小鼠随机分为对照组(sham组,只接受PBS处理)、OVA模型组(OVA组)、OVA+Le-scr组(OVA模型小鼠在实验第15天经尾静脉注射2×106Treg/空载体细胞)和OVA+Le-scr组(OVA模型小鼠在实验第15天经尾静脉注射2×106慢病毒修饰的Treg/Foxp3细胞)。在实验的第24天收获小鼠的外周血(麻醉后摘除眼球取血)、脾组织及肺组织,经流式细胞仪分析NKT细胞的分布情况。
三、统计学方法
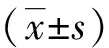
结 果
一、慢病毒载体转染效率检测
RT-PCR及Western blot 检测结果显示(图1A和B),转染携带Foxp3的慢病毒载体可促进Treg细胞中Foxp3的表达, MOI=2时,Foxp3的表达增加显著(P<0.01),结果说明Le-Foxp3可用于后续实验。
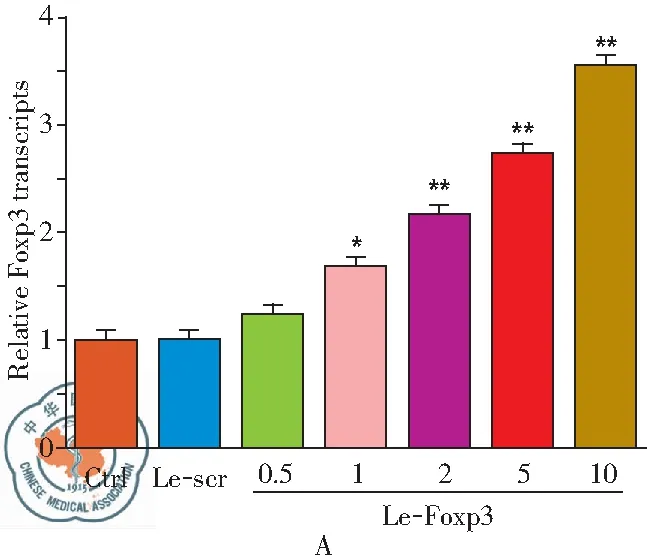
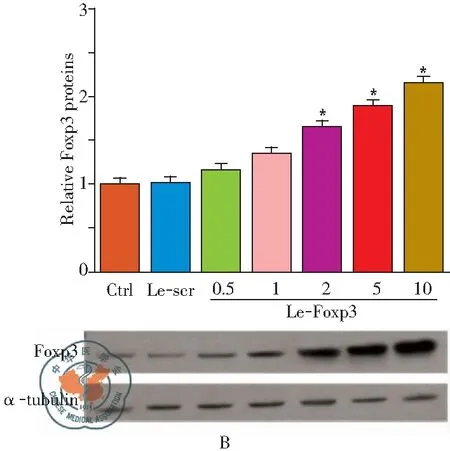
图1Le-Foxp3转染效率检测;注:A:RT-PCR检测Treg细胞中Foxp3的表达;B:Western blot检测Treg细胞中Foxp3的蛋白表达
二、表达Foxp3对Treg细胞功能的影响
Treg细胞主要通过调控效应T细胞(Teff细胞)的功能来实现其维持机体免疫稳态的作用,本实验通过共培养表达Foxp3的Treg细胞和Teff细胞来检测表达Foxp3对Treg细胞功能的影响。结果如图2A所示,相较于Le-scr组;Le-Foxp3组Teff细胞的增殖指数降低, Treg细胞对Teff细胞的抑制率显著增加。同时活化的Treg细胞可分泌细胞因子IL-10和TGF- β抑制免疫反应。本实验中ELISA的结果显示(图2B),相较于Le-scr组;Le-Foxp3组IL-10和TGF-β的水平显著上升。结果说明表达Foxp3可活化Treg细胞。
三、表达Foxp3的Treg细胞对NKT细胞体外迁移和活性的影响
体外共培养Treg细胞和NKT细胞,以探讨Treg细胞对NKT细胞迁移及活化的调控作用。共培养结束后采用流式细胞仪检测下室中NKT细胞的数量。结果显示,转染Foxp3后,迁移到下室的NKT细胞由Le-scr组的649.38±153.97减少至221.15±79.36(P<0.05)。RT-PCR和ELISA检测培养上清中IL-4和IFN-γ的水平,结果显示(图3):相较于Le-scr组,Le-Foxp3组共培养体系上清液中IL-4和IFN-γ的水平显著降低,差异具有统计学意义。
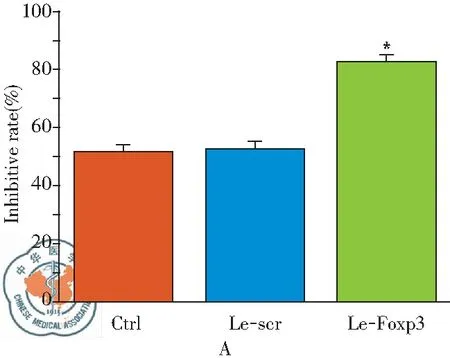
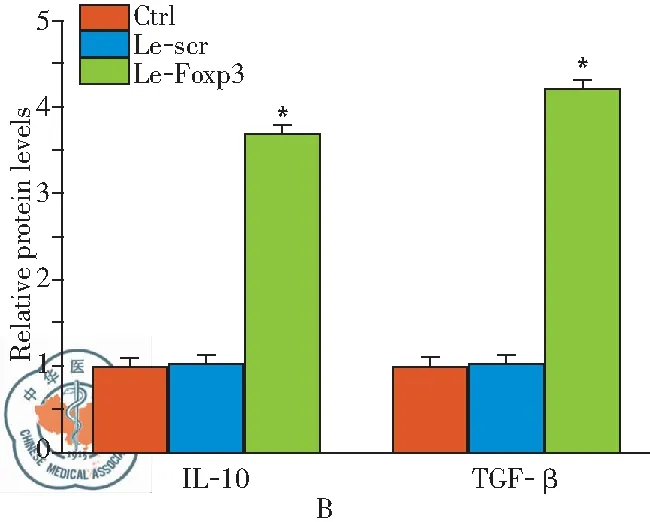
图2表达Foxp3对Treg细胞功能的影响;注:A:CFSE标记法检测Treg细胞对Teff细胞的增殖抑制作用;B:ELISA检测细胞因子IL-10和TGF- β的水平
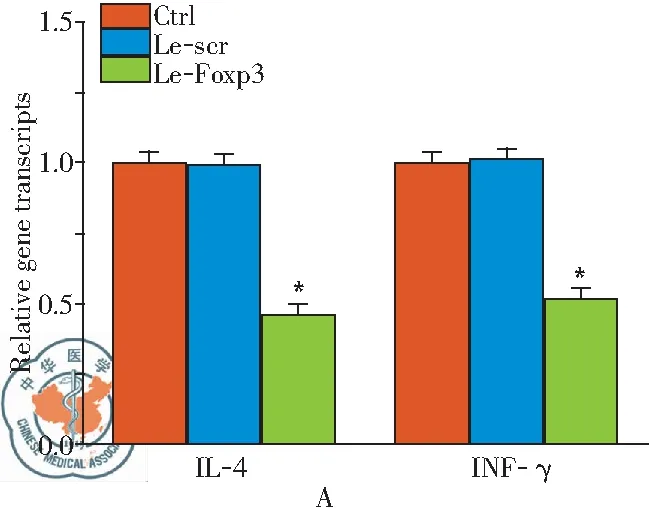

图3RT-PCR(A)和ELISA(B)检测表达Foxp3的Treg细胞对NKT细胞胞内因子IL-4和IFN-γ分泌的影响
四、OVA致哮喘小鼠模型中Treg细胞对NKT细胞体内分布的影响
本实验进一步引入OVA致哮喘小鼠模型,检测哮喘发病过程中表达Foxp3后Treg细胞对NKT细胞体内分布的影响。结果显示(图4),相较于OVA组, OVA+Le-Foxp3组小鼠肺组织中NKT的数量显著降低,而外周血及脾脏中NKT的数量显著升高。因实验过程中发现,OVA组和OVA+Le-scr组结果不具有显著差异,故结果中未显示OVA+Le-scr组数据。
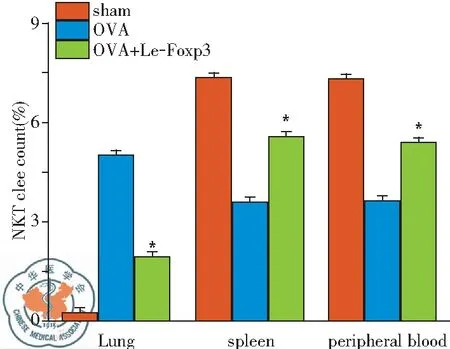
图4OVA哮喘模型中Treg细胞对NKT细胞体内分布的影响
讨 论
本文首先检测了体外构建的Foxp3病毒载体的转染效率,结果显示Treg细胞中转入Foxp3病毒载体后Foxp3的表达显著升高,证明所构建的载体可用于后续实验。Foxp3是Treg细胞的特征标志,也是其最重要的功能分子,大量研究表明高表达的Foxp3与Treg细胞免疫抑制功能之间有良好的相关性[13-14]。本文进一步检测了直接通过病毒载体表达Foxp3对Treg细胞功能的影响。结果发现表达Foxp3可提高Treg细胞对Teff细胞的增殖抑制率,同时促进Treg细胞分泌细胞因子IL-10和TGF- β。结果提示通过体外构建Foxp3表达载体可直接活化Treg细胞,促进其功能的发挥。
早期有研究提示Treg细胞及NKT细胞在哮喘发病过程中存在相互调控作用[10-11]。故而本实验通过体外共培养Treg细胞和NKT 细胞,研究Treg细胞对NKT细胞功能的影响。Transwell共培养的结果显示,转染Foxp3后,迁移到下室的NKT细胞数量明显减少,提示活化的Treg细胞可抑制NKT细胞的迁移;此外RT-PCR和ELISA的检测结果显示,转染Foxp3后,共培养体系上清液中IL-4和IFN-γ的水平显著降低,结果提示活化的Treg细胞可抑制NKT细胞的活化。这些结果直接证实了Treg活化后可负调控NKT细胞,与前期的研究具有一致性。此外,哮喘发病过程中存在NKT细胞在不同组织器官之间的迁移/重新分布[15-18],但目前尚不清楚这一现象是否与Treg细胞有关。为进一步观察在哮喘发病过程中Treg细胞对NKT细胞的调控作用,本实验研究引入OVA致哮喘小鼠模型,体内研究Treg细胞对NKT细胞体内分布的影响。结果显示,表达Foxp3可显著减少OVA致哮喘小鼠肺组织中NKT的数量,而增加外周血及脾脏中NKT的数量。提示活化Treg细胞可调控哮喘小鼠体内NKT细胞的分布。但是Treg细胞调控NKT细胞的具体作用机制还有待进一步深入的研究。
综上所述,Foxp3病毒载体修饰可活化体外培养的Treg细胞,而活化的Treg细胞可抑制NKT细胞的活化及体外迁移并影响OVA哮喘模型小鼠NKT细胞的体内分布。

