外科肺活检诊断弥漫性实质性肺疾病的临床分析
张娟娟 邱玉英 张英为
肺弥漫性疾病(diffuse lung disease, DLD)是放射学上的一个名词,系指肺部疾病在X线胸片或胸部CT上表现为两肺野或大部分肺野布满大小不等的结节状、小片状、线条、网格状、蜂窝状阴影[1]。DLD相对应的临床含义主要是指弥漫性实质性肺疾病(diffuse parenchymal lung disease, DPLD)。DPLD是一组累及肺间质和肺泡腔、肺泡壁的异质性肺部疾病,组织学上主要表现为间质细胞增生、间质基质增多和慢性炎症细胞浸润,包括已知和未知原因所引起的200多种疾病,其临床表现相似,不同亚型治疗各异,预后差别较大,明确诊断十分必要,但临床确诊往往较困难。随着对DPLD认识的进一步提高,部分患者可通过临床症状和体征、胸部高分辨率CT(high-resolution CT, HRCT)、实验室检查、经支气管镜肺活检(transbronchial lung biopsy, TBLB)和CT引导下经皮肺穿活检等小创伤检查获得明确或相对明确的诊断,还有少部分患者需外科肺活检才能进一步明确诊断。外科肺活检包括开胸肺活检(open lung biopsy, OLB)和电视辅助胸腔镜手术(video-assisted thoracic surgery, VATS)两种手术方式,目前常用于DPLD的诊断,其在疾病诊断、指导调整治疗方案以及改善患者预后方面优于小创伤性检查。由于外科肺活检为有创操作,可导致DPLD患者基础肺功能常受损,术后患者易出现呼吸衰竭、原有肺部疾病加重甚致死亡等并发症,既往文献报道的并发症发生率和诊断率差异较大。本文回顾分析了54例南京鼓楼医院呼吸与危重症医学科2006年1月至2018年9月行外科肺活检的DPLD患者,旨在评估外科肺活检的诊断率和安全性,以期为临床选择外科肺活检诊断DPLD提供依据。
资料与方法
一、临床资料
54例患者术前均进行了胸部HRCT检查,均考虑DLD,根据临床、影像学资料未能诊断为DPLD的具体亚型,进而接受了外科肺活检。收集患者术前资料:年龄、性别、吸烟史,肺功能、PaO2、TBLB、支或CT引导下经皮肺穿活检情况、气管肺泡灌洗(bronchoalveolar lavage, BAL)、激素使用情况、手术方式、临床表现以及胸部HRCT。总结术后资料:术后并发症种类及数量、术后诊断结果及治疗方案等。外科肺活检手术方式在2011年前包括OLB和VATS,2011年以后的病例均为VATS。本组患者的术后脱机困难是指术后机械通气大于48 h。
二、研究分析方法
回顾性分析54例南京鼓楼医院呼吸与危重症医学科2006年1月至2018年9月结合临床资料、胸部HRCT、实验室检查,甚至TBLB或CT引导下经皮肺穿活检不能确诊,从而接受外科肺活检的DPLD患者的临床资料。比较术后并发症组和无并发症组在性别、年龄、FVC% pre、FEV1%pre、DLCO% pre、术前PaO2、术前使用激素情况以及手术方式等方面的异同。将患者术后有无并发症分为并发症组和无并发症组。
三、统计学方法
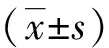
结 果
一、术前临床资料
共有54例患者入组,其中男29例,女25例,平均年龄(42.9±14.1)岁,既往或现在吸烟者17例。术前肺功能检查,平均FVC% pre为(75.1±17.3)%,平均FEV1% pre为(76.5±18.9)%,平均DLCO% pre为(67.0±23.6)%。术前PaO2为(85.6±18.7)mmHg。术前25例患者接受TBLB和/或CT引导下经皮肺穿活检,均未明确诊断;12例患者接受了BAL检查。10例患者术前曾接受激素治疗。37例患者接受了电视辅助胸腔镜肺活检,17例患者接受了开胸肺活检。术前临床表现包括咳嗽44例、咳痰24例、活动后气喘32例、咯血4例、发热5例、胸痛2例及无症状6例,其中最常见的临床表现是咳嗽。所有患者术前均接受HRCT检查,54例患者胸部HRCT均表现为双肺弥漫性病变:网格影为28例,结节影为17例,片状高密度影为13例,磨玻璃样影为13例,囊状影为10例,其中有些患者合并两种以上病变类型,术前临床资料详见表1,典型病例胸部HRCT分别,见图1~3。

图1囊状影
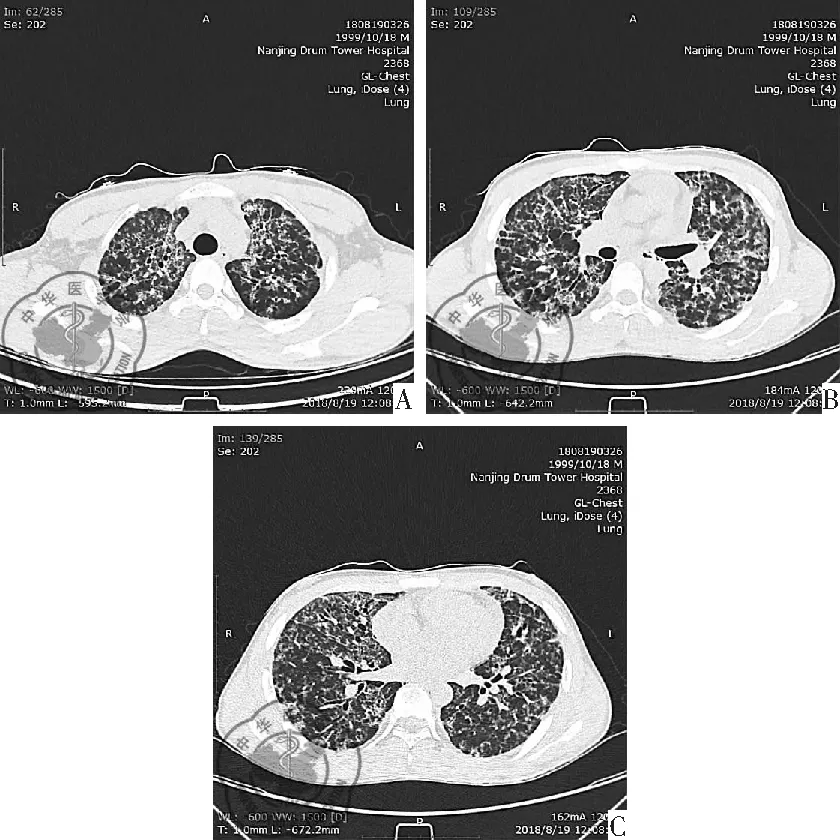
图2网状实变影

图3网状实变影、结节影
病例1男性,18岁,干咳、咯血2月,伴胸闷、气喘1月;胸部HRCT(肺窗)示两肺多发薄壁囊腔影伴左侧胸腔内条带状透亮影,左侧大量气胸,左肺压缩65%,纵隔右移(图1 A-C)。VATS活检病理为肺朗格汉斯细胞组织细胞增生症,见图4。
病例2男性,18岁,干咳伴活动后胸闷气喘1月;胸部HRCT(肺窗)示两肺弥漫性磨玻璃影、网状实变影(图2 A-C)。VATS活检病理诊断为机化性肺炎,见图5。
病例3女性,50岁,体检发现两肺阴影半月;胸部HRCT(肺窗)示双肺散在网状实变影,小叶中心性结节影(图3 A-C)。VATS活检病理诊断为castleman病累及小气道和肺实质,见图6。
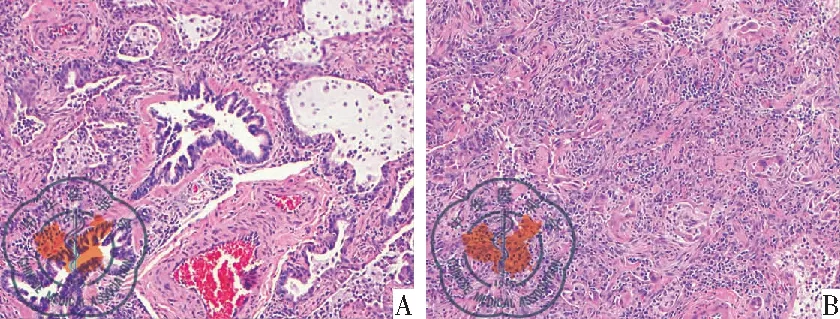
图5病例2多数区域肺泡间隔纤维组织增生、慢性炎症细胞浸润。肺组织病理学诊断机化性肺炎(HE×10)
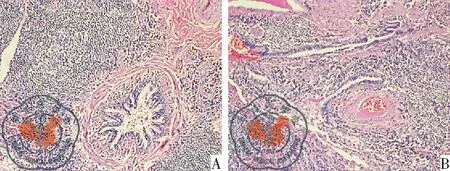
图6病例3小气道周围、胸膜下、小叶间隔周围淋巴组织结节状增生伴淋巴滤泡形成,淋巴组织间纤维组织增生,组织学可符合castleman病累及小气道和肺实质(HE×10)
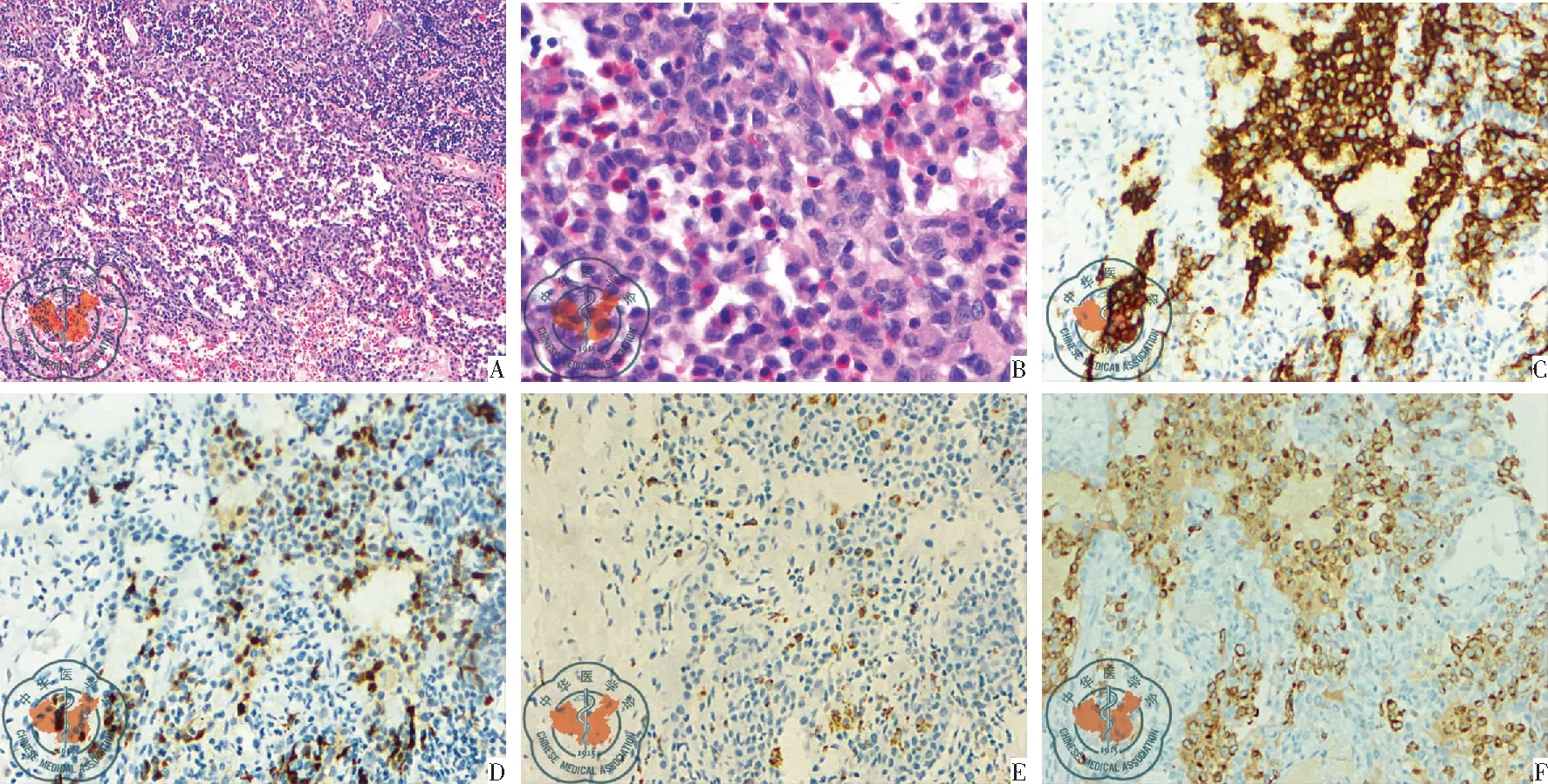
图4病例1肺组织病理学诊断肺朗格汉斯细胞组织细胞增生症;注:A :(HE×10)肺组织病理示大量朗格汉斯组织细胞、少量嗜酸性粒细胞和淋巴细胞浸润;B:(HE×40)肺组织病理示朗格汉斯细胞核呈卵圆形、肾形(黑箭),可见明显核沟,少量嗜酸性粒细胞浸润;C:免疫组化示朗格汉斯组织细胞膜CD1a阳性(棕色)表达;D:免疫组化示朗格汉斯组织细胞S-100阳性(棕色)表达;E:免疫组化示朗格汉斯组织细胞膜CD68阴性表达;F:免疫组化示朗格汉斯组织细胞Langerin阳性(棕色)表达
二、术后并发症
54例患者在手术过程中均未出现并发症,15例(27.8%)患者在外科肺活检术后出现了并发症,其中9例患者出现气胸,5例出现肺部感染,脱机困难和呼吸衰竭各3例,术后出血、气管切开及再插管各占1例。12例患者出现1种并发症,1例患者出现2种并发症,2例患者出现3种以上并发症。1例(1.9%)患者在术后30 d内死亡,死亡原因为主要为呼吸衰竭。
三、诊断结果及治疗调整
所有患者外科肺活检后均获得了病理诊断,病理类型包括间质性肺炎、肺部肿瘤、细支气管炎、结缔组织疾病、感染性疾病、肺气肿、吸入性肺疾病和遗传代谢性疾病等8种。其中,52%的病理类型为间质性肺炎,15%为肺部肿瘤,其他病理类型较少见。最常见的病理诊断是机化性肺炎。外科肺活检术后确诊者的病理诊断见表1,6例未确诊者的病理诊断见表2。

表2 术后6例未确诊患者的病理结果

表1 术后48例确诊患者的病理结果
注:NSIP 非特异性间质性肺炎;PLCH 肺朗格汉斯细胞组织细胞增生症,MALT 胃黏膜相关性淋巴样组织淋巴瘤
术后38例(70.4%)患者根据诊断结果调整了治疗方案,其中加用糖皮质激素和(或)免疫抑制剂调节免疫者26例,确诊肺部肿瘤接受化疗者4例,抗感染治疗者3例,抗结核治疗者2例,1例停用了激素并口服三苯氧胺治疗原发病。
四、比较术后两组临床资料的差异
性别、年龄、FVC% pre、FEV1%pre、DLCO% pre、术前PaO2、术前使用激素情况以及手术方式等在术后并发症组和无并发症组之间的差异没有统计学意义(P>0.05),见表3。

表3 比较术后并发症组和无并发症组临床资料的差异
讨 论
DLD实际上就是指间质性肺疾病(interstitial lung disease, ILD),ILD最早是在1975年美国第18届Aspen肺科讨论会上开始使用。最初以为ILD是肺间质的病变,后来慢慢发现ILD并不是仅仅累及肺间质,还有肺实质的病变,很多ILD早期起源于肺泡炎和肺泡结构的变化,然后引起广泛的间质纤维化。近年来有学者认为用ILD命名这一大类疾病并不恰当,在文献中多使用DPLD来表示这一类疾病[2-3]。
本文外科肺活检的诊断主要包括间质性肺疾病、感染、肿瘤、自身免疫性疾病和遗传代谢异常等,也符合DPLD常见的诊断[4-7]。文献报道外科肺活检的诊断率在75.4%~100%,诊断率明显高于小创伤肺活检[4,8-13]。本文外科肺活检的诊断率为88.9%,与以往文献报道相似,验证了外科肺活检是一项可靠的诊断DPLD的手段。对于结合临床特点、胸部HRCT以及实验室检查不能明确诊断的DPLD患者,首选TBLB及CT引导下经皮肺穿活检等风险小的有创检查[14]。本组病例接受TBLB或CT引导下经皮肺穿活检未确诊的患者,行外科肺活检后96%患者得到确诊。可见对于小创伤肺活检仍不能确诊的DPLD患者,外科肺活检可作为最后一项有意义的诊断手段,能提供可靠的病理信息。
外科肺活检作为一项外科手术仍有潜在的手术风险,其术后并发症发生率为11%~30%,术后30 d病死率为0~24%[8,15-18]。本组病例术后并发症发生率为27.8%,术后30 d病死率为1.9%,死亡原因主要是呼吸衰竭。术前临床医师应谨慎评估手术相关的风险与收益。本文比较了术后并发症组和无并发症组之间的临床资料,未发现具有显著统计学差异的因素,这可能是因为本组样本量较少,无法找出有意义的危险因素。研究表明,高龄、男性、肺动脉高压、术前合并其他疾病、术前肺功能差以及术前接受激素和免疫抑制剂治疗是患者术后出现并发症或死亡的危险因素[9,16-17,19-22]。这说明对于基础状况较差的患者选择外科肺活检时应更谨慎,除非预估病理结果能明显改善患者预后,否则应尽量避免行外科肺活检。
本组54例患者中37例行VATS,其余17例行OLB。本组病例2011年以前活检术式包括OLB和VATS,而2011年后则仅有VATS一种手术方式,这也符合近几年文献报道的VATS较OLB更安全[16-17]。VATS和OLB相比,其窥视范围更广、创伤小、痛苦小、住院时间短以及可多部位取材,因而外科肺活检手术方式以VATS为主,而OLB仅用于胸腔粘连严重难以进行胸腔镜肺活检的患者。
胸部HRCT已成为诊断和鉴别诊断DPLD首选且必不可少的检查手段。胸部HRCT上能显示肺病变的类型、分布特征、累及部位、有无肺组织的牵拉变形,还可动态观察病变的演变过程和缩小鉴别诊断范围,因此对于DPLD的诊断十分重要。研究表明,胸部HRCT上肺实质病变的类型、程度、体积受损程度与DPLD患者肺功能损害的严重程度和总体预后有关。本组病例在HRCT上的表现主要分为网格状影、结节状影、实变影、磨玻璃样影和囊状影。其中51.9%的患者主要表现为网格状阴影。网格状影是DPLD常见的HRCT类型,提示病变部位为肺泡间隔、小叶内间隔、小叶间隔以及支气管血管束周围等。
外科肺活检的病理诊断能为临床诊断提供可靠的依据,但是不能仅根据病理诊断得出最终的临床诊断。由于部分DPLD的病理组织学诊断缺乏特异性,一种组织学改变可见于多种疾病,而一种疾病也可表现为多种组织学改变。例如组织学为普通型间质性肺炎(usual interstitial pneumonitis, UIP)表现可见于IPF、结缔组织疾病相关间质性肺疾病和慢性过敏性肺炎;干燥综合征相关性间质性肺疾病的病理类型可表现为淋巴细胞间质性肺炎(lymphocytic interstitial pneumonitis, LIP)、非特异性间质性肺炎(nonspecific interstitial pneumonia, NSIP)、机化性肺炎(organizing pneumonia, OP)和UIP中任一种。因此,病理诊断必须结合临床表现、影像学特点,才能得出可靠的临床诊断,这需要经验丰富的病理科医师、呼吸科医师和影像学医师共同讨论,这种多学科讨论是目前诊断DPLD的重要方法。本组有6例患者接受外科肺活检后,由于其病理诊断与临床及影像表现不一致,最终仍无法确诊,多学科讨论均考虑为未分类的DPLD。对于无法确诊的患者,应评估患者病情的严重程度,给予合理的治疗,定期随访并监测病情的变化以期最终能确诊。
本研究尚存在一些不足之处。首先,本文的样本量较少,不具有非常可靠的代表性,虽然既往研究表明多种因素与术后并发症及死亡有关,但是本文未找到具有统计学意义差异的危险因素。其次,因缺乏长期的随访,不能评价更改治疗方案对于预后的影响,也无法统计30 d以上的死亡率,不能系统地评价术后的病死率。

