光照对腐殖酸生物可利用性的增效作用的研究
任 东
(西华师范大学环境科学与工程学院,四川 南充 637009)
1 引 言
腐殖酸(HA)是一类组成和结构复杂、物理上不均匀的有机混合物,主要来源于动植物残体的生物化学分解过程,广泛分布于沉积物、沼泽、湖泊、河流及海洋等水生生态系统[1]。以碳含量计,HA在自然水体中的含量常为0.5~100 mgC/L[2-3],可占水体总溶解性有机质的40%~80%[4]。在水生生态系统中,HA本身是一种生物难利用的混合物,但其结构组成易被光化学、氧化还原、络合和溶解-沉淀等作用所改变。HA对波长小于600nm的太阳光具有强烈的吸收,其光化学过程通常会对水体中各物理、化学和生物过程产生重要的影响[5],如加速碳、氮等元素的生物地球化学循环,为异养型微生物提供生长所需的能源和营养元素,以及为植物生长提供必要微量元素等。
在太阳光照射下,水体中溶解性有机质的结构和性质均会发生大幅度改变,并生成甲酸、乙酸、丁二酸等小分子有机物[6-7],其本身生物可利用性也可能会发生显著变化,这将对水生生态系统中物质和能量循环产生极为重要的影响。然而,HA等有机质的生物可利用性受光照条件的影响至今未形成共识。Bittar等对藻源有机质生物可利用性受光照的影响进行了研究,结果显示光照能显著降低该类有机质的生物可利用性[8];然而,Senga等在研究陆源有机质生物可利用性受光照条件影响时却得到了完全相反的结论,并且他们指出光照对有机质生物可利用性的改变可能与其来源有关[9]。同时,微生物是水生生态系统中有机碳各种生物地球化学过程中最具活力的参与者,其活动过程能显著利用或改变有机碳的种类、组成和性质。因此,本文拟以稻田土壤微生物为受试生物,对光照影响溶解性HA的生物可利用性进行深入探究,从而为溶解性HA的生物地球化学行为与效应研究提供基础信息。
2 材料与方法
2.1 样品采集及预处理
稻田土壤样品采集自四川苍溪(E 105°58′46″、N 31°42′47″,2017年10月),均为5cm以下的土壤部分。手工剔除动植物残体后,一部分新鲜土壤用于微生物接种液制备,另一部分土壤风干后避光保存,用于腐殖酸提取。
2.2 微生物接种液及HA制备
将新鲜土壤于室温下活化3天,按10∶1(v/w)比例加入去离子水振荡混匀,静置过夜后离心获取上清液,将其稀释至溶解性有机碳浓度低于仪器检测限,即获得微生物接种液。
按前期研究建立的方法提取HA,并制备HA储备液和工作液[10],获得的HA固体和溶液均避光保存于4°C下。
2.3 腐殖酸光照实验
配制浓度为200.0mgC/L的HA工作液,调节pH=7.5±0.2后于光化学反应仪上进行光照。实验温度为25.0±0.5°C,并保持各反应器与空气相通。于0、8、16、24和48小时取样,分别标记为HA0、HA8、HA16、HA24和HA48。将获得的部分HA样品进行冷冻干燥,剩余部分于4°C下保存备用。
2.4 生物可利用性实验
配制微生物生长基质溶液,每升溶液中矿物盐的含量如下:100.0mg K2HPO4·12H2O、100.0mg KH2PO4、40.0mg NaCl、50.0mg NH4Cl、100.0mg MgSO4和50.0mg CaCl2·2H2O。采用灭菌的基质溶液配制微生物生长液,使HA浓度为20.0mgC/L,并向各生长液加入500μL微生物接种液。接种好的反应体系于好氧黑暗条件下培养72h,并于设定时刻下测定各培养体系光密度。
2.5 测试表征与数据分析
光照前后,HA浓度由总有机碳分析仪测定、吸光特性采用紫外-可见(UV-vis)分光光度计测试(测试HA浓度为5.0mgC/L)、组成和结构变化由元素分析和红外光谱确定,HA生物可利用性高低由微生物生长量(培养液光密度,OD680)指示。
3 结果与讨论
3.1 HA光学特性变化
如图1所示,随光照时间增加,HA的UV-vis吸光能力逐渐减小,这可能是由HA光矿化及其光吸收官能团破坏导致。为了验证这一猜想,实验测定了HA溶液TOC随光照时间的变化,结果显示光照并未引起HA溶液TOC的明显变化。与HA0相比,HA48的TOC仅降低了3.6%。因此,光吸收官能团受损是HA吸光能力减弱的主要原因,这与Sharpless等研究光氧化改变腐殖酸电化学特性时所发现的结果相一致[11]。

图1 光照对HA吸光能力的影响Fig.1 Influence of light irradiation on HA absorbance
尽管不同光照程度HA的UV-vis吸收光谱十分相似,各HA吸光能力均随波长增大呈指数模式减小,但其吸收光谱特征指数能在一定程度上反映光照对HA的组成和结构的改变情况。如表1所示,E2/E3值大小与HA结构中的电子转移复合结构丰度密切相关,随电子转移复合结构含量增加而减小[12]。因此,HA光吸收能力随光照时长增加而减小的变化趋势也与其电子转移复合体结构受损程度相关[13]。光谱斜率(S275-295)、光谱斜率比(SR)及特征紫外吸收系数(SUVA254)均与HA的分子量大小和芳香度成反比[14-15],因此光照导致了HA的芳香度和分子量减小。

表1 HA光吸收特征指数Tab.1 Light absorption characteristics of the HA
3.2 HA组成和结构改变
为了进一步确认UV-vis吸收光谱所指示的HA组成及结构变化,实验对各HA样品进行了元素组成分析。如表2所示,随光照时长增加,HA的碳元素含量比例有所增加,而氧元素含量比例有所减小,这与HA中羧酸组分光矿化过程相关[14]。原子比H/C随光漂白过程有增大的趋势,表明HA中芳香性组分相对含量减少,脂肪性组分相对含量增加。这与UV-vis光谱分析的结果相一致,即光照过程中HA的芳香性组分会不断减少。原子比O/C和(O+N)/C随光照过程呈现出先增大后减小的变化趋势,这表明HA的极性先增大后减小,这些变化均与HA先被分解成有机酸然后被矿化的过程密切相关[7]。

表2 不同光照时长HA的组成及原子比Tab.2 Composition and atomic ratios of HA under different light duration
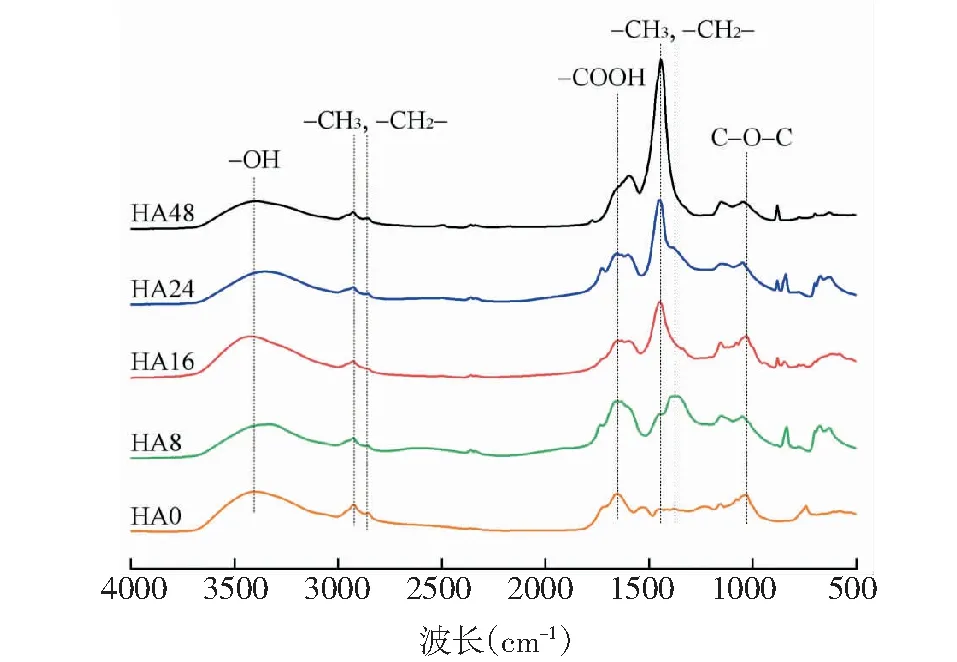
图2 不同光照时长HA的FTIR光谱Fig.2 FTIR spectra of HA with different light duration
各HA样品的FTIR表征结果如图2所示。随光照时长增加,-OH响应(3 400cm-1)不断减弱,而-COOH响应(1 662cm-1)呈现先增强后减弱的变化趋势,这可能是HA中氧元素比例随光照时长增加先增大后减小的原因。同时,这些官能团响应也与Polak等对溶解性HS红外光谱分析结果一致[16]。与H/C值变化趋势一致,-CH3和-CH2-响应(1 450cm-1和1 372cm-1)也呈现出不断增强的变化趋势。因此,随光照时间增加,HA组成中会累积脂肪类物质,其生物可利用性可能会有所增加。
3.3 光照对HA生物可利用性的改变
如图3所示,原始HA几乎不能为微生物生长提供条件,培养前后溶液TOC仅减小了8.5%左右,但光照能显著增加HA溶液的微生物可利用性(p<0.05),其TOC减小了31%~52%不等。相应地,HA0-微生物体系的光密度无显著变化(p>0.05),而光照HA-微生物培养体系的光密度增大了1.38~2.05倍。尽管前期研究指出,光化学反应会与微生物生长过程竞争溶解性有机质中的碳源物质[17],但HA光分解的同时也会生成微生物不稳定性碳,而这部分有机碳能为微生物生长提供有利条件。因此,与HA0相比,微生物能在光照HA溶液中良好生长。

图3 不同HA-微生物培养体系的光密度及TOC含量Fig.3 Optical density and TOC contents of different HA-microbe incubation systems
各光照HA中,HA16具有最高的生物可利用性,这与各HA元素组成及官能团变化趋势基本一致。尽管HA8具有最高的氧含量,但其碳含量相对较低,因此其生物可利用性低于HA16,这与Goldstone等的研究结论一致,即光分解腐殖质产生的有机酸并不是微生物生长的主要碳源[7]。因此,光照HA产生的脂肪性有机碳是其生物可利用性增大的主要原因。微生物培养后的原始HA和光照HA的UV-vis光谱分析结果如图4所示,与图1相比可知,对长波光敏感的HA组分也是微生物生长优先利用的有机物组分。因此,生物可利用性从HA16开始下降的主要原因是生物可利用性有机碳发生了光化学降解。

图4 各HA微生物培养后的紫外-可见吸收光谱Fig.4 UV-vis absorption spectra of various HA microorganisms after culture
4 结 论
4.1 光照过程中,HA主要生成了小分子有机物,包括脂肪性有机物和有机酸等,仅小部分发生了光矿化过程;同时,HA的腐殖化程度和芳香化程度随光照时长增加逐渐减小,氧元素比重先增大后减小,而碳元素比重先减小后增大。
4.2 光化学转化能显著增加HA的微生物可利用性,生成的小分子脂肪性有机物是光照增强HA生物可利用性的主要原因,但HA中对长波光敏感的组分也是微生物生长优先利用的部分,因此光照对HA微生物可利用的增强作用与光照时长相关。

