β-羟丁酸对脑胶质瘤细胞增生糖酵解的影响
于春娜 江 波 李文斌* 陈 峰
(1.首都医科大学附属北京天坛医院神经肿瘤综合治疗科,北京 100050;2.首都医科大学附属北京世纪坛医院胃肠外科/临床营养科,北京 100038)
脑胶质瘤是一种起源于中枢神经系统的恶性肿瘤,其恶性程度高,侵袭性强,患者生存期短。目前,脑胶质瘤标准治疗包括最大限度的手术切除,继而辅以放射治疗及替莫唑胺化学药物治疗。但由于肿瘤组织的浸润特性,无法完全切除,残存的肿瘤细胞常常成为复发的来源[1]。尽管在接受了全面地治疗后,胶质母细胞瘤(glioblastoma,GBM)患者的平均生存期也仅有12~15个月。标准治疗虽然在短期内控制了胶质瘤地生长,但却可以促进并加快肿瘤的复发[2]。因此,寻找新的治疗方法迫在眉睫。
能量代谢改变是肿瘤细胞的特征之一,即表现为无论在有氧或无氧环境下,肿瘤细胞均以葡萄糖酵解作为能量供应方式,这种现象被称为“沃伯格”效应[3]。因此,理论上可以通过限制葡萄糖摄入,选择性饥饿肿瘤细胞,从而达到限制肿瘤细胞生长的目的。生酮饮食(ketogenic diet,KD)是一种高脂肪(60%~90%)、低碳水化合物(2%~5%)及适量蛋白质的饮食方式,已在治疗儿童难治性癫痫领域应用了数十年[4]。KD提供的脂肪和蛋白质可以满足人体正常组织的基本能量代谢需求,但却降低了体内血糖浓度,减少了肿瘤细胞能量供应从而达到抑制肿瘤细胞生长的目的。不仅如此,KD还能发挥抗氧化、抑制炎性反应及增强免疫的作用[5-6]。早在1995年,Nebeling等[7]就尝试将KD应用于恶性神经胶质瘤的治疗,并取得一定治疗效果。2010年,Zuccoli等[8]报道了1例胶质母细胞瘤的患者经过生酮饮食联合标准疗法治疗后,肿瘤病灶消失,停止生酮饮食10周后肿瘤复发。之后的研究[9]显示,KD可以延长脑胶质瘤患者生存期、改善预后并提高放射治疗及化学药物治疗敏感性。
KD的核心是高脂肪及低碳水化合物,脂肪通过肝脏进行β-氧化,生成β-羟丁酸(β-hydroxybutyrate,β-HB)、乙酰乙酸(acetoacetate)以及丙酮(acetone)3种酮体,其中β-HB约占酮体总量的70%[10]。酮体作为除葡萄糖外的另一种供能物质,被运输到肝脏之外的组织中产能。除了减少肿瘤的能量来源,KD的抗肿瘤作用部分归功于产生的酮体。使用生理剂量的β-HB可以抑制人和鼠胶质母细胞瘤细胞系的增生[11]。此外,β-HB增加了放射治疗和化学药物治疗药物对人胶质母细胞瘤细胞系的治疗效果[11-12]。虽然KD在荷瘤动物实验[7-12]中被证明有不错治疗效果,但对β-HB的研究多集中于其抗炎、抗氧化及神经保护作用,对脑胶质瘤细胞代谢影响的报道较少。因此,基于肿瘤细胞的“沃伯格”效应,在本研究中探讨了KD代谢产物β-HB对脑胶质瘤细胞生长及糖酵解的影响,进一步阐释KD抗肿瘤的作用机制。
1 材料与方法
1.1 细胞及试剂
实验使用的人脑胶质瘤细胞株U87及LN229由西南大学实验室提供;DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;CCK8试剂盒购自日本Dojindo公司;Seahorse XF Glycolysis Stress Test Kit试剂盒购自美国Agilent公司,反转录试剂盒购自日本Toyobo公司;Power SYBR®Green PCR Master MIX 试剂盒购自美国Life公司;RIPA裂解液、BCA蛋白定量试剂盒、SDS-PAGE凝胶试剂盒购自北京索莱宝公司;兔抗人c-myc多克隆抗体购自美国CST公司。
1.2 细胞培养
U87及LN229细胞均用含10%(体积分数)FBS的DMEM高糖培养基培养,隔天换培养液,达到指数生长期胰蛋白酶消化传代,置于5%(体积分数)CO2,37 ℃培养箱中。
1.3 细胞活力检测
采用CCK8试剂检测细胞增生。取对数生长期细胞,消化离心后,以5 000个/孔的细胞密度接种于96孔板中,细胞贴壁24 h后,替换含不同浓度β-HB的细胞培养基(0、40、60、80、100、120 mmol/L),每组设置5个复孔,处理48 h后,每孔加入含10%(体积分数)的CCK8试剂的完全培养基,放入培养箱孵育2 h,酶标仪检测450 nm处的吸光度。
1.4 细胞糖酵解实验
糖酵解压力试剂盒检测细胞糖代谢水平。取对数生长期细胞,以5 000个/孔的细胞密度接种于Seahorse XFe24专用24孔板中,贴壁后替换含不同浓度的β-HB培养基(0、60、80 mmol/L),每组设置5个复孔。实验前配制不含葡萄糖的基础培养基,调节pH值为7.4。水化Seahorse XFe24专用探针板12~72 h。处理细胞48 h后,将24孔板中DMEM培养基更换为基础培养基,放入培养箱中孵育1 h。根据试剂盒说明书,配制并稀释葡萄糖、寡霉素及2-脱氧葡萄糖至所需浓度,加入到测试板中,按说明书上机检测。Seahorse XF糖酵解压力试剂盒检测不同浓度β-HB(0、60、80 mmol/L)作用于脑胶质瘤细胞48 h后的细胞外酸化速率(extracellular acidification rate,ECAR),并对细胞的糖酵解能力进行统计。
1.5 实时定量聚合酶链式反应 (real-time quantitative polymerase chain reaction,RT-qPCR)法检测
取经过β-HB处理的细胞,用Trizol法提取细胞内总RNA。反转录试剂盒反转合成cDNA。以β-Actin 为内参,Power SYBR®Green PCR Master MIX进行RT-qPCR检测,引物序列:c-myc 正向序:5′-CCTGGTGCTCCATGAGGAGA-3′;反向序列:5′-CTCCAGCAGAAGGTGATCCAGA-3′;β-actin正向序列:5′-GGGAAATCGTGCGTGACATTAAG-3′;反向序列5′-TGTGTTGGCGTACAGGTCTTTG-3′。引物由生工生物工程(上海)股份有限公司合成。扩增条件为:50 ℃ 2 min 升温,95 ℃ 10 min初始变性,95 ℃ 15 s 变性,60 ℃ 1 min退火延伸,其中初始变性、变性、退火延伸3步骤重复40个循环。并用2-ΔΔCT法比较表达量的差异。
1.6 Western blotting法检测
取经过β-HB处理的细胞,PBS洗3次,以PMSF:RIPA=1∶100的比例配置蛋白裂解液,裂解细胞提取蛋白。并用BCA蛋白定量法测定蛋白含量,100 ℃煮沸10 min。变性蛋白等质量、等体积上样于10%(质量分数)分离胶的聚丙烯酰凝胶中,经电泳、电转、洗膜后,PVDF膜用含5%(质量分数)脱脂奶粉的1×TBST室温封闭2 h,一抗4 ℃孵育过夜。第2天回收一抗,用1×TBST洗膜3次后,加入荧光二抗,室温下避光孵育1 h,1×TBST洗膜后,用Odyssey CLx仪检测蛋白条带。
1.7 统计学方法

2 结果
2.1 β-HB在体外对脑胶质瘤细胞生长的影响
用不同浓度β-HB(0、40、60、80、100、120 mmol/L)处理脑胶质瘤细胞48 h后,CCK8 检测细胞的增生情况,β-HB对 LN229及U87细胞的生长抑制随着药物浓度增加而升高,呈现出浓度依赖性,详见图1。
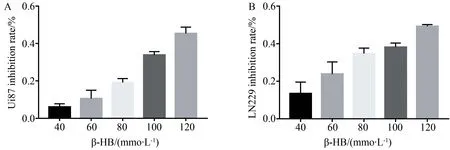
图1 β-HB对脑胶质瘤细胞U87及LN229的生长抑制作用Fig.1 Effect of β-HB on proliferation ability in glioma cell lines U87 and LN229
2.2 β-HB对脑胶质瘤细胞糖酵解水平的影响
与对照组相比,β-HB处理后细胞糖酵解水平下降。在U87细胞中,3组间细胞糖酵解水平差异有统计学意义(F=39.511,P=0.000),其中两两比较60 mmol/L组最大糖酵解能力为(25.53±3.07)mpH/min,与对照组相比(28.49±2.52)mpH/min差异无统计学意义,80 mmol/L组最大糖酵解能力为(11.83±1.49)mpH/min,与对照组相比明显降低,差异有统计学意义(P<0.05)。在LN229细胞中,60 mmol/L组和80 mmol/L组最大糖酵解能力分别为(7.37±2.50)mpH/min、(6.11±2.03)mpH/min,与对照组相比(11.50±1.38)mpH/min明显降低,差异有统计学意义(F=5.828,P<0.05),详见图2。
2.3 β-HB对脑胶质瘤细胞c-myc基因水平的影响
不同浓度β-HB(0、60、80 mmol/L)分别处理细胞24 h及48 h,检测c-myc的基因及c-myc蛋白表达量。与对照组相比,在U87细胞中,实验组c-myc基因表达量均下降且差异有统计学意义(F=1654.61,P=0.000),LN229细胞中c-myc基因表达量均下降且差异有统计学意义(F=161.94,P<0.05),详见图3。
3 讨论
葡萄糖代谢异常是肿瘤细胞的显著特征大多数肿瘤细胞表现为葡萄糖摄取增加、糖酵解速率加快以及乳酸生成增多。虽然糖酵解是一种低效的产能方式(一分子葡萄糖仅能产生2分子ATP,而有氧氧化可生成38或36分子ATP),但其产生ATP的速率是有氧氧化的10~100倍[13],所以通过糖酵解就能更快且更多的生成ATP,满足肿瘤细胞快速增生的需要。另外,磷酸戊糖途径产生的NADPH及5-磷酸核苷,可以被肿瘤细胞利用,合成核酸和脂质等生物大分子,这些都是肿瘤细胞生长和增生必不可少的。因此,干预这一过程为肿瘤治疗提供了新思路。
KD模拟了人体的饥饿状态,迫使机体以脂肪作为能量代谢的主要物质。脂肪则在肝内通过β氧化生成酮体。β-HB不仅是脂肪的代谢产物,其本身就具有抗肿瘤作用。在KD的基础上使用酮类补充剂,可以增强KD的效果,甚至在单独用于某些疾病时也是有效的。此外,β-HB具有多种信号功能,包括与细胞表面受体结合调节细胞过程,并间接的改变其他代谢产物的水平[14]。Shukla等[15]的研究显示,β-HB可以下调胰腺癌细胞葡萄糖转运体-1(glucose transporter 1,GLUT1)及乳酸脱氢酶A(lactate dehydrogenase-A,LDHA)的表达,使细胞葡萄糖摄取、糖酵解通量及谷氨酰胺摄取量降低。
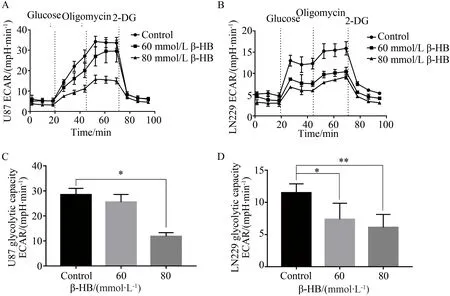
图2 β-HB处理脑胶质瘤细胞U87及LN229后糖酵解水平Fig.2 Glycolytic capacity in glioma cell lines U87 and LN229 after treated with β-HB
A:U87 treated with different concentrations of β-HB;B:LN229 treated with different concentrations of β-HB;C:glycolytic capacity in U87;D:glycolytic capacity in LN229.*P<0.05,**P<0.01;β-HB:β-hydroxybutyrate;ECAR:extracellular acidification rate;2-DG:2-deoxyglucose.
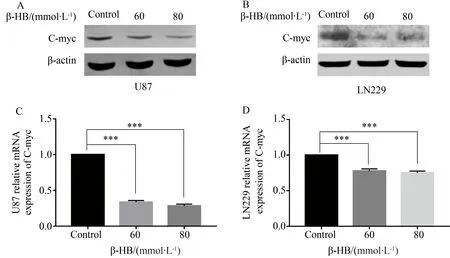
图3 β-HB处理脑胶质瘤细胞U87及LN229后c-myc表达水平Fig. 3 Protein and mRNA expression of c-myc after treated with β-HB in U87 and LN229
A: Expression of c-myc protein in U87 was assayed by Western blotting;B: Expression of c-myc protein in LN229 was assayed by Western blotting;C: Relative mRNA expression of U87 c-myc was determined by RT-qPCR;D: Relative mRNA expression of LN229 c-myc was determined by RT-qPCR;***P<0.001;β-HB:β-hydroxybutyrate;RT-qPCR:real-time quantitative polymerase chain reaction.
本研究中,首先探讨了β-HB对脑胶质瘤细胞系U87及LN229的作用,发现β-HB可以抑制细胞的生长,且呈剂量依赖性。同时,对ECAR进行测定,笔者发现经过β-HB处理后的细胞糖酵解水平及最大糖酵解能力明显下降,提示β-HB可能通过抑制细胞糖酵解,从而抑制细胞生长。虽然本研究已经验证了KD对体外胶质瘤细胞的抑制作用,但是由于体内与体外肿瘤生长环境的差异性,还需进一步研究β-HB对原位脑肿瘤动物模型的效应。
C-myc是由myc原癌基因编码的一种转录因子,参与细胞的增生、转化及凋亡等生理过程。在结肠癌、乳腺癌、前列腺癌和脑胶质瘤等许多肿瘤中都存在myc基因表达失调。早期研究[16]显示,c-myc可以与LDHA的启动子结合并诱导LDHA表达增加,这将c-myc与葡萄糖代谢调节联系起来。随后的研究[17-18]表明,c-myc还可以调节GLUT1、己糖激酶-2(hexokinase 2,HK2)、磷酸果糖激酶-M 1(phosphofructokinase M1,PFKM1)和烯醇化酶-1(enolase 1,ENO1)的表达,增加葡萄糖转运及分解代谢。
因此,肿瘤中过表达c-myc可以增强细胞的“沃伯格”效应。本研究中检测了经过β-HB处理后细胞c-myc的表达情况,发现c-myc基因及c-myc蛋白都有不同程度的降低,说明β-HB可能通过降低c-myc基因的表达从而抑制细胞的糖酵解水平,进而使细胞的生长停滞。但β-HB是否是通过c-myc调控糖酵解过程中的关键酶表达,亦或是其他信号通路影响胶质瘤细胞的代谢还需进一步探究。
综上所述,本研究探讨了β-HB在脑胶质瘤细胞增生及糖酵解方面的影响,证明β-HB能够抑制脑胶质瘤细胞的增生,且对其糖酵解水平的抑制也随浓度升高而增强,而β-HB对脑胶质瘤细胞增生及糖酵解的抑制作用可能是由于下调c-myc基因导致的。根据“沃伯格”效应的原理,本研究提示KD治疗脑胶质瘤是可行的。通过高脂肪低碳水化合物的饮食方式,提高体内β-HB浓度,或使用酮类补充剂以及抑制酮体代谢过程中的关键酶使体内β-HB维持在一个适当的浓度,从而达到控制肿瘤的目的,这为胶质瘤地治疗提供了新思路。

