对比增强能谱乳腺X线摄影诊断乳腺影像报告和数据系统4类钙化
龙 蓉,曹 崑,曹 敏,李海蛟,孙应实
(北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
钙化是乳腺X线检查中最主要的影像学征象之一,40%乳腺癌中可出现钙化[1],80%导管原位癌仅表现为乳腺钙化[2]。部分乳腺病变X线仅以钙化为征象,不伴肿块或结构扭曲等其他征象,故只能依据钙化分布和形态对乳腺疾病进行定性诊断。依据美国放射学会(American College of Radiology, ACR)发布的2013版乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)指南[3],BI-RADS 4类病变恶性可能性为2%~95%,需进行活检等进一步检查,以获得定性诊断[4]。研究[5]表明,BI-RADS 4类钙化中,仅20%~25%最终病理结果为恶性。因此,提高乳腺钙化的诊断效能成为目前研究的热点。对比增强能谱乳腺X线摄影(contrast-enhanced spectral mammography, CESM)在常规乳腺X线摄影的基础上应用对比剂,可以同时获得乳腺病变的形态学和血供信息。本研究对比分析CESM和常规全视野数字化乳腺X线摄影(full-field digital mammography, FFDM)在BI-RADS 4类钙化中的诊断价值。
1 资料与方法
1.1 一般资料 收集2015年1月—2016年12月于我院接受FFDM检查及乳腺钙化灶经术前导丝定位的48例乳腺疾病患者(FFDM组),均为女性,年龄32~72岁,平均(48.7±8.2)岁;收集2017年3月—2018年1月于我院接受CESM检查的30例乳腺疾病患者(CESM组),均为女性,年龄37~76岁,平均(47.9±7.4)岁。纳入标准:①乳腺X线片中出现钙化征象,不伴肿块或结构扭曲等其他征象;②根据ACR BI-RADS分类标准[3]诊断为BI-RADS 4类病变;③临床体检或超声均未于病变部位发现软组织肿块;④于我院接受乳腺钙化活检或手术切除,获得病理结果。排除标准:3个月内病变侧乳腺接受过干预或治疗,如手术、活检、放射治疗等。
1.2 仪器与方法 FFDM检查采用GE Senographe Esse和Siemens Novation DR钼靶机,行双侧乳腺标准体位投照,包括头足(craniocaudal, CC)位和内外侧斜(mediolateral oblique, MLO)位。采用自动管电压及管电流。
CESM检查采用GE Senographe Essential CESM钼靶机。检查前于立位经前臂血管团注含碘对比剂碘海醇(300 mgI/ml),剂量2 ml/kg体质量,流率2.5 ml/s,开始注射对比剂后2~7 min内对双侧乳腺依次行CC位及MLO位摄片,在同一压迫体位下进行低能和高能射线摄影,低能射线为26~31 kVp,高能射线为45~49 kVp,采用自动管电流和管电流,分别获得低能图像和高能图像,经后处理得到减影图像。
1.3 图像分析 由2名有3年工作经验的放射科医师在不知晓临床及病理结果的情况下分别独立阅片,意见不同时由第3名具有15年以上工作经验的上级医师最终确定。以ACR BI-RADS分类中的钙化描述为依据,对所有钙化的分布和形态进行分类描述。将钙化根据形态分为无定形、粗糙不均质、细小多形性、细线样或细分枝状及其他形态;根据分布分为团簇状、区域性及段样,计算各钙化的分布和形态诊断恶性钙化的效能。根据ACR BI-RADS分类,在FFDM图像上,将BI-RADS 4C类钙化诊断为恶性。在CESM图像上,以钙化处有无强化为标准,有强化诊断为恶性,无强化诊断为良性。
1.4 统计学分析 采用SPSS 20.0统计分析软件。以病理结果为金标准,分别计算FFDM及CESM诊断恶性钙化的敏感度、特异度、阳性预测值、阴性预测值及准确率。采用χ2检验比较FFDM与CESM对恶性钙化诊断效能和2组间钙化特征。P<0.05为差异有统计学意义。
2 结果
2.1 FFDM组 48例均为单发钙化病灶,共纳入48个病灶,其中恶性病灶13个,包括12个导管原位癌,1个腺样囊腺癌;良性病灶35个,包括24个乳腺腺病,3个纤维腺瘤,2个导管内乳头状瘤和6个乳腺组织。根据钙化形态及分布特征诊断恶性钙化的敏感度、特异度和准确率见表1。FFDM诊断恶性钙化的敏感度、特异度、阳性预测值、阴性预测值及准确率分别为69.23%(9/13)、77.14%(27/35)、52.94%(9/17)、87.10%(27/31)及75.00%(36/48)。

表1 FFDM组各钙化形态和分布特征诊断恶性钙化的效能[%(个)]
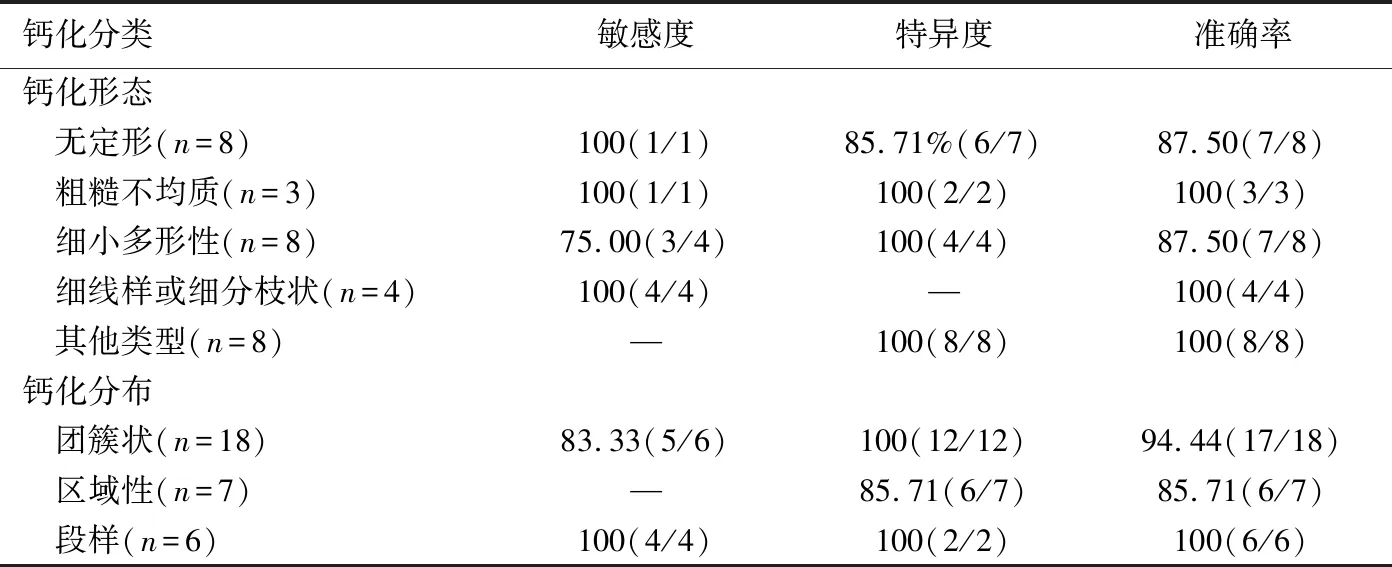
表2 CESM组各钙化类型和分布特征诊断恶性钙化的效能[%(个)]
2.2 CESM组 30例中,29例单发,1例多发,共31个病灶,多发病变为非同质病灶,最终纳入31个病灶,其中恶性病灶10个,包括8个导管原位癌,2个浸润性导管癌;良性病灶21个,包括乳腺腺病15个,纤维腺瘤3个,导管内乳头状瘤1个,乳腺组织2个。
10个恶性钙化中,9个诊断正确,21个良性钙化中20个诊断正确,1个假阴性为导管内原位癌,1例假阳性为导管内乳头状瘤。CESM诊断恶性钙化的敏感度、特异度、阳性预测值、阴性预测值及准确率分别为90.00%(9/10)、95.24%(20/21)、90.00%(9/10)、95.24%(20/21)及93.55%(29/31),见图1、2。CESM组各钙化形态及分布特征诊断恶性钙化的的敏感度、特异度和准确率见表2。
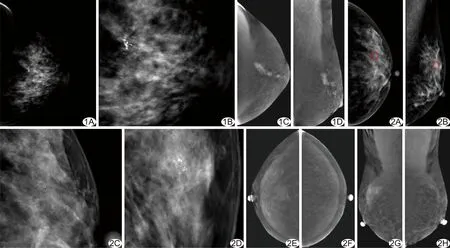
图1 患者45岁,超声体检发现左乳钙化,穿刺活检病理证实为浸润性导管癌 A、B.CESM低能图像CC位(A)和钙化部位局部放大(B)图像示左乳外上象限段样分布微钙化; C、D.CESM减影图像CC位(C)和MLO位(D)示钙化处可见强化 图2 患者46岁,左侧乳腺低级别导管原位癌 A~D.CESM低能图像,A为CC位,B为MLO位,C、D分别为A、B局部放大图像,显示左侧乳腺外象限团簇状钙化; E~H.CESM减影图像显示双侧乳腺体强化,左侧乳腺钙化处及周围腺体亦可见强化
2.3 FFDM与CESM的诊断效能对比 CESM诊断BI-RADS 4类钙化的阳性预测值及准确率均高于FFDM(χ2=3.891、4.444,P=0.049、0.035),敏感度、特异度及阴性预测值差异无统计学意义(χ2=1.433、3.186、0.955,P=0.231、0.074、0.329)。
FFDM与CESM组患者间钙化形态及分布差异无统计学意义(χ2=9.160、1.557,P=0.057、0.459)。
3 讨论
3.1 乳腺微钙化的诊断方法及对比 乳腺X线摄影是检出乳腺钙化最敏感的方法,优于超声和MRI。钙化形态和分布是判断良恶性的重要因素,团簇状、段样或线样分布钙化比散在或区域性分布的钙化恶性可能性大,无定形、细小多形性及细线样或细分枝状钙化的恶性可能分别为20%~26%、25%~41%和>80%[6]。典型恶性钙化或钙化同时伴肿块或结构扭曲等其他征象时,临床不易漏诊或误诊;但以钙化为唯一征象、尤其形态类型难以分类时,判断良恶性较困难。乳腺X线诊断的BI-RADS 4类钙化中,最终仅20%~25%病理为恶性[5],提示以钙化为诊断标准,敏感度高而特异度较低。
超声对乳腺结节的敏感度较高,但对钙化不敏感,仅能发现35.3%乳腺钙化[7],在不伴肿块时无法根据钙化本身形态来判断良恶性。动态增强MRI是目前检出乳腺癌最敏感的方法,敏感度达79%~98%[8],但不能直接显示钙化,仅能参考X线片中钙化的位置,观察相应区域是否有强化及强化方式来判断钙化部位是否存在恶性病变,诊断BI-RADS 4类钙化良恶性的敏感度、特异度和准确率为96%、82%和88%[9];但乳腺X线与MR检查体位不同,前者为站立位,且在压迫状态下腺体重叠,而后者采取俯卧位检查,腺体处于自然下垂状态,导致MRI上难以精准定位X线片所示钙化[10]。
3.2 CESM对乳腺钙化诊断的价值 CESM是在传统乳腺X线摄影技术基础上结合使用对比剂的一项新检查技术,在同一个压迫体位,可在很短时间间隔内进行低能和高能2个不同能量射线的照射,获得2组图像,低能射线的能量一般为26~31 kVp,高能射线的能量一般为45~49 kVp。碘原子发生电离的最低能量为33.2 keV[11],在低能X线照射下,碘不能吸收X线发生电离,而软组织能够吸收低能X线,因此低能图像相当于传统的乳腺X线摄影图像;而在高能X线照射下,碘及软组织均能够吸收X线,故高能图像与低能图像的减影图像为碘摄取图像。Lobbes等[12]比较113例同时接受CESM和FFDM检查的患者,发现CESM诊断乳腺癌的敏感度、特异度均高于FFDM。uczyńska等[13]报道,CESM诊断乳腺癌的敏感度和准确率为100%和79%,MRI为93%和73%,两者比较,CESM敏感度高于MRI。CESM一次曝光可获得2组图像,其中低能图像与传统乳腺X线摄影图像类似,可用于评价钙化的形态和分布;而减影图像与MRI增强图像类似,可用于评价钙化部位是否存在可疑血供。CESM结合了乳腺X线摄影和增强MRI的优势,有望提高对乳腺钙化的诊断效能。Cheung等[14]分析了94例BI-RADS 4类钙化患者的CESM图像,其诊断恶性钙化的敏感度、特异度、阳性预测值、阴性预测值及准确率分别为88.89%、86.56%、72.72%、95.08%及87.24%,本研究结果与之相似。本研究结果显示,CESM诊断恶性钙化的阳性预测值和准确率均高于FFDM(P均<0.05)。通过对钙化形态和分布进行分类,本研究发现CESM和FFDM对不同类型钙化的诊断能力有所差别,但本研究中样本量较少,尚需增加样本数量以进一步验证所获结果。
与既往研究[14-15]结果相似,本组1例CESM中假阴性患者为导管内原位癌,这也是MRI易漏诊的病变。对此类病变,CESM较MRI的优势在于能够同时分析钙化形态,CESM读片时应兼顾低能图像表现,同时辅以减影图像所示强化特征。另外,本组CESM出现误诊或漏诊的病例与正常腺体广泛强化、影响病灶局部判断有关(图2)。注射对比剂后,正常乳腺腺体在CESM上也会产生强化,广泛的正常腺体强化必然会对病灶的强化产生遮掩,且恶性簇状钙化的强化范围通常较小,在腺体强化的背景下不易发现。临床工作中需反复仔细阅片,并与对侧乳腺进行对比,以尽可能降低误诊或漏诊。
本研究的不足在于CESM应用于临床的时间短,经验较少,在判断强化上仍有很多困难;样本量较小,仍需扩大样本量、积累经验,以进一步观察CESM的应用价值。
总之,作为一种新的乳腺检查方法,CESM既能提供常规乳腺X线的影像信息,又能观察病变的血供情况,有利于提高对BI-RADS 4类钙化的诊断效能。

