MRI增强早期及晚期全肿瘤直方图分析诊断肿块型乳腺癌新辅助化疗后残余癌
曹 崑,赵 博,李艳玲,曲玉虹,李晓婷,孙应实
(北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
新辅助化疗(neoadjuvant chemotherapy, NAC)是治疗乳腺癌的重要方法,疗效能否达到病理完全缓解与预后相关[1]。MR是目前判断NAC后有无残余癌的最佳影像学方法之一[2-3],但肿瘤治疗后MRI表现与治疗前不同,仅根据形态学、动态增强曲线等常规MRI参数难以判断NAC后是否存在残余癌。目前仅以原癌灶局部存在强化灶为公认的判断残余癌的MRI征象,但总体准确率欠佳[4]。MRI全肿瘤直方图分析可以提供更多反映肿瘤内部异质性的参数。本研究探讨采用MR增强早晚期全肿瘤直方图分析诊断肿块型乳腺癌NAC后残余癌的价值。
1 资料与方法
1.1 一般资料 选取2015年1—6月我院收治的经粗针穿刺病理活检确诊的肿块型乳腺癌患者52例,均为女性,年龄23~64岁,平均(49.2±10.4)岁;其中浸润性导管癌Ⅰ级2例、Ⅱ级35例、Ⅲ级12例,浸润性微乳头状癌1例,化生癌1例,导管内原位癌1例。纳入标准:肿瘤均经手术切除,术前接受NAC(蒽环类或紫杉醇类为基础的化疗方案,4~6个周期)。排除标准:非肿块型乳腺癌、手术与第1次化疗开始时间间隔>6个月的乳腺癌患者。
1.2 仪器与方法 采用GE Optima 360 1.5T和Discover MR 750 3.0T MR扫描仪,4通道乳腺相控阵线圈。嘱患者俯卧,双侧乳腺自然下垂置于乳腺线圈内。首先行快速回复自旋回波序列双乳矢状位T2W(脂肪抑制)扫描,TR 2 000 ms,TE 85 ms,层厚4.0 mm,层间距1.0 mm;再行双乳矢状位动态增强三维T1W(脂肪抑制)容积成像,TR 5.3 ms,TE 2.6 ms,TI 12.0 ms,FOV 20 cm×22 cm,矩阵256×256,层厚 2.0 mm,NEX 0.75,单次采集时间45~55 s,每时相间隔时间10~15 s。对比剂为Gd-DTPA,剂量 0.2 mmol/kg体质量,经高压注射器以2.0 ml/s流率团注,注射完成后追加10 ml生理盐水。增强前扫描1个时相作为蒙片,对比剂注入同时开始扫描5个时相作为动态增强影像。
1.3 图像分析 由1名有3年影像科工作经验的低年资住院医师和1名有10年以上乳腺影像学诊断经验的高年资医师在不知晓病理结果的情况下共同阅片,经协商达成最终结论。采用2个增强时相与蒙片相减的减影MRI,分别为早期增强时相(动态时相第2期,采集时间为对比剂注入后1 min 45 s~2 min)及晚期增强时相(最后1个时相,采集时间为对比剂注入后5~6 min)。在PACS工作站对比治疗前后MRI,确认病灶位置,存在多发病灶时,选择最大的主病灶进行分析。将减影图像传入基于3D Slicer平台开发的纹理分析软件(第三方软件),在NAC后增强早期减影图上勾画覆盖全病灶强化区的ROI。由低年资医师首先勾画ROI,之后由高年资医师复核、修改。获取直方图参数共21个,包括残余强化灶体积,增强早期和晚期信号强度最大值(maximum, Mx)及第90、75、50、25、10百分位数、平均值、偏度值和峰度值等。若原肿瘤位置已无强化灶,则不勾画ROI,判断为影像学无残余癌。
1.4 病理检查 将手术切除病理标本以10%甲醛固定24 h,叶状切开后多点取材,行常规HE染色。原肿瘤位置见浸润性癌成分时判定为残余癌,癌细胞完全消失或仅含导管原位癌成分则判定为无残余癌。
1.5 统计学分析 采用SPSS 22.0统计分析软件。符合正态分布的连续变量以±s表示,非正态分布者以中位数(上下四分位数)表示。2组间直方图参数比较采用两独立样本t检验和非参数检验(Mann-WhitneyU);以ROC曲线分析各参数诊断残余癌的效能;采用多因素二分类Logistic回归方程分析残余癌的影响因素,以Fisher检验比较不同影像学诊断标准对残余癌的诊断效能。P<0.05为差异有统计学意义。
2 结果
病理结果示残余癌31例,无残余癌21例(镜下无癌细胞13例、有原位癌成分8例)。早期增强减影MRI示14例原肿瘤位置无强化灶,病理示12例无残余癌、2例残余癌;38例有强化灶,病理示残余癌29例(残余癌组,图1)、无残余癌9例(无残余癌组,图2)。残余癌组与无残余癌组间残余强化灶体积、增强早期信号强度Mx、增强晚期峰度值差异均有统计学意义(P均<0.05),其余参数差异均无统计学意义(P均>0.05),见表1。
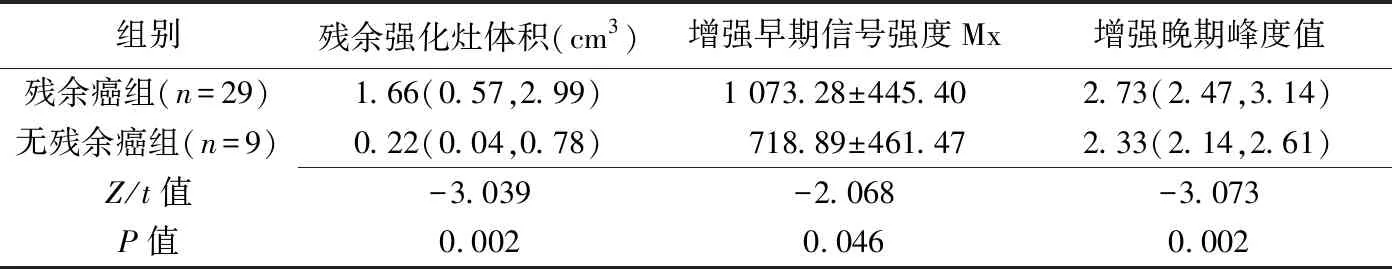
表1 残余癌组与无残余癌组间差异有统计学意义的直方图参数
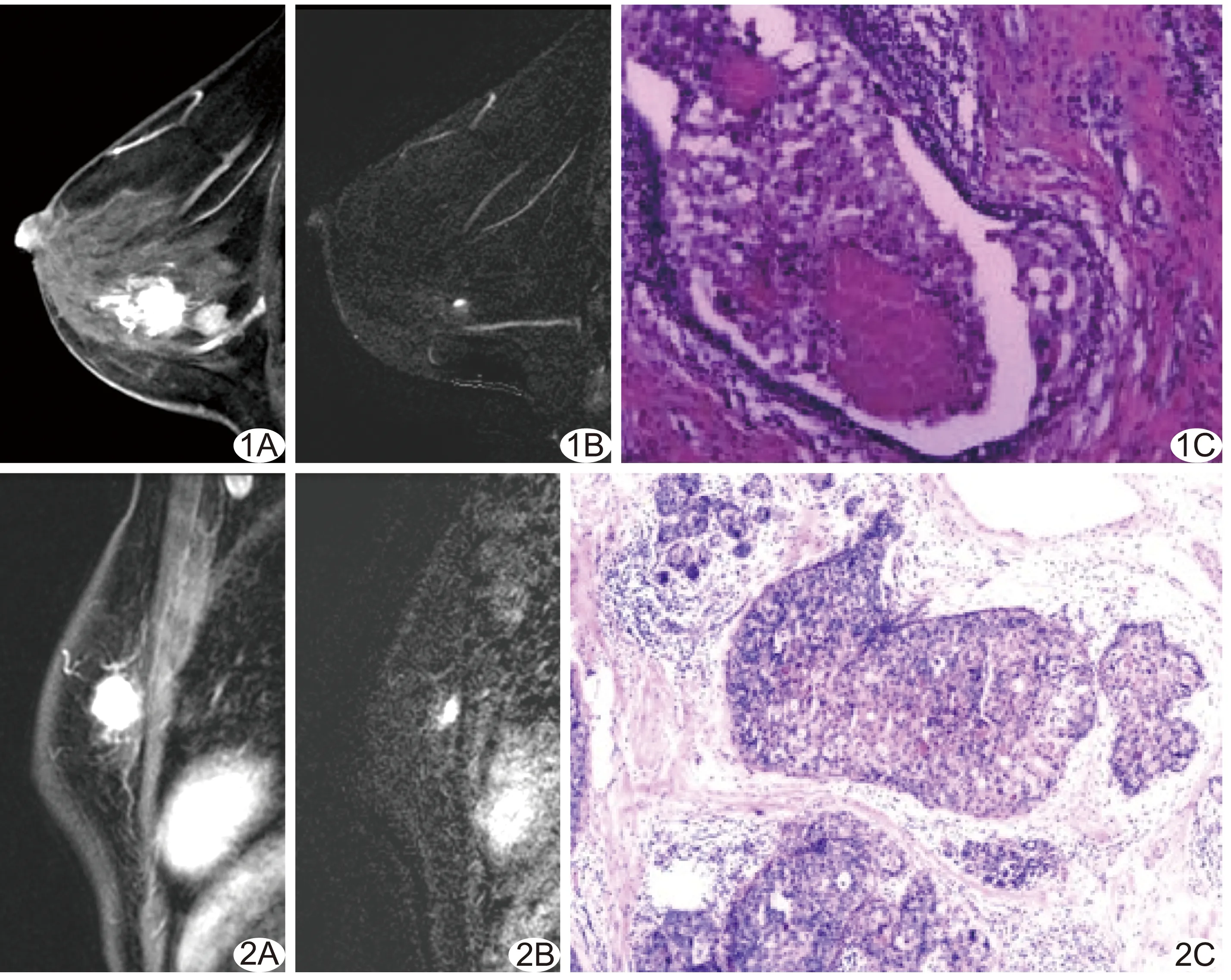
图1 患者女,53岁,右侧乳腺浸润性导管癌Ⅲ级 A.NAC前增强早期MRI示右侧乳腺多发高强化病灶; B.NAC后增强早期MRI减影示病灶明显缩小,但仍可见结节状强化,增强晚期峰度值为2.79(>2.25),考虑残余癌; C.病理示瘤床内见浸润性导管癌,病理诊断残余癌(HE,×40) 图2 患者女,55岁,左侧乳腺浸润性导管癌Ⅱ级 A.NAC前增强早期MRI示左侧乳腺高强化病灶; B.NAC后增强早期MRI减影图示病灶明显缩小,但仍见明确强化,增强晚期峰度值为2.19(<2.25),考虑无残余癌; C.病理示瘤床内仅存在高级别导管原位癌,病理诊断无残余癌(HE,×40)
将残余强化灶体积、增强早期信号强度Mx、增强晚期峰度值代入ROC曲线,获得对应的AUC依次为0.839、0.718及0.843(P均<0.05)。多因素二分类Logistic回归分析结果显示,增强晚期峰度值是残余癌的独立影响因素[P=0.025,OR=4.303,95%CI(1.205,15.359)]。
以原肿瘤位置MRI有无强化灶作为残余癌的影像学诊断标准,其诊断特异度57.14%(12/21)、敏感度93.55%(29/31)、准确率78.85%(41/52)、阳性预测值76.32%(29/38)、阴性预测值85.71%(12/14);根据ROC曲线确定增强晚期峰度值界值为2.25,其诊断残余癌的特异度为76.19%(16/21)、敏感度90.32%(28/31)、准确率84.62%(44/52)、阳性预测值84.85%(28/33)、阴性预测值84.21%(16/19);2种诊断标准的准确率比较差异有统计学意义(P=0.048),其余指标比较差异无统计学意义(P均>0.05)。
3 讨论
肿瘤内部存在异质性,而MRI直方图能够提供描述肿瘤异质性的相关参数,并以此鉴别良恶性和评价预后[5-6]。全肿瘤ROI能够避免因选择ROI过小而导致的人为差异。本研究在全肿瘤范围内检测MR增强早晚期直方图相关参数,探讨直方图分析诊断肿块型乳腺癌NAC后残余癌的能力。
3.1 残余癌与非残余癌间增强早晚期MR直方图参数差异 既往研究[7]显示,直方图分析中的高强化峰值(第90和第75百分位数)有助于鉴别乳腺良恶性病变 。本研究原肿瘤部位存在强化灶的残余癌与无残余癌组间MR增强早期信号强度Mx差异有统计学意义(P=0.046),增强早期及晚期其他信号强度百分位数差异均无统计学意义(P均>0.05)。直方图描述中的偏度值和峰度值分别代表曲线偏态分布程度和峰部尖度。本研究中残余癌组与无残余癌组间早期时相偏度值和峰度值均无明显差异,与既往研究[8]结果相符;增强晚期峰度值差异不仅有统计学意义(P=0.002),且多因素分析结果显示其是残余癌的独立影响因素[P=0.025,OR=4.303,95%CI(1.205,15.359)]。Chang等[9]研究乳腺癌NAC效果的动态增强直方图,发现NAC效果相对好的肿瘤曲线峰值降低而峰度值增高,提示NAC效果好的肿瘤内部成分可能存在从不均质到均质的变化;峰度值差异也可认为是内部强化像素的均质性差异。与上述研究[9]结果不同,本研究残余癌组增强晚期峰度值较无残余癌组更高,可能因为瘤床内部成分混杂,同时存在变性坏死癌细胞、纤维组织及炎细胞等,强化较散。既往研究[10]报道,ROI内反映肿瘤内部均质性程度的参数在化疗前后可能发生变化,但由于选择的均质性参数各有不同,结果尚无定论。
3.2 直方图参数对肿块型乳腺癌NAC后残余癌的诊断效能 目前诊断乳腺癌NAC后残余癌的公认影像学标准为MRI示原癌灶区域存在残余强化灶。一项基于25项研究、1 212例乳腺癌患者的荟萃分析结果显示,MRI诊断化疗后残余癌的敏感度仅约63.10%[11]。本研究以强化早期时相作为MR扫描的基本序列,以减影图像上原肿瘤部位有无确切强化灶为诊断标准,诊断NAC后残余癌的敏感度达93.55%(29/31),但特异度仅为57.14%(12/21)。有研究[12]显示,病灶体积和长径与乳腺癌NAC后病理反应性分级的相关性最好,直径≤0.2 cm可用于鉴别微小残余癌与病理完全缓解[13]。本研究中残余强化灶体积在残余癌与无残余癌间差异有统计学意义(P=0.002),但其并非残余癌的独立影响因素,原因可能为定性诊断小体积强化灶仍较困难。根据ROC曲线确定增强晚期峰度值界值为2.25,并以此界值作为残余癌影像学诊断标准,其诊断残余癌的特异度为76.19%(16/21)、敏感度90.32%(28/31)、准确率84.62%(44/52),诊断准确率较以有无强化灶作为诊断标准时提高。
本研究的不足:①仅以肿块型乳腺癌为研究对象,这是由于非肿块型乳腺癌病变形态松散,难以确认治疗后的瘤床活性区,全肿瘤ROI勾画易存在较大误差,而肿块型病变的全肿瘤ROI勾画相对简单;②样本量相对少,未分析观察者间一致性。
综上所述,MR增强早期及晚期全肿瘤直方图能够反映乳腺癌病灶内部的信号分布,其中增强晚期峰度值可用于诊断NAC后残余癌。

