不同大气CO2浓度升高与施氮互作对冬小麦光合与生长的影响
夏晔,胡正华*,刘超,刘晓萌,于凌飞,张琳,孙文娟,尤钰杰
(1. 南京信息工程大学气象灾害预报预警与评估协同创新中心/江苏省农业气象重点实验室,江苏南京 210044;2. 中国科学院植物研究所植被与环境变化国家重点实验室,北京 100093)
在全球工业飞速发展,人口数量不断增加的背景下,人类活动引起的温室气体过度排放成为全球气候变暖的主要原因[1]。CO2、CH4和N2O是重要的温室气体,总排放量占人为温室气体排放的98.2%并仍有继续上升[2-3]。大气CO2浓度从工业革命前的 280 μmol/mol上升到目前的 409 μmol/mol[4]。在此背景下,农作物对大气CO2浓度升高的响应受到国内外学者广泛关注。
已有研究表明,CO2浓度增加在一定程度上延长了作物营养生长时间,对作物生长有促进作用[5-6],可以增加作物的株高、各组织生物量及产量,对地上干物质累积的贡献大于地下部分[7-9]。CO2浓度升高对光合作用有直接影响:营养生长阶段提高叶片光化学性能[10-11],促进净光合速率;生殖生长阶段提高作物灌浆速率,促进籽粒产量形成[12-13]。但也有研究表明,长期处于高CO2浓度,初期作物净光合速率会大幅增加,后期增幅减半并逐渐下降直至消失,出现光合下调现象[14-15]。尤其在大气CO2浓度倍增的条件下,光合速率和叶绿素含量受抑制作用明显[16]。氮素作为基本矿物元素,对植物生长发育具有重要意义,氮肥供应不足将阻碍叶片氮素吸收,是作物光合产物积累的重要限制因素[17],在很大程度上影响着作物的生长发育状况[18-20]。目前,CO2浓度升高对作物生理生态过程的影响研究,大多在高CO2浓度条件下进行,即CO2浓度骤增且长期保持在高CO2浓度。然而,大气CO2浓度变化是一个逐渐增加的过程,不同CO2浓度对作物生理生态特性的影响程度可能存在着差异。不同CO2浓度水平对作物生长和产量结构影响方面的研究尚少,孙文娟等[13]对水稻进行不同浓度的CO2处理,发现与低CO2浓度升高相比,高CO2浓度升高增加了灌浆前期的穗重,并使最大灌浆速率出现的时间有所提前;刘超等[21]和刘晓萌等[22]研究表明,与低CO2浓度升高相比,高CO2浓度升高增加了叶片光合氮素利用效率。
本文利用开顶式气室(OTC)组成的CO2浓度升高自动调控平台,试图通过对不同CO2浓度和氮肥水平下冬小麦叶片光响应曲线、CO2响应曲线的变化和植株地上器官干重的观测,分析了CO2浓度升高和施氮水平对冬小麦光合作用、生物量和产量结构的影响,并探讨了其可能机理,对预测未来不同碳排放情景下作物生产能力与合理施用氮肥具有重要意义,也为准确评估未来气候变化对粮食安全的影响提供科学依据。
1 材料与方法
1.1 研究区域概况
田间试验于2016—2017年冬小麦生长季进行,试验平台位于南京信息工程大学农业气象与生态实验站(32.16° N,118.86° E),属亚热带季风气候区,全年降水季节性差异较为明显,多年平均降水量1 102 mm,相对湿度76%,年平均温度15.4 ℃,无霜期237 d。
供试土壤为潴育型水稻土,灰马肝土属,耕作层土壤质地为壤质粘土。黏粒含量为26.1%,土壤容重为1.57 g/cm3,土壤pH(H2O)值为6.3,有机碳和全氮含量分别为11.95 g/kg与1.19 g/kg。
1.2 CO2浓度自动调控平台
田间CO2浓度自动调控平台包括开顶箱(OTC)、CO2传感器、自动控制系统和通气装置。OTC为正八边形棱柱体(高3 m,对边直径3.75 m,底面积10 m2),铝合金框架,顶部开口向内倾斜45°,安装高透光性普通玻璃。每个OTC内配置CO2传感器和温湿度自动记录仪,CO2传感器(GMM222传感器,Vaisala公司,芬兰),量程为0~2 000 μmol/mol,响应时间30 s。自动控制系统主要由数据采集、主控板、加压模块、阀控制模块、流量控制模块和CO2感应模块组成。通过计算机程序实现各个OTC内CO2浓度的自动监测和调节,保证OTC内CO2浓度维持在目标浓度值[23]。CO2气源为高纯CO2钢瓶(40 L,纯度为99%),利用汇流盘连接24个钢瓶集中供气。
1.3 试验设计
每个OTC内分两个区域:核心区与盆栽区,盆栽区位于核心区两侧。核心区用于研究CO2浓度升高对光合特性的影响,盆栽区用于研究CO2浓度升高与氮肥水平对生物量及产量结构的影响。
试验的主处理为不同CO2浓度升高水平。CO2浓度设置3个水平:以环境大气CO2浓度为对照(CK)、低CO2浓度升高(T1,CO2浓度在CK基础上增加 40 μmol/mol)、高 CO2浓度升高(T2,CO2浓度在CK基础上增加200 μmol/mol),每个水平有4个重复,共12个OTC。
试验的副处理为不同氮肥水平。采用盆栽方法,使用无底盆钵,钵内径和高均为20 cm。每个OTC使用30个盆钵(每侧盆栽区15个)。两侧盆栽区均设置3个氮肥水平:不施氮肥(N0,0 kgN/hm2)、中氮肥量(N1,220 kgN/hm2)、高氮肥量(N2,400 kgN/hm2)。氮肥施用包括基肥和追肥,其中基肥为复合肥(N∶P∶K为15%∶16%∶16%),追肥为尿素(N含量为46.7%)。核心区将70%作为基肥(154 kgN/hm2)、30%作为返青肥(66 kgN/hm2);盆栽区将80%作为基肥(N1为176 kgN/hm2,N2为320 kgN/hm2)、20% 作为返青肥(N1为 44 kgN/hm2,N2为 80 kgN/hm2)。
主处理和副处理的组合为:CKN0、CKN1、CKN2、T1N0、T1N1、T1N2、T2N0、T2N1、T2N2。
供试冬小麦品种为扬麦22,属春性品种,弱筋小麦,全生育期187 d,于2016年11月15日播种,2017年2月6日返青,5月12日成熟。水分等其它管理措施与当地常规方式一致。
1.4 测定指标与方法
1.4.1 光响应和CO2响应曲线的测定与模型 在拔节—孕穗期,使用Li-6400便携式光合作用测量系统(Li-Cor Inc,Lincoln,NE,USA)测定不同光强和不同胞间CO2浓度下叶片净光合速率(Pn)。光合有效辐射梯度设置为2 000、1 500、1 200、1 000、800、600、400、200、100、50 和 0 μmol/(m2·s),CO2浓度梯度设置为 1 500、1 200、1 000、800、600、440、400、300、200、100 和 50 μmol/mol,各梯度设置3个重复。
使用非直角双曲线光响应模型确定光合作用参数[24],表达式为:
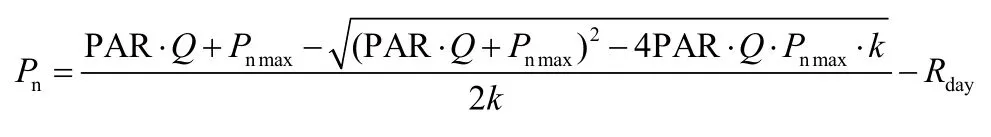
式中 :Pn为净光合速率(μmol/(m2·s)),PAR 为光合有效辐射(μmol/(m2·s)),Q为表观量子效率,Pnmax为最大净光合速率(μmol/(m2·s)),k为光响应曲线的曲角(无量纲),Rday为暗呼吸速率(μmol/(m2·s))。
使用指数CO2响应模型确定光合作用参数[25],表达式为:
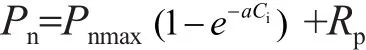
式中:Ci为胞间CO2浓度(μmol/mol),Rp为光呼吸速率(μmol/(m2·s)),α为羧化速率(CE,无量纲),CE=α(Pnmax+Rp)。
1.4.2 生物量与产量 生物量:于拔节—孕穗期和抽穗—开花期,在每个OTC两侧盆栽区,各随机选取长势均匀的1盆植株,即每种氮肥处理取了8盆(每种氮肥处理有4个OTC)。经105 ℃杀青40 min,80 ℃烘干至恒重后称重。
产量:在12个OTC的核心区和盆栽区,各处理分别收获有代表性的植株20株,杀青、烘干后称重,分析小麦产量结构。
1.5 统计分析
利用Microsoft Excel对数据进行初步分析处理;通过SPSS21.0(SPSS Inc., Chicago, IL, USA)实现模型的拟合与方差分析,用最小显著差数法(LSD)进行多重检验(P<0.05);使用 Origin Pro 2016(Origin Lab Corp., Wellesley Hills, USA)软件制图。
2 结果与分析
2.1 光合速率对光强和胞间CO2浓度的响应
通过非直角双曲线模型模拟叶片Pn对光强变化的响应,使用指数模型模拟叶片Pn对Ci变化的响应,响应曲线的R2均达到0.94~0.99,拟合效果较为理想。当PAR 为 0 μmol/(m2·s)时,叶片Pn为负值,Pn随PAR的增加而增加(图1)。在低光强(PAR ≤ 200 μmol/m2·s))条件下,净光合速率与光强呈正相关 ;当 PAR>500 μmol/(m2·s)时,增幅逐渐减缓并平稳,Pn值表现为CK<T1<T2,此时T2处理下的Pn与CK相比增加了19.93%(P=0.013)。在拔节—孕穗期,CK、T1和T2的Pnmax分别为40.61、44.71 和 45.76 μmol/(m2·s)。
在低Ci处(Ci≤ 300 μmol/mol),Pn随 CO2浓度的升高而迅速增加,各处理间无明显差异。随CO2浓度继续上升(Ci>300 μmol/mol),T1、T2处理的Pn升高,平稳后Pn为 CK<T2<T1。在拔节—孕穗期,CK、T1和T2的Pnmax分别为58.52、58.92和60.46 μmol/(m2·s)。
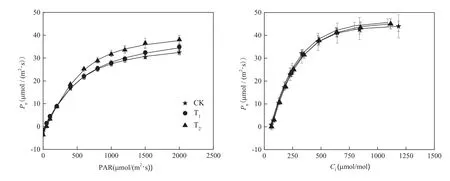
图1 净光合速率(Pn)对光合有效辐射(PAR)和胞间CO2浓度(Ci)变化的响应Fig. 1 Response of net photosynthetic rate (Pn) to photosynthetic active radiation (P AR) and inter-cellular CO2 concentration (Ci)
2.2 光响应曲线参数和CO2响应曲线参数
表1为非直角双曲线拟合方程所确定的小麦叶片光响应曲线参数。净光合速率从一定程度上能反映冬小麦对所处环境的适应能力,与CK相比,T1和 T2处理的Pnmax增幅为 10.10%(P=0.292) 和12.68%(P=0.194),但无显著差异。Rday影响了冬小麦叶片的生理活性,其中,T2与T1处理相比Rday增幅为54.29% (P=0.111),但均无显著差异。Q反映了小麦的光能利用率,其值越高则叶片对光能的转化效率越高,与CK相比,T1和T2处理对Q均无显著影响。另外,不同CO2浓度处理对k无显著影响。

表1 不同CO2浓度升高对光响应曲线参数的影响Table 1 Effect of elevated CO2 concentration on the parameters of light response curve
表2为指数拟合方程所确定的小麦叶片CO2响应曲线参数。由于光照条件下暗呼吸很小,光呼吸速率主要反映了叶片向空气中释放CO2的速率,而羧化效率反映了叶片对CO2的利用状况。与CK相比,Pnmax、Rp和CE在T1、T2处理下均无显著性差异,即CO2浓度升高处理对小麦叶片CO2响应曲线参数无显著影响。
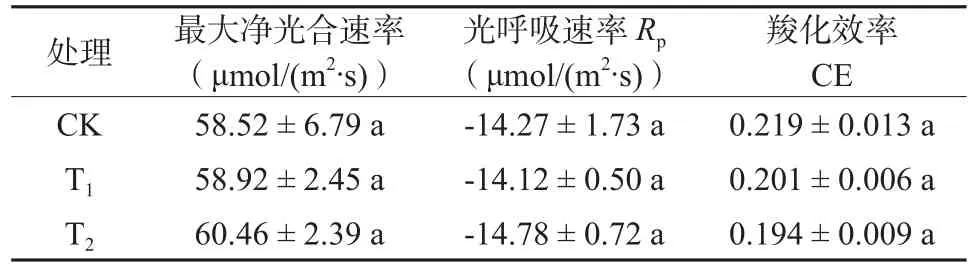
表2 不同CO2浓度升高对CO2响应曲线参数的影响Table 2 Effect of elevated CO2 concentration on the parameters of CO2 response curve
2.3 CO2浓度和氮肥水平对植株生长的影响
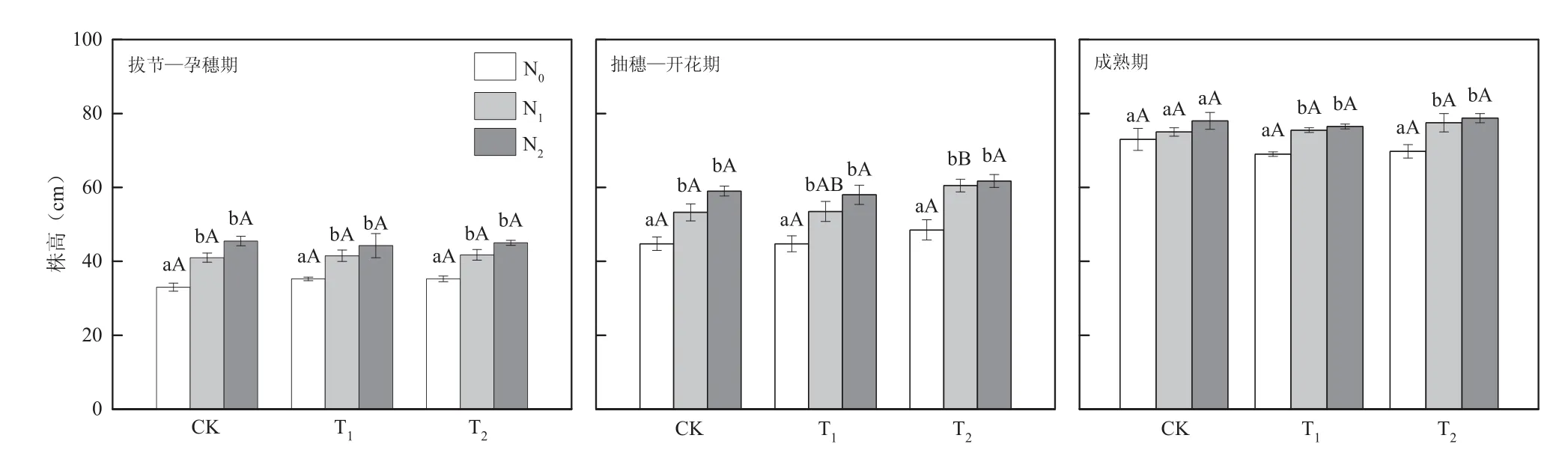
图2 CO2浓度和氮肥水平对小麦株高的影响Fig. 2 Effects of elevated CO2 concentration and nitrogen fertilization levels on plant height
不同CO2浓度处理下株高均表现为N0<N1<N2(图2)。拔节—孕穗期,CK处理下,N1、N2与N0相比显著增加了24.24%(P=0.001)和36.36%(P=0.000);T1处理下,N1、N2与N0相比显著增加了 17.73%(P=0.008)和 25.53%(P=0.002);T2处理下,N1、N2与N0相比显著增加了18.44% (P=0.007)和27.66%(P=0.002)。抽穗—开花期,CK处理下,N1、N2与N0相比显著增加了18.99%(P=0.011)和31.84%(P=0.000);T1处理下,N1、N2与N0相比显著增加了19.55%(P=0.023)和29.61%(P=0.020);T2处理下,N1、N2与N0相比显著增加了24.74%(P=0.003)和27.32%(P=0.002)。T2N1与CKN1相比显著增加了13.62%(P=0.044)。成熟期,T1处理下,N1、N2与N0相比显著增加了9.42%(P=0.000)和10.87%(P=0.000);T2处理下,N1、N2与N0相比显著增加了11.11%(P=0.020)和12.90%(P=0.009)。
如图3所示,拔节—孕穗期,不同CO2浓度处理下,N1、N2与N0相比茎蘖数增加了约1倍,均表现为 N0<N1<N2;N1、N2与 N0相比绿叶干重增加了约 2 倍,均表现为 N0<N1<N2;T1N0与 CKN0相比,黄叶干重增加了60%(P=0.028);N1、N2与N0相比,茎鞘干重和地上部分总生物量均增加了约1.5倍。抽穗—开花期,CKN1、CKN2与CKN0相比茎蘖数分别增加了42.86%(P=0.007)和80.95%(P=0.000),T1N1、T1N2与T1N0相比茎蘖数分别增加了36%(P=0.035)和 52%(P=0.005);CK、T1处理下,N1、N2与N0相比绿叶干重均增加了约1倍;CK、T2处理下,N1、N2与N0相比黄叶干重均增加了约1.5倍;N1、N2与N0相比茎鞘干重均增加了约1倍;T2N1与CKN1相比,茎鞘干重增加了37.4%(P=0.035);N1、N2与N0相比地上部分总生物量均增加了约1倍。
2.4 CO2浓度和氮肥水平对产量构成的影响
由表3可知,T1处理下,N1、N2与N0相比,籽粒数分别增加了29.69%(P=0.006)和42.27%(P=0.001);T2处 理 下,N1、N2与 N0相 比, 籽粒数分别增加了16.66%(P=0.011)和19.19%(P=0.005)。CK处理下,N2与N0相比,籽粒净重增加了31.37%(P=0.018);T1处理下,N1、N2与N0相比,籽粒净重分别增加了33.95%(P=0.005)和 48.71%(P=0.001);T2处理下,N1、N2与 N0相比,籽粒净重分别增加了25.57%(P=0.001)和26.54%(P=0.001)。CK处理下,N1、N2与N0相比,秸秆、穗轴和麦芒净重分别增加了36.16%(P=0.006)和52.23%(P=0.001);T1处理下,N2与N0相比,秸秆、穗轴和麦芒净重增加了52.86%(P=0.016);T2处理下,N1、N2与N0相比,秸秆、穗轴和麦芒净重分别增加了20.78%(P=0.000)和25.88%(P=0.000)。T2处理下,N1、N2与N0相比,千粒重分别增加了7.79%(P=0.004) 和 6.23%(P=0.015)。CK 处 理下,N1、N2与N0相比,经济系数均减少了6.90%(P=0.003);T2N1与T1N1相比,经济系数增加了1.82%(P=0.045);T1N2与CKN2相比,经济系数增加了3.70%(P=0.025)。
3 讨论
3.1 光合特性
本研究所选用的非直角双曲线光响应模型在拟合时考虑了曲线的凸起度[26],使拐点更明显,拟合的光合速率后期趋于平缓[27],能更直观的描述CO2浓度升高下净光合速率对光合有效辐射和胞间CO2浓度变化的响应。以往有研究认为,CO2浓度在环境大气CO2浓度基础上升高200 μmol/mol能促进植物的光合作用,作物的净光合速率约增加27%[14],而本研究中CO2浓度升高200 μmol/mol处理下,冬小麦的净光合速率增加了19.93%(P=0.013),表明CO2浓度增加对作物光合存在一定的促进作用。CO2浓度升高一定程度是增加了冬小麦光合参数Pnmax、Rday、Q等,但无显著影响。有研究表明CO2浓度升高显著降低了暗呼吸速率,提高了表观量子速率[16],但本研究中未出现显著性差异,这可能与光合作用参数的观测时期有关,本次试验选在冬小麦拔节—孕穗期进行光合速率的测定。长期来看,氮素供给受限条件下,生长在高CO2浓度环境下的作物出现光合适应,一些研究认为这种现象与叶绿素含量和气孔导度下降、光合量子传递和碳氮比例失衡等因素有关。作物复杂的生长过程及光化学反应各物质间的交互影响使得光合适应现象的机制需进一步深入研究。

图3 CO2浓度升高和氮肥水平对小麦茎蘖数、叶干重、茎鞘干重和地上部分总干重的影响Fig. 3 Effects of elevated CO2 concentration and nitrogen fertilization levels on the tiller number, leaf dry weight,stem dry weight and the total dry weight on the ground of wheat
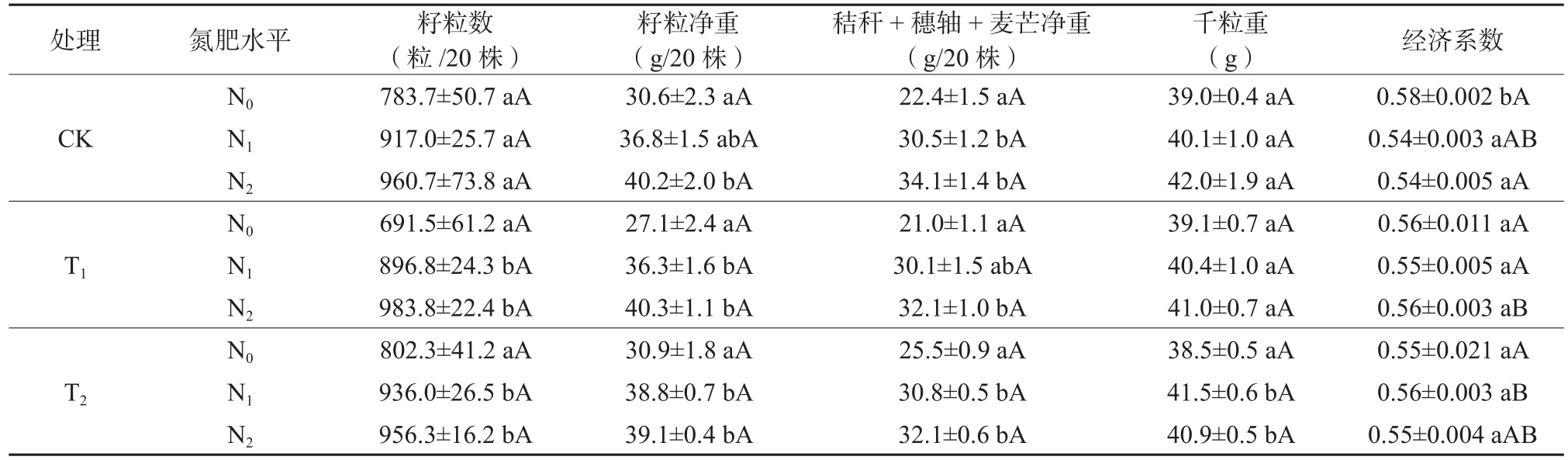
表3 CO2浓度和氮肥水平对小麦籽粒产量结构的影响Table 3 Effects of elevated CO2 concentration and nitrogen fertilization levels on grain yield structure of wheat
3.2 生物量积累
小麦株高是影响其是否高产的重要因素[28],研究表明,高CO2浓度使冬小麦在拔节期、开花期和成熟期的株高都有所增加。其中,CO2梯度大棚的试验中,CO2浓度升高到594 μmol/mol时,两种供试冬小麦的灌浆期株高分别增加了5.8%和8%[29]。在江苏的FACE试验中,CO2浓度增加200 μmol/mol时,冬小麦成熟期株高增加4%[30]。本试验研究中,CO2浓度升高对冬小麦株高的促进作用均低于上述研究,而施氮处理显著增加了株高,这可能是冬小麦品种差异导致的。北京麦豆轮作miniFACE试验中[31],与施氮处理相比,CO2浓度升高仅显著增加了拔节期冬小麦株高。本研究与上述结果不尽相同,其原因可能是试验设置的氮肥水平高于前者,另外本试验的供试品种扬麦22属弱筋小麦,而北京的试验为高筋小麦。
有研究表明,植株的生物量及干物质的累积随着CO2浓度升高而增加,即CO2浓度升高具有“施肥效应”。CO2浓度升高促进了冬小麦地上部分的干物质以及碳氮积累[32-33];FACE试验中小麦在拔节—孕穗期、抽穗—开花期和收获期的干物质累积量均有所增加[34];在小麦整个生育期内CO2浓度升高和施氮处理使地上生物量相比于环境大气CO2浓度和无施氮处理条件有明显增加,且前者的促进作用更大[30]。本次试验中,CO2浓度升高和施氮处理均使冬小麦地上生物量增加,但施氮处理对冬小麦地上生物量的促进作用更显著,该结论与上述FACE试验结果存在差异。其原因可能是施氮对作物产生直接影响,氮素是植体内叶绿素和蛋白质的重要组分,施氮处理直接促进了叶绿素含量,加快了光反应,增加了叶片蛋白质含量,而蛋白质是酶的主要组成部分,故有利于暗反应,进而增加干物质的累积。CO2浓度升高则是通过提高胞间CO2浓度,间接促进碳水化合物合成,从而增加作物干物质累积的[35]。本试验中CO2浓度升高和施氮对地上生物量增加的促进作用大于FACE试验,这可能是由于两种不同控制试验装置下CO2浓度升高和施氮的肥效受其它环境因子扰动造成的。此外,本次试验中,不同CO2浓度处理下,氮肥施用显著提高了植株叶片干重和茎鞘干重,尤其在拔节—孕穗期T2处理下,N2水平的绿叶和茎鞘干重与N0相比,分别增加了2倍和1.5倍;在抽穗—开花期,N1水平下,T2与CK相比茎鞘干重增加了37.4%(P=0.035);CO2浓度升高和施氮处理对小麦地上部分总干重的促进作用,在拔节—孕穗期和抽穗—开花期均表现为T2N2最强。可见,在拔节—开花期内,CO2浓度升高和施氮处理共同促进小麦干物质的积累,其中施氮处理对小麦生长前期物质积累的促进作用相对更大,而CO2浓度升高在中后期对其物质积累的促进作用相对更大。
3.3 产量构成
小麦的产量主要由籽粒数和籽粒重等决定,籽粒重主要受抽穗—开花期后物质积累过程影响。氮肥的施用在一定程度上促进了植株生长,有利于作物生长后期物质积累。北方冬小麦试验中[36],CO2浓度升高相较于施氮处理,对冬小麦籽粒数的促进作用更大,而施氮处理对千粒重的促进作用更大;南方FACE试验中[31],CO2浓度升高使籽粒数和千粒重显著增加,但施氮处理及其与CO2浓度升高的交互效应对籽粒数和千粒重均无显著影响;开顶式气室试验中[37],CO2浓度升高和施氮处理共同影响了冬小麦的籽粒数和千粒重,具有一定的正向互作效应。本研究表明,CO2浓度升高时,施氮处理显著增加了籽粒数,尤其在T1处理下,N1、N2与N0相比增加了29.69%(P=0.006)和42.27%(P=0.001),其原因可能是CO2浓度升高加快了叶片光合速率,抑制光呼吸强度,配合氮肥施用,进一步促进了冬小麦生长中后期物质积累。T2处理下,N1、N2与N0相比千粒重分别增加了7.79%(P=0.004)和6.23%(P=0.015),与CO2浓度升高相比,施氮处理显著增加了冬小麦千粒重,此结果与南方FACE试验不一致,该差异可能与冬小麦品种、CO2浓度升高水平和试验方式等因素相关,有待进一步研究。
4 结论
高CO2浓度升高显著增加了冬小麦叶片净光合速率,从而促进叶片光合作用;施氮处理在拔节—孕穗期和抽穗—开花期显著增加了冬小麦株高而CO2浓度升高在抽穗—开花期显著增加了冬小麦株高;CO2浓度升高和施氮处理共同促进冬小麦干物质的积累,其中施氮处理对冬小麦生长前期物质积累的促进作用相对更大;CO2浓度升高与施氮处理主要通过增加籽粒数和千粒重共同影响冬小麦产量结构,其中低CO2浓度升高和高施氮处理对冬小麦籽粒数的促进作用最大。下一步研究可考虑使用CO2浓度升高处理收获的种子和大田种子,连续开展几个生长季的试验,研究小麦对CO2浓度升高是否具有适应性或后代记忆效应。

