布鲁氏菌RPA-LFD检测方法的建立
于 博,李博宇,赵 博,李 东,李健明,时 坤,曾范利,宗 颖,杜 锐*
(1.吉林农业大学 动物科学技术学院,吉林 长春130118;2.吉林农业大学 中药材学院,吉林 长春130118)
布鲁氏菌病简称布病,是全球最常见且对经济有重要影响的人畜共患病之一[1]。目前在全球已发现有170多个国家和地区存在布鲁氏菌病[2]。这种疾病的特征是导致动物的流产、降低产奶量和生育能力,以及人的波状热,关节炎和骨髓炎[3]。布鲁氏菌种属有10种以上,但牛种、猪种、羊种布鲁氏菌是布鲁氏菌病发病的主要原因[4],从感染人的布鲁氏菌的血培养物中分离出来的大多数为羊种布鲁氏菌,因此羊种布鲁氏菌对人的致病力最强[3]。目前细菌分离培养技术是布鲁氏菌检测的“金标准”[5],但该方法危险性高,对环境要求严格,敏感性差。血清学检测是布鲁氏菌常用的检测方法,其中凝集试验较为常用,但血清学方法敏感性低,容易出现假阳性和交叉反应。随着分子生物学技术的发展,越来越多的诊断依赖于核酸分子检测,目前针对布鲁氏菌已经开发出了基于PCR及其衍生技术的多种检测技术,但大多数分子检测都需要昂贵的设备和专业的技术人员,并且耗时长,对于现场和偏远地区检测存在一定的困难[6]。
重组酶聚合酶扩增技术(RPA)是2006年发明的一种新型等温核酸扩增技术[7],该技术使用重组酶与引物结合形成的复合物能在模板上寻找同源序列,定位后就会引发链交换反应并启动DNA合成,可在25℃~42℃恒温,20 min内条件下完成核酸扩增,其扩增产物结果可以与凝胶电泳、实时荧光、侧流层析试纸条等多种方法结合读取。本研究将RPA技术与侧流层析试纸条结合,原理为羧基荧光素(FAM)标记的特异性探针与生物素(Biotin)标记的特异性引物杂交扩增出带有双标记的扩增产物,将其滴加于试纸条上便会与胶体金标记的抗FAM抗体结合,形成三元复合物,当流动到检测线时,生物素配体捕获该复合物,形成检测线;未杂交的FAM标记探针与胶体金标记的抗FAM抗体结合,形成不含有生物素的两元复合物,结合在质控线上[8]。RPA-LFD技术不需要通过复杂的仪器和设备,操作简单,通过肉眼即可观察到结果,更加适用于现场快速检测,为今后布鲁氏菌现场检测提供了帮助。
1 材料与方法
1.1 菌株及主要实验材料 布鲁氏菌S2、M5、A19疫苗株、维氏气单胞菌、大肠杆菌、甲型副伤寒沙门氏菌、肠炎沙门氏菌、乙型溶血性链球菌均由本实验室保存。34份鹿的血液样品采集于吉林省鹿场。TwistAmpnfo和TwistAmp Basic试剂盒购自英国Twist DX公司;MileniaGenlineHybriDetect 1(侧流层析试纸条)购自德国MileniaBiotec公司;Premix TaqTM(ExTaqTMVersion 2.0 plus dye)和pMD18-T Vector Cloning Kit购自宝生物工程(大连)有限公司;普通DNA产物纯化试剂盒和组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;细菌基因组提取试剂盒和质粒提取试剂盒购自Axygen公司。引物和探针由上海生工生物工程技术服务有限公司合成。
1.2 重组质粒标准品的构建与鉴定 利用细菌基因组提取试剂盒分别提取布鲁氏菌S2疫苗株、维氏气单胞菌、大肠杆菌、甲型副伤寒沙门氏菌、肠炎沙门氏菌、乙型溶血性链球菌基因组,根据Gen-Bank中登录的布鲁氏菌Omp31基因(AY484527.1)保守序列设计引物(表1),以提取的布鲁氏菌S2疫苗株基因组为模板进行PCR扩增,将扩增片段回收纯化后克隆至pMD18-T载体,构建重组质粒标准品pMD18-T-Omp31,经PCR鉴定和重组质粒测序后按照公式:拷贝数(copies/μL)=6.02×1023×质粒浓度(ng/μL)×10-9/(质粒碱基数×660),计算质粒拷贝数。

表1 Omp31引物Table 1 Primers of Omp31
1.3 RPA引物的设计与筛选 根据相关资料并结合TwistAmp Basic试剂盒说明书设计RPA引物,参考Omp31基因保守序列设计9对引物(表2),以拷贝数为106拷贝/μL的质粒标准品为模板,按照TwistAmp Basic试剂盒说明书进行RPA扩增,反应结果经2.5%凝胶电泳检测,筛选最终可以扩增出良好特异性条带的引物为最佳引物。
1.4 RPA-LFD反应条件的优化 以筛选出的最佳引物按照TwistAmpnfo说明书设计RPA-LFD引物和探针(表3),以拷贝数为106拷贝/μL的质粒标准品为模板,在预添加nfo酶的冻干PCR管中加入如下预混液:上、下游引物各2.1 μL、探针0.6 μL、Primer Free Rehydration buffer(再水合缓冲液)29.5 μL、模板和水13.2 μL。在倒置的管盖中加入2.5 μL MgOAc(醋酸镁),盖上管盖放入金属浴中,利用方阵法对反应温度(20℃、25℃、28℃、30℃、35℃、37℃、39℃、40℃、42℃)、时间(5 min、10 min、15 min、20 min、25 min、30 min)、引物探针浓度(1 pmol/μL、5 pmol/μL、10 pmol/μL、25 pmol/μL、50 pmol/μL)等条件优化,反应结束后取反应液2 μL加入98 μL LFD缓冲液中混合静止2 min,将侧流层析试纸条插入混合缓冲液中静止2 min~3 min,按照试纸条试剂盒说明书判定结果。

表2 RPA引物Table 2 Primers for RPA sequence
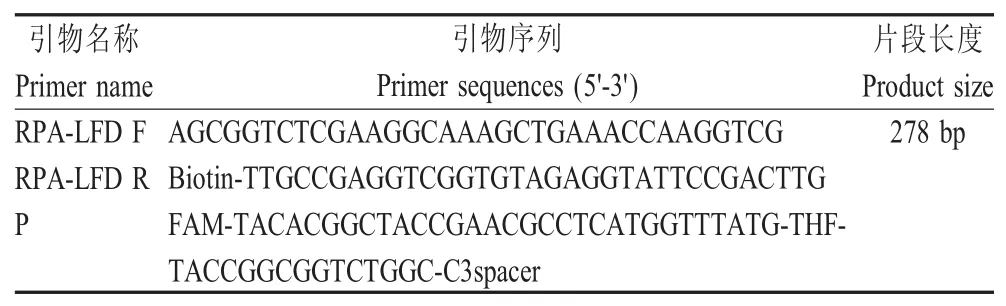
表3 RPA-LFD引物和探针Table 3 Primers and probes for RPA-LFD sequence
1.5 特异性试验 以提取的布鲁氏菌S2、M5、A19疫苗株、维氏气单胞菌、大肠杆菌、甲型副伤寒沙门氏菌、肠炎沙门氏菌、乙型溶血性链球菌基因组为模板,以最佳反应条件进行RPA-LFD检测,同时以ddH2O为模板作为阴性对照,检测该方法的特异性。
1.6 敏感性试验 将质粒标准品按10倍倍比稀释(106拷贝/μL~1拷贝/μL),分别以稀释的质粒(104拷贝/μL~100拷贝/μL)为模板,在最佳反应条件下进行RPA-LFD反应,确定该方法的最小检出量,评价该检测方法的敏感性,同时以筛选出的最佳引物进行常规PCR扩增(质粒模板浓度106拷贝/μL~100拷贝/μL),将两种方法的敏感性进行对比分析。
1.7 重复性试验 以3.1×104拷贝/μL~3.1×100拷贝/μL 10倍倍比稀释的5个质粒标准品为模板,按照最佳反应条件将每个稀释度的模板分别加入至单独预添加nfo酶的冻干PCR管中,每次为独立的反应,进行3次RPA-LFD批间重复试验,确定该检测方法的重复效果。
1.8 临床样品的检测 对从吉林省鹿场采集的34份加入抗凝剂的鹿血液样品,按照血液基因组提取试剂盒提取基因组DNA,应用已建立的RPA-LFD方法和常规PCR进行检测,比较两种方法的符合率。
2 结果
2.1 重组质粒标准品的构建与鉴定结果 以布鲁氏菌疫苗株S2为模板,进行PCR扩增,结果显示得到约700 bp的片段(图略),将扩增片段回收纯化后克隆至pMD18-T载体,经PCR鉴定,测序结果均与预期一致,命名为pMD18-T-Omp31,经微量核酸测定仪检测,浓度为116 ng/μL,换算为质粒拷贝数为3.1×1010拷贝/μL。
2.2 RPA引物筛选结果 以106拷贝/μL质粒标准品为模板,利用9对引物进行RPA基础反应,经过凝胶电泳检测,结果显示,引物对F1/R1相比于其它引物对扩增的目的条带更为特异清晰(图1),因此选用引物对F1/R1为最佳引物。

图1 引物筛选结果Fig.1 Primer screening results
2.3 RPA-LFD反应条件优化试验结果 经过反应条件优化,结果显示,温度在28℃~42℃(图2A),时间在10 min~30 min(图2B),引物探针浓度在5 pmol/μL~10 pmol/μL(图2C)试纸条检测线(T)均有条带,最终确定该方法的优化条件为:反应温度设定为39℃,时间为20 min,引物探针浓度均为10 pmol/μL。
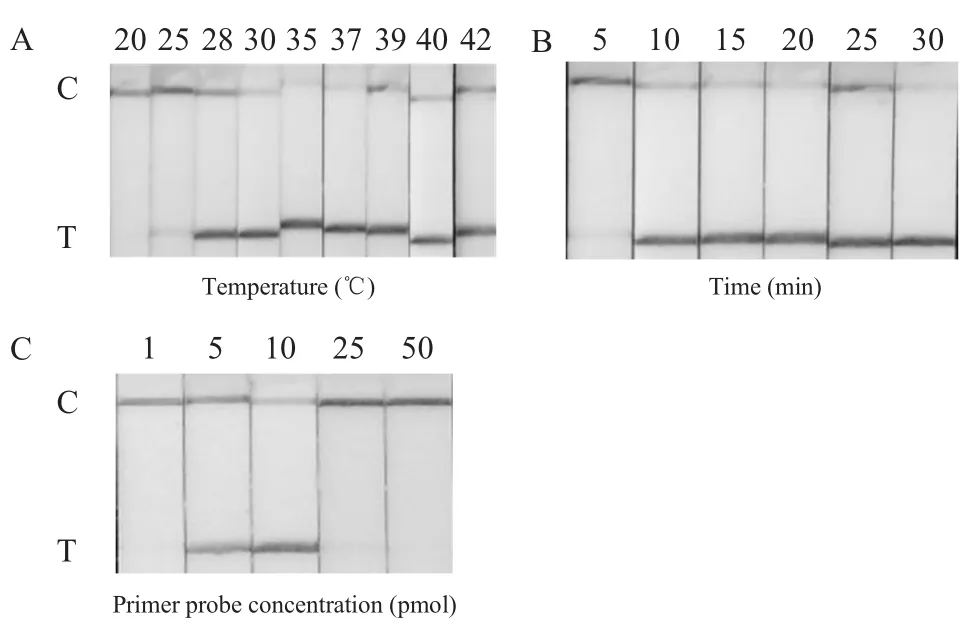
图2 不同温度(A)、时间(B)、引物探针浓度(C)下RPA-LFD反应Fig.2 RPA-LFD reaction at different temperatures(A),times(B),and prime probe concentration(C)
2.4 特异性试验结果 利用本实验建立的方法检测多种病原基因,进行特异性试验。结果显示,除布鲁氏菌基因组检测线(T)有特异性条带外,维氏气单胞菌、大肠杆菌、甲型副伤寒沙门氏菌、肠炎沙门氏菌、乙型溶血性链球菌基因组检测线(T)均无该条带(图3),表明所建立的RPA-LFD检测方法具有较强的特异性。

图3 布鲁氏菌RPA-LFD特异性试验结果Fig.3 Specilfic results of the RPA-LFD for Brucella
2.5 敏感性试验结果 以3.1×106拷贝/μL~3.1×100拷贝/μL的质粒标准品为模板进行常规PCR扩增,3.1×104拷贝/μL~3.1×100拷贝/μL的质粒标准品进行RPA-LFD试验,结果显示常规PCR最低可检测到3.1×103拷贝/μL的质粒标准品(图4A),而RPA-LFD可以检测到3.1×101拷贝/μL的质粒标准品(图4B),所建立的RPA-LFD检测方法比常规PCR敏感性高100倍,表明该方法敏感性高。
2.6 重复性试验结果 以3.1×104拷贝/μL~3.1×100拷贝/μL的质粒标准品按照最佳反应条件进行3次RPA-LFD批间重复试验。结果显示,RPA-LFD检测方法均可检测出最低限为3.1×101拷贝/μL质粒标准品(图5)。表明该检测方法的重复性良好。

图4 常规PCR(A)和RPA-LFD(B)敏感性试验结果Fig.4 Sensitivity results of PCR(A)and RPA-LFD(B)

图5 RPA-LFD重复性试验结果Fig.5 Results of RPA-LFD repeatability test
2.7 临床样品的检测结果 将采集的34份鹿血液样品提取基因组进行常规PCR和RPA-LFD检测,结果均显示3份样品为阳性,所建立的RPA-LFD检测方法与常规PCR检出符合率为100%,表明所建立的RPA-LFD检测方法可用于现场检测。
3 讨论
本研究将RPA技术与侧流层析试纸条结合用于检测布鲁氏菌,在39℃,20 min的反应条件下,5 min内即可观察到肉眼可见的结果。目前,RPA检测技术在细菌、病毒、寄生虫等领域均有涉及,Wang等对猪圆环病毒(PCV3)建立了实时重组酶聚合酶(RT-RPA)检测方法,其在38℃反应20 min即可完成检测,且最低可以检测到23个拷贝的质粒标准品,特异性强,所建立的RT-RPA检测方法与荧光定量PCR性能相当,但RT-RPA反应更快,有望实现快速灵敏地检测PCV3,从而有助于预防和控制PCV3感染的疾病[9]。高建欣等建立了RPALMTS(乳胶微球试纸)用来检测金黄色葡萄球菌,15 min即可检测到最低500 fg DNA和1.2×101cfu/mL纯菌液,可应用于基层单位和现场检测金黄色葡萄球菌[10]。Sun等针对日本血吸虫SjR2基因建立了RPA-LFD检测方法,最低可检测到5 fg DNA,与qPCR和实时RPA敏感性相同,在25℃~45℃,15 min~20 min条件下即可完成,相比传统ELISA和IHA实验检测效果好,在现场具有很大的应用价值[11]。
RPA技术在拥有检测时间短,灵敏度高,在常温下即可进行反应,甚至人体体温即可提供反应所需的温度环境,读取结果多样化的优势外,同时也存在着许多问题,其一在于没有专业软件对RPA引物进行设计,应根据引物设计原则设计多对引物进行筛选;其二在于容易造成扩增产物气溶胶污染而产生假阳性结果,操作尽量在通风性好,空旷的环境条件下,同时应严格按照说明书设计引物探针,避免引物探针发生杂交而产生假阳性结果。为避免假阴性结果出现,模板核酸的质量、引物和探针的特异性应得到保证;其三在于存在噪音现象,放置时间过长,阴性对照可能会在试纸条上出现微弱的检测线[12],本实验结果显示在2 min以内便可读取结果,因此尽量在最短时间内读取为宜;其四在于成本高,由于RPA技术目前应用尚不广泛,成本较高,本研究尝试将50 μL体系减半为25 μL体系,结果显示体系减半后并不影响实验结果,这将有效的控制成本,但随着该技术的不断成熟和发展,成本将在未来进一步降低。RPA-LFD对于现场检测具有巨大的优势,但DNA的提取对于现场检测还是有一定的困难,杨洋建立了基于磁珠的现场核酸提取方法,与RPA-LFD联用,使整个过程脱离实验室的束缚,真正的使RPA-LFD应用于现场检测[13]。综上所述,本研究建立了一种简便快速、特异性强、灵敏度高的布鲁氏菌RPA-LFD检测方法,为今后布鲁氏菌病的现场诊断提供了帮助。

