三株鸭源H7N2亚型禽流感病毒的遗传进化分析及其致病性研究
李 梅,尹 馨,侯玉杰,邓国华,崔鹏飞,房敬真,施建忠,陈化兰
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点实验室,黑龙江哈尔滨150069)
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科,A型流感病毒属。根据其抗原性的差异,可将其分为16种不同的HA亚型和9种不同的NA亚型。H7亚型AIV宿主范围广泛,亚型组合众多,在自然界中存在时间较长。自1902年在意大利鸡群中首次发现H7N7亚型AIV以来,该病毒已在野鸟和家禽中广泛存在[1]。2003年,我国学者在无明显临床症状的鸡体内首次分离到低致病性H7N2亚型AIV[2](注:本文中若不特殊说明,低致病性AIV和高致病性AIV均指对家禽中鸡的致病性)。2013年初,我国上海市首次出现人感染H7N9亚型禽流感病例,随后该疫情在安徽、江苏等地出现,导致了人们对该病的恐慌[3]。截止2019年3月,该亚型病毒已导致我国1 567人感染发病,其中615个患者死亡,构成了严重的公共卫生威胁(www.who.int/influenza/human animal interface/influenza H7N9/en/)。2014年2月,吉林省出现人感染H7N9 AIV事件,研究人员在患者家中的鸡群中同时分离到低致病性H7N2和H9N2亚型AIV。基因分析显示,该H7N2亚型AIV为H7N9和H9N2亚型AIV的重组病毒[4]。2017年初我国出现高致病性H7N9亚型AIV后,2018年又在福建省的鸭群中陆续出现高致病性鸭源H7N2亚型AIV,对其进行系统分析后显示,该株高致病性鸭源H7N2亚型AIV的HA基因与高致病性H7N9亚型AIV的HA基因高度同源,并且该株高致病性H7N2 AIV对鸡鸭均100%致死[5]。这些研究结果表明,H7N2亚型AIV对家禽以及人类健康均造成了严重的威胁。因此,应加强对H7N2亚型AIV的持续监测。
2012年~2015年期间,在动物流感病毒的常规监测中,本研究室在浙江和湖南省活禽市场的水禽中分离到3株低致病性鸭源H7N2亚型AIV,为了解该亚型AIV的进化及评估该病毒对动物和人的致病性风险,本研究室对上述3株鸭源H7N2亚型AIV开展了遗传演化分析及其对家禽和哺乳动物小鼠的致病性研究,为H7N2 AIV的持续监测及科学防控禽流感提供数据支撑,并评估可能导致人类感染该亚型AIV的风险。
1 材料与方法
1.1 主要实验材料 H7N2亚型AIV DK/ZJ/S3192/2012、DK/HuN/S1515/2014和DK/HuN/SD038/2015株由国家禽流感参考实验室于2012年~2015年期间分离自浙江和湖南省活禽市场的水禽。6周龄雌性BALB/c小鼠购自北京维通利华实验动物有限公司;6周龄SPF鸡、3周龄SPF鸭和10日龄SPF鸡胚均购自哈尔滨兽医研究所实验动物中心。
病毒核酸提取试剂盒购自天根生化科技(北京)有限公司;RNA反转录试剂盒购自日本TOYOBO公司;用于PCR扩增的EasyTagDNA聚合酶购自北京全式金生物技术有限公司;PCR产物纯化试剂盒购自OMEGA公司;测序反应试剂盒BigDye Terminator 3.1购自美国ABI公司。
1.2 病毒全基因组测序及遗传演化分析 按照病毒RNA提取试剂盒说明书提取3株H7N2亚型AIV的病毒RNA,反转录为cDNA,以其为模板,按照Hoffmann等的引物及反应条件分别对各目的基因节段进行PCR扩增[6]。扩增产物经纯化后测序鉴定。测序结果利用DNAStar软件包中的Seqman进行序列拼接。利用MEGA 6.0中的Clustal W法进行病毒基因序列比对,采用Neighbor-Joining方法构建HA及NA基因进化树,Bootstrap值为1000。
1.3 病毒的纯化及鸡胚半数感染量(EID50)的测定将分离到的3株病毒10倍倍比稀释后接种10日龄SPF鸡胚,48 h后,收集最高稀释度、最高血凝价的鸡胚尿囊液,按照上述操作步骤,连续纯化3代后,将尿囊液分装冻存于-80℃备用。纯化保存的病毒10倍倍比稀释后分别接种5枚10日龄的SPF鸡胚,48 h后,统计各稀释度有血凝活性鸡胚的数量,根据Reed-Muench法计算各株病毒EID50。
1.4 家禽感染性试验 将106EID50/0.1 mL分离的3株H7N2 AIV分别经鼻腔各接种11只6周龄SPF鸡和各接种8只3周龄的SPF鸭,均是0.1 mL/只。感染3 d后,随机迫杀3只感染的鸡、鸭。分别取其脑、喉气管、肺脏、胸腺、脾脏、胰腺、肾脏、盲肠扁桃体、法氏囊、心脏、肝脏,其余8只鸡和5只鸭在感染后第3 d、5 d、7 d分别采集其咽喉拭子和泄殖腔拭子。采集的脏器加入1 mL含三抗(青霉素、链霉素、头孢)的冰PBS液中研磨、离心后取上清,拭子常规处理后,利用鸡胚进行脏器和拭子的病毒滴定,检测各脏器中病毒的复制及排毒情况,并根据Reed-Muench法计算病毒滴度。每天观察感染组鸡、鸭是否出现明显可见的临床症状至感染后14 d,对存活的鸡、鸭采血并分离血清,检测血清HI抗体效价。
1.5 小鼠感染性试验 以106EID50/50 μL的剂量经鼻腔感染8只6周龄雌性BALB/c小鼠,50 μL/只。感染3 d后,随机迫杀3只小鼠,取其脑、鼻甲、脾脏、肾脏、肺脏,通过鸡胚滴定各脏器中的病毒,并根据Reed-Muench法计算病毒滴度,检测病毒在小鼠体内各脏器的复制;收集滴定脏器后HA效价较高的尿囊液进行病毒核酸提取、PCR扩增及测序,以检测病毒的突变情况,剩余的5只小鼠,每天记录体质量变化至感染后14 d,并观察其临床症状。
2 结果
2.1 鸭源H7N2亚型AIV的遗传演化分析及EID50测定结果 对3株鸭源H7N2亚型AIV各目的基因节段PCR扩增后拼接得到全基因组,对其序列进行比对分析。结果显示,按照95%的核苷酸同源性划分,3株H7N2亚型AIV的HA基因可以划分为2个Group,其之间的同源性为89.2%~98.2%,且3株H7N2亚型AIV与2013年的H7N9亚型AIV不属于同一分支(图1),表明3株鸭源H7N2亚型AIV与2013年的H7N9亚型AIV亲缘关系较远。分离株DK/HuN/S1515/2014和 DK/HuN/SD038/2015位于Group 2,属于同一分支且二者同源性为98.2%,表明这两株AIV高度同源,但与分离株DK/ZJ/S3192/2012同源性较低,亲缘关系较远。3株H7N2亚型AIV的NA基因同源性为83.1%~89.1%,分别位于3个不同的分支(图2),表明这3株AIV的NA基因亲缘关系较远。BLAST分析显示,3株AIV的内部基因来源复杂,与3株分离病毒核苷酸同源性最高的病毒株查找显示,DK/ZJ/S3192/2012株的PB1、HA和M基因序列与数据库中A/duck/Zhejiang/S3158/2012(H7N7)株的相应核苷酸序列同源性最高,表明该病毒与后者亲缘关系密切。DK/HuN/SD038/2015株的PB2与HA基因序列与A/duck/Fujian/S4170/2014(H7N9)病毒株的相应核苷酸序列同源性最高,表明这两株病毒亲缘性更近。但DK/HuN/S1515/2014株病毒的8个基因节段序列均与不同亚型病毒相应基因序列具有较高的相似度(表1),表明该病毒基因来源多样,且3株病毒均是H7N7、H3N8和H10N7等多个亚型AIV的重组体,表明不同来源分离病毒具有明显的基因多样性,可分为3个基因型,DK/ZJ/S3192/2012、DK/HuN/S1515/2014和DK/HuN/SD038/2015株AIV分别为基因A、B、C型。
根据Reed-Muench法计算病毒株DK/ZJ/S3192/2012、DK/HuN/S1515/2014和DK/HuN/SD038/2015的EID50分别为108.5EID50/0.1 mL、107.63EID50/0.1 mL、107.68EID50/0.1 mL。
2.2 分离病毒对鸡的感染性试验结果 利用3株H7N2亚型AIV进行SPF鸡感染性试验,感染组8只鸡在两周内均存活。观察期内也无明显肉眼可见的临床症状。排毒试验及各脏器病毒滴定结果显示,在感染后第3 d、5 d、7 d感染鸡的喉头排毒鸡数量明显高于泄殖腔排毒鸡数量(表2,5 d、7 d数据未显示),其中感染DK/ZJ/S3192/2012分离株的3只鸡均能够从胰腺中检测到病毒,但其中1只鸡还可以从肺脏、心脏、脾脏及肾脏中检测到病毒,而其余脏器均未检测到该病毒;其余两株病毒均未在鸡各脏器中检测到(表2),表明DK/HuN/S1515/2014与DK/HuN/SD038/2015株病毒均不能在鸡脏器内有效复制,且该3株鸭源性H7N2 AIV在鸡体内仅具有有限的复制能力。感染14 d后存活的鸡血清抗体检测结果显示,其血清HI抗体几乎全部转阳,效价为在2~64。表明,该3株病毒均能够诱导鸡产生一定的免疫应答。

图1 分离病毒HA基因进化树Fig.1 The phylogenetic tree of HA gene

图2 分离病毒NA基因进化树Fig.2 The phylogenetic tree of NA gene
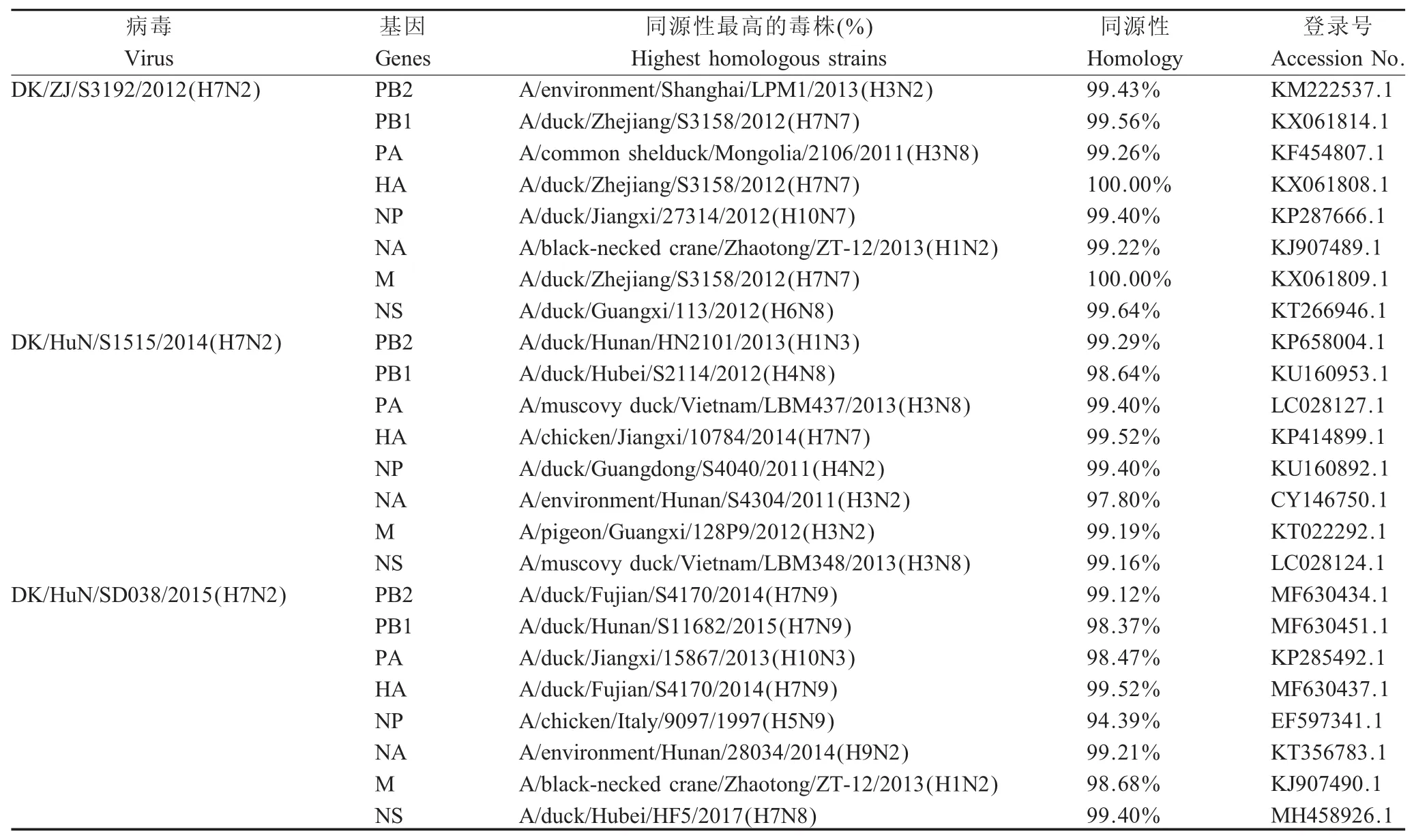
表1 H7N2亚型AIV各基因节段同源性分析结果Table 1 Homology analysis of each segment of H7N2 avian influenza viruses
2.3 分离病毒对鸭的感染性试验结果 利用3株H7N2亚型AIV进行SPF鸭感染性试验,结果显示,感染组5只鸭14 d观察期内全部存活且未出现任何明显的临床症状。排毒试验结果显示,3株病毒在所有感染的鸭中均可以通过喉头和泄殖腔排毒。各脏器病毒滴定结果显示,病毒在鸭消化道的复制能力要高于其在呼吸道的复制能力,并且3株病毒在鸭各脏器中的复制情况表现出明显差异,其中DK/ZJ/S3192/2012于感染后3 d在感染鸭的肺、脾、肾、胰腺中检测到病毒;DK/HuN/S1515/2014在感染鸭的肺、心脏、肾、胰腺中检测到病毒;而DK/HuN/SD038/2015仅在感染鸭的脾、肾、胰腺中检测到了病毒。这些结果表明3株H7N2亚型AIV在SPF鸭体内复制良好。感染14 d后存活的鸭血清抗体检测结果显示,血清HI抗体全部转阳且效价为4~32(表3)。表明,该3株病毒均能够诱导鸭产生一定的免疫应答。
2.4 分离病毒对BALB/c小鼠的致病性试验结果将3株鸭源H7N2 AIV以106EID50/50 μL的剂量感染小鼠。脏器病毒滴定结果显示,3株病毒在小鼠肺脏及鼻甲中的平均含量分别为4.9 log10 EID50/mL~6.6 log10 EID50/mL和4.5 log10 EID50/mL~5.2 log10 EID50/mL,但感染DK/HuN/S1515/2014株病毒的3只小鼠中仅1只在其脑组织中检测到病毒,其余两株病毒均未在小鼠的脑组织中检测到(表4),以上结果表明DK/HuN/S1515/2014株病毒可以突破小鼠血脑屏障在其脑内增殖,同时3株H7N2亚型AIV均具有感染哺乳动物的能力。从感染小鼠脏器中重新分离到的病毒测序结果显示未见其有任何突变,表明3株H7N2亚型AIV基因组在动物体内复制的过程中未发生变化。小鼠体质量在14 d观察期内变化不明显,仅处于小幅度的波动范围,表明3株病毒对小鼠呈现低致病力。

表2 H7N2亚型AIV对鸡的致病力试验结果Table 2 Replication and virulence of H7N2 avian influenza viruses in chicken.

表3 H7N2亚型AIV对鸭的致病力试验结果Table 3 Replication and virulence of H7N2 avian influenza viruses in duck

表4 H7N2亚型AIV对小鼠的致病力检测结果Table 4 Replication and virulence of H7N2 avian influenza viruses in mice
3 讨论
尽管之前本研究室2014年从国内分离到的H7N2 AIV的HA及多个内部基因节段均来自2013年新出现的H7N9亚型AIV[4],但在2014年之后,本研究室在监测过程中再未发现这样的重组病毒。本研究中3株H7N2亚型AIV均分离自活禽市场中的鸭,但其各基因节段来源均不同,为H7N7、H3N8和H10N7等多个亚型病毒的重组体,表明H7N2亚型AIV基因来源的复杂性及遗传的多样性。HA蛋白Q226L、G228S的突变能增强病毒结合人型受体的能力,从而引起人流感的大流行[7-8]。另外,HA蛋白裂解位点处多个碱性氨基酸的增加以及PB2蛋白E627K、D701N的突变均可以增强AIV对家禽及哺乳动物的致病力[9-10]。本研究通过对3株AIV相应蛋白氨基酸关键位点的分析并未发现上述的突变出现(该部分数据未显示)。
研究表明,2018年初分离到的一株高致病性A/duck/Fujian/SE0195/2018(H7N2)突变株,其HA基因来自高致病性H7N9亚型AIV,NA基因与H3N2亚型AIV高度同源,家禽感染性试验结果显示该病毒对感染家禽快速致死[5],表明自然界存在发生基因重组并突变成高致病性病毒的风险。虽然本研究中3株H7N2 AIV对家禽表现出低致病性,但仍存在病毒在其部分脏器中复制的情况,因此该病毒可以在家禽中复制和传播,特别是在水禽中长期传播。应继续加强对H7N2亚型AIV的监测工作,必要时采取严格的防控措施。
PB2蛋白E627K和D701N的突变是影响流感病毒致病力的关键因素之一。2013年部分H7N9亚型人流感病毒PB2蛋白具有627K变异且该病毒可以在哺乳动物体内有效复制,导致其出现严重的临床症状[10]。而且有研究报道,2017年的H7N9亚型AIV其PB2蛋白在哺乳动物体内出现E627K、D701N的突变使病毒毒力增加万倍以上[11]。在本研究中,分离的3株H7N2亚型AIV的PB2蛋白627和701位均未出现与哺乳动物适应性相关的变异,但病毒能够在小鼠体内有效复制并导致其体质量下降。这一结果表明H7N2 AIV也可能感染人类并导致疾病,值得关注。
因此,本研究对H7N2亚型AIV的持续监测和生物学特性的深入研究可为我国流感疫情防控及预警预报提供有效的数据支持。

