阳宗海湖滨湿地沉积物磷形态及影响因子
刘云根, 王 妍, 齐丹卉, 李梦莹, 徐晓军
(1.昆明理工大学环境科学与工程学院,云南 昆明 650504; 2.西南林业大学生态与水土保持学院,云南 昆明 650224)
湖泊底泥中磷的释放是影响水体磷含量的主要因素之一,不同磷形态对湖泊富营养化的影响不同[1-2].湖滨湿地对外源污染物具有拦截作用[3-4].沉积物中磷酸盐对环境的变化敏感,如水体中溶解氧、pH等因子对磷形态的影响较大[5-6].以湖泊沉积物中总磷量(total phosphorus, TP)作为磷释放量的计算依据不全面,且不同磷形态的稳定性差异较大,受环境因子影响的差别也较大[7].不少研究探究过阳宗海沉积物中磷含量的分布特征及环境对它的影响[8-10],但很难说明环境因素对湖滨湿地磷形态的作用.有研究者运用回归分析建立水质指标和参数之间的关系模型,揭示水质因子之间的客观规律,提高了预测精度和实用性[11-13],但对湖滨湿地沉积物磷形态的预测模型的研究较少,而此类研究模型的建立可以跟踪到影响湖泊水体富营养化及各磷形态含量微变化的关键因子,进而针对性地控制湖泊水体富营养化.
本研究以阳宗海湖滨湿地沉积物为研究对象,探究磷形态含量与环境参数随季节的变化,旨在更有效地控制湖泊各磷组分的含量.其中磷形态包括磷酸二钙型Ca2-P、磷酸八钙型Ca8-P、磷酸铝盐Al-P、磷酸铁盐Fe-P、闭蓄态磷酸盐O-P、磷石灰型Ca10-P,环境参数包括沉积物全磷(total P in sediment, S-TP)、沉积物有效磷(available P in sediment, S-AP)、沉积物总砷(total arsenic in sediment, S-TAs)、沉积物有机质(organic matter in sediment, S-OM)、水体总磷(total P in water, W-TP)、水体溶解性总磷(total dissolved P in water, W-DTP)、水体正磷酸盐(soluble reactive phosphate in water, W-SRP)、水体总砷(total arsenic in water, W-TAs)、溶解氧(dissolved oxygen, DO)、氧化还原电位(oxidation-reduction potential, Eh)、电导率(electrical conductivity, EC)及水/沉积物pH(pH of water, W-pH; pH of sediment, S-pH).
1 材料与方法
1.1 研究区概况
阳宗海位于云南省昆明市呈贡区、宜良县和玉溪市澄江县的交界处,是高原淡水湖泊.呈纺锤形,湖面面积31.9 km2,总蓄水量6.04×108m3,最大水深30 m,平均水深20 m.阳宗海流域属亚热带气候,降水量824.6 mm,雨季5—10月降水量占年降水量的85%.阳宗海曾于1997年爆发蓝藻水华,水质降至Ⅳ类水,采取一系列措施后污染得到较好控制,目前水环境总体处于贫营养向中营养过渡阶段,水体中总磷平均值为0.021 mg·L-1,处于富营养化警戒线(水体总磷Ⅲ类标准值0.025 mg·L-1)[14].2008年阳宗海爆发了砷污染,在2009—2011年通过喷洒絮凝剂(铁盐)对水体砷污染进行治理,湖水中砷的浓度大幅度下降,低于Ⅲ类标准限值.
阳宗海的东、南、西、北岸均有湖滨湿地分布,主要以挺水植物香蒲为主.由于湖泊构造及周边人为干扰等因素,阳宗海东、西、北岸的湖滨湿地退化较为严重,植被覆盖较少,只有南岸湖滨湿地植物相对较多,具有典型的研究价值.
1.2 样点布设与样品采集
采用典型样带法,根据上游人为干扰方式在阳宗海南岸的湖滨湿地布设4条样带,每条样带设3条平行样带,样带1是空白样带(现场勘察上游无人为干扰,但在1-3和1-4位置的湖底有大面积的围网养殖),样带2上游为农村和农田的混合,样带3上游的主要干扰方式为农田,样带4为农村,每条样带沿湖岸至湖心方向等比例布设3~5个采样点,共15个样点(图1).2015年7月至2016年4月每季度采样一次,分别采用柱状沉积物分层采样器和水质分层采样器采集沉积物样品(表层10 cm)和表层水(50 cm),每个样点采集3个平行样,装入洁净的聚乙烯密封袋和瓶中,标记好带回实验室.
1.3 样品分析与数据处理
1.3.1 样品分析 沉积物样品自然风干后,挑出植物根、石块等杂物后研磨过100目筛备用.水质样品保存在冷藏室并于48 h内测定.每个样品的每个指标做3个平行.物理指标中W-pH、DO、Eh和EC采用哈希HQ40 d水质分析便携式仪器现场测定,水和沉积物检测方法如表1所示.

表1 水和沉积物指标检测方法Table 1 Analysis methods for indicators of water and sediment samples

图1 阳宗海湖滨湿地样点设置示意图Fig.1 Schematic map of sampling points in Yangzonghai lakeside wetland
1.3.2 数据处理 在Excel 2016中对2015年7月、10月及2016年1月、4月数据进行预处理并分析沉积物磷、环境因子分布特征,采用SPSS 21中的Pearson相关性分析程序分析沉积物磷与各环境因子间的关系,再利用线性回归分析法得出回归方程,验证环境因子对沉积物磷的影响程度.
2 结果与分析
2.1 湖滨湿地环境因子及沉积物磷形态的分布
阳宗海湖滨湿地环境因子在不同季节的状况如表2所示.水体和沉积物中TAs的含量7月最高,4月和10月波动不大.水体中正磷的含量1月最高,在不同月份差异显著(P<0.05).水体和沉积物中TP、DTP含量无季节性差异.OM的含量在秋冬季较高.水体和沉积物的pH大部分呈中碱性,5种物理指标大部分在1月和4月较高,单因素方差分析结果显示,物理指标中除了W-pH、EC在不同季度不存在差异外(P>0.05),其他指标均存在明显差异(P<0.05).

表2 不同月份阳宗海湖滨湿地环境因子状况Table 2 Characteristics of environmental factors of Yangzonghai lakeside wetland in different months
阳宗海湖滨湿地沉积物TP(表2)及形态含量分布如图2所示.1、4、7、10月沉积物TP含量范围分别为207.05~925.94、189.21~1 158.53、215.54~1 325.33、177.31~1 238.47 mg·kg-1,不同样带TP平均含量排序为样带2>样带1>样带4>样带3,4条样带在不同月份呈沿湖岸—湖心方向的削减的趋势,且7月TP含量较高.6种磷形态平均含量由低到高的排序为Ca2-P
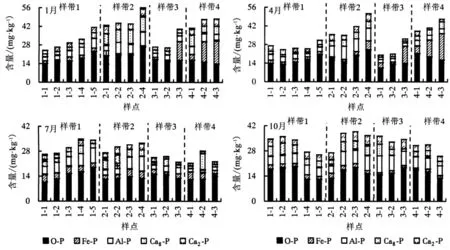
图2 阳宗海湖滨湿地沉积物磷形态分布Fig.2 Phosphorus fraction of sediments in Yangzonghai lakeside wetland

图3 阳宗海湖滨湿地Ca10-P的季节性变化Fig.3 Seasonal changes in Ca10-P content in the sediment of Yangzonghai lakeside wetland
2.2 湖滨湿地环境因子对磷形态的影响
由磷形态与环境因子的相关性分析可知(表3),S/W-P与Al-P、Ca2-P、 Ca8-P、Ca10-P呈极显著正相关(P<0.01),S/W-As与Al-P、Ca10-P呈极显著正相关(P<0.01).物理指标中S-pH、DO、EC与O-P呈极显著正相关(P<0.01),与Ca10-P呈显著负相关(P<0.05),DO、Eh与Ca8-P有显著相关性.

表3 阳宗海湖滨湿地沉积物磷形态与环境因子的相关系数及显著性1)Table 3 Correlation coefficients between phosphorus fractions and environmental factors in the sediments of Yangzonghai lakeside wetland.
1)*在0.05水平(双侧)上显著相关;**在0.01水平(双侧)上显著相关;-在0.05水平(双侧)上不显著相关.
2.3 磷形态回归模型及预测效果
利用2015年7月、2016年1月和4月各环境因子建立线性回归方程,各磷形态与环境因子的线性回归分析结果如表4所示.拟合系数越接近1,表明拟合程度越好;越接近0,拟合程度越差;P值均小于系统默认的显著性水平0.05,表明回归效果非常显著,磷形态与其相关的变量之间具有较为显著的线性关系.
1)x1=S-TP;x2=S-AP;x3=S-OM;x4=S-As;x5=W-As;x6=W-TP;x7=W-DTP;x8=W-SRP;x9=S-pH;x10= W-pH;x11=DO;x12=Eh;x13=EC.
利用表层沉积物磷形态回归模型模拟2015年10月采样数据,对比实测值和预测值(图3),钙磷组分中Ca10-P模拟程度较好,相对误差值在0.49%~9.68%,标准偏差值为7.55%;Ca2-P和Ca8-P模拟程度较差,但预测趋势与实测大致相同,相对误差为2.38%~35.62%,其标准偏差为22.63%和28.06%.Fe-P、Al-P和O-P实测值与预测值平均相对误差为22%,预测精度相对较高.
3 讨论与结论
3.1 讨论
3.1.1 湖滨湿沉积物磷形态的分布 阳宗海湖滨湿地不同样带S-TP平均含量排序为样带2>样带1>样带4>样带3,S-TP的含量主要与上游的人为干扰方式有关.样带2的上游是阳宗大河,流经城镇、农田携带了大量的农田废水和生活污水,因此样带2的平均S-TP含量都高.样带1设有围网养殖,养殖产生的排泄物使该区域湖水的有机质含量明显增加,S-TP含量随之增加,因此总体上样带1的TP含量高于样带3和4[23].样带4的S-TP含量在湖岸区域偏高与其凹形位置有关,S-TP随水流向两边扩散.样带3的上游为七星河,大部分流经农田,如农闲不施肥时随雨水汇入河道的含磷化肥就低,因此样带3的平均S-TP含量略低.同时4条样带7月的S-TP含量高与雨季(夏季)有关,上游污染物如土壤中过量的含磷化肥被大雨冲刷随地表径流汇入河道进入湿地,加上雨季易引起沉积物扰动使得沉积物处于再悬浮状态,促进营养盐的释放或者再生[24-25].不同类型生态系统湖泊的S-TP含量存在较大的差异.阳宗海湖滨湿地S-TP的平均含量为558 mg·kg-1,低于同为高原湖泊的滇池湖滨湿地[26](481~10 604.64 mg·kg-1,均值为2 452 mg·kg-1)、洱海[27](259.10~1 769 mg·kg-1,均值为866 mg·kg-1).但近年阳宗海W-TP浓度超过GB 3838—2002Ⅲ类标准[14],因此沉积物及水体TP的内源负荷不容忽视.4条样带S-TP含量沿湖岸至湖心方向逐渐降低(P<0.05),说明湖滨湿地对污染物有截留作用,具有长期净化水质的环境效应[28-29].

图4 2015年10月沉积物磷形态模拟值与实测值比较Fig.4 Comparison between the simulated and measured values of phosphorus fraction in the sediments in October 2015
Ca-P来源于湖泊沉积碳酸钙或自生的磷灰石,通常把Ca-P作为一个整体,认为是生物不可利用的磷.本研究将Ca-P分为活性磷Ca2-P、Ca8-P(易于释放的磷形态)和惰性磷Ca10-P[30].阳宗海湿地沉积物中的Ca10-P含量较高(85%),Ca2-P、Ca8-P含量较低,可见整体上沉积物中的磷不易释放,有利于减缓水体富营养化进程.阳宗海沉积物中Ca2-P和Ca8-P含量与普者黑沉积物中Ca2-P、Ca8-P(8%)含量相近[31],低于洱海(18.23%)[32],可能得益于阳宗海湖滨和湖岸较丰富的挺水/水生植物,因为Ca2-P和Ca8-P易被水生生物吸收.Fe/Al-P、O-P属于潜在释放磷形态,占TP的4%和7%,低于滇池草海[33](11.4%、40.1%)和剑湖[34](24.62%、7.49%),说明阳宗海Fe/Al-P、O-P造成的风险较低.各形态磷在不同月份的含量无明显的规律,可能来源于湖滨湿地复杂的环境因子(温度、pH、Eh等)和生物(植物和微生物)的综合作用,使各形态磷间发生相互转化所致.
3.1.2 湖滨湿地环境因子对磷形态的影响 钙磷组分(Ca2-P、Ca8-P、Ca10-P)与水和沉积物中磷(S-TP、S-AP、W-TP、W-DTP、W-SRP)的不同相关性是由各组分的理化性质决定的.Ca2-P、Ca8-P和S-AP、W-DTP、W-SRP属于易被植物吸收的有效磷,Ca10-P与S/W-P正相关与CaCO3-P的共沉淀有关[35].S-As与Ca10-P呈正相关是由于阳宗海在2008年爆发砷污染,砷与Ca矿物(磷酸钙和羟基磷灰石)形成沉淀,转化成成不易释放的形态[36-37].Al-P与S-As呈正相关是由于水体中磷酸根与同样以含氧阴离子形式存在的砷酸根产生吸附作用[38].O-P与S/W-As呈负相关是由于土壤中Fe、Al氧化物及其氢氧化物是As的主要吸附剂,磷盐易被Fe2O3胶膜包裹,当As被沉积物吸附后,被Fe2O3包裹在颗粒表面上[39].Fe-P与OM呈正相关是由于OM具有较多的官能团,可通过离子交换或其他金属阳离子架桥的方式结合磷酸根离子[40].物理指标(S/W-pH、DO、EC、Eh)与磷形态的相关性不一,也是由磷形态的性质决定的.DO和Eh决定水体处于好氧/氧化环境还是厌氧/还原环境,当厌氧(还原环境)增加,钙结合态的磷可溶,促进磷释放[41].当pH值小于6,铁铝矿物以游离的可溶性盐类存在;弱碱环境下,水体的氢氧根离子增多,游离的铁铝与氢氧根结合,生成易于吸附磷的氢氧化物;强碱环境下,磷释放,因此Fe/Al-P与pH呈现较强的相关性[42].在中性环境下O-P稳定,强酸环境下被释放,当氧化还原电位降低(还原环境)Fe2O3胶膜包含的磷酸铁及磷酸铝,三价态还原成二价态,磷被释放[43].
3.2 结论
(1)湖滨湿地沉积物TP含量波动不大,样带2的S-TP含量较高且在7月含量最高,与上游污染来源有关,呈现湖岸至湖心递减的趋势,说明湖滨湿地对污染物有拦截作用;沉积物磷形态以Ca10-P为主,6种磷形态在季节分布上无明显规律,相关性表明S-TP、S-As、S-pH、DO、EC对磷形态有较大影响.
(2)线性回归分析能较好地预测惰性磷O-P、Ca10-P的时空分布规律(平均相对误差为14.77%),预测的活性磷Ca2-P、Ca8-P的相对误差较大(28%),与活性磷易受环境因子影响有关.增设新的环境因子,可能可以更准确地预测活性磷的变化.

