高寒草地土壤产漆酶真菌的筛选及分子鉴定
李 欣, 芦光新, 姚世庭, 党 宁, 王英成
(1. 青海大学, 青海 西宁 810016; 2. 青海大学农牧学院, 青海 西宁 810016)
漆酶(Laccase EC 1.10.3.2)是1883年被日本科学家Yoshida发现[1],1894年被法国人Bertrand[2]研究并命名的一种酶。漆酶是一种催化中心含有多个铜离子的广泛存在于植物、动物、微生物及昆虫中的多酚氧化酶,可氧化木质素、酚类化合物、非酚类化合物等底物,且随着漆酶的氧化还原电势越高,可降解的底物范围越广[3]。通过一百多年的发展,漆酶在食品工业、制浆和造纸工业、纺织工业、土壤的生物修复等领域具有广泛的应用前景[4]。在服装行业、生物传感器、环境修复、毒品检测和清除军用化学毒剂等方面也有相关的研究报道[5]。
植物产生的漆酶发现最早,但高等植物产生的漆酶的研究相对较少。目前,已发现产漆酶的植物有日本漆树、欧亚槭树、拟南芥、水稻、松树、黄杨、棉花、芒果和香蕉等[6-7],存在漆酶的动物(昆虫)有猪、烟草天蛾、绿头苍蝇、蚊子及双翅目的迁移类蝗虫等[8-10]。微生物漆酶的研究主要以真菌漆酶为主,因其产生的是胞外酶,容易提取,并且其是唯一可以将木质素降解生成二氧化碳和水的多酚氧化酶[11]。动植物产漆酶一般生长周期长,同时还受地理、气候和季节等因素的限制,不适于大规模工业化生产。微生物生长周期短,繁殖快,且易于提取与纯化,微生物产生的漆酶是工业漆酶的重要来源[12],备受国内外的科学研究的青睐[13-15]。
由于漆酶巨大的应用价值以及不同物种中漆酶的含量、催化部位的结构和酶学性质差异较大,因此,进行漆酶产生菌的分离筛选一直是漆酶研究的热点之一。到目前为止,已有从土壤中分离筛选产漆酶真菌的报道[16-19],但高寒草地土壤中产漆酶菌株的筛选鲜有报道,高寒草地土壤环境中孕育着丰富的微生物资源,常年持续的低温环境可能会造就其不同于其他环境的微生物资源,因此在高寒环境中探索与发现新的产漆酶真菌具有重要意义。本文选用漆酶作用的8种底物为选择性培养基,并通过测定漆酶活力,筛选高寒草地土壤中的产漆酶菌株,以期丰富漆酶产生菌的种类,并且为高寒草地土壤微生物产漆酶菌株的筛选研究做初步探究。
1 材料与方法
1.1 供试菌株
供试的9个真菌菌株1.9,2.1a,310b,2.1c,2.3a,2.4d,10a,3.7c,WB均由本课题组从东祁连山高寒草地土壤中通过稀释分离法,将土壤样品母液进行梯度稀释,选用适当的培养基进行分离、纯化和纯培养后筛选获得,保存于4℃冰箱。
东祁连山高寒草地自然概况:实验区位于甘肃省天祝县境内,海拔2 700~4 300 m之间。气候寒冷潮湿,空气稀薄、太阳直射强。年均温-0.1℃,1月份均温-18.3℃,7月份均温12.7℃;大于0℃年积温1 380℃。水热同期,年均降水量416 mm,集中在7-9月份;年蒸发量1 592 mm,无绝对无霜期,仅分为冷、热两季。区内土层较薄,有机质含量高,微生物资源丰富。
1.2 培养基
菌株活化、保存培养基PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 ml。
产漆酶菌株筛选培养基察氏培养基:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO40.5 g,FeSO40.01 g,底物10 g,琼脂10 g,蒸馏水1 000 ml。
漆酶底物选择性培养基在察氏培养基的基础上,分别添加1%的愈创木酚(Guaiacol)、ABTS(Agreement of Basic Telecommunications Services)、蒽酮(Anthrone)、邻苯二酚(Catechol)、邻联甲苯胺(o-Tolidine)、邻甲苯胺(o-Toluidine)、α-萘酚(α-Naphthol)、联苯胺(Benzidine)、没食子酸(Gallic acid)等9种漆酶底物,灭菌备用。
液体产酶培养基:NaNO32.5 g,KH2PO41 g,CaCl2·6H2O 0.1 g,MgSO40.3 g,NaCl0.1 g,FeCL30.01 g,蒸馏水1 000 ml,pH自然。灭菌后加入统一直径的菌饼。
草地植物粉末-液体产酶培养基:草地植物粉末1 g,NaNO32.5 g,KH2PO41 g,CaCl2·6H2O 0.1 g,MgSO40.3 g,NaCl 0.1 g,FeCL30.01 g,蒸馏水1 000 ml。灭菌后加入统一直径的菌饼。
1.3 研究方法
1.3.1产漆酶真菌的初步筛选 将活化的菌株接种于分别以愈创木酚、ABTS、蒽酮、邻苯二酚、邻联甲苯胺、邻甲苯胺、α-萘酚、联苯胺、没食子酸为底物的察氏培养基上,以25℃培养,定时观察菌落生长和菌落周围颜色深浅变化情况。
选出能产生褐色氧化带的菌株,25℃培养,每天定时观察菌落形态的同时,测量菌丝圈、变色圈直径,记录变色圈颜色深浅,以判断漆酶生产菌株。
1.3.2粗酶液的制备及漆酶活力测定 将制备好的液体产酶培养基置于25℃、180 r·min-1的摇床发酵。粗酶液制备好后按照王剑锋等[24]方法进行测定,一个酶活单位(IU)定义为1 min内氧化1 μmol底物所需要的酶量。
1.3.3产漆酶菌株的DNA-ITS分子鉴定 将9株菌株的rDNA-ITS序列测定结果与GenBank中已登录的序列进行Blast比对,使用MEGA7软件中的Neighbor-Joining程序构建系统进化树。
1.4 数据处理及分析
将不同条件下各处理中酶活力换算成酶活力相对值,所有数据均用Microsoft Excel录入并作图,采用DPS 6.55进行数据分析。
2 结果与分析
2.1 产漆酶菌株的DNA-ITS分子鉴定结果
将9株菌株菌株的5.8SrDNA-ITS序列测定结果与GenBank中已登录的序列进行Blast比对,比对结果如表1所示;使用MEGA7软件中的Neighbor-Joining程序构建系统进化树,如图1所示。
2.2 供试菌株在不同底物选择性培养基上的显色情况
由表2可以看出,在愈创木酚选择性培养基上接种后,菌株1.9,2.1a,310b,2.1c,2.3a,2.4d周围出现氧化带;在蒽酮选择性培养基上接种后,菌株1.9,2.1a,310b,2.1c,2.3a,2.4d,10a周围出现氧化带;在邻苯二酚选择性培养基上接种后,只有菌株2.4d周围出现氧化带;在邻联甲苯胺选择性培养基上接种后,菌株1.9,2.1a,310b,2.1c,2.3a,2.4d,10a,WB周围出现氧化带;在邻甲苯胺选择性培养基上接种后,只有菌株2.3a,2.4d周围出现氧化带;在1-萘酚选择性培养基上接种后,只有菌株1.9周围出现氧化带;在联苯胺选择性培养基上接种后,菌株1.9,2.1a,310b,2.1c,2.3a,2.4d,10a周围出现氧化带;在没食子酸选择性培养基上接种后,所有菌株均无氧化带出现。

表1 菌株鉴定结果及NCBI的注册号Table1 Identification results of strains and registration number of NCBI

图1 系统发育树Fig.1 phylogenetic tree
各菌株在不同底物培养基上的氧化带如图2~图8所示。菌株在愈创木酚、蒽酮、邻甲苯胺和邻苯二酚为底物的培养基上呈现红褐色氧化带,培养基呈半透明状。菌株在联苯胺、α-萘酚为底物的培养基上呈现紫黑色氧化带,培养基呈不透明状。在邻联甲苯胺为底物的培养基上呈现黑褐色氧化带,培养基呈不透明状。氧化带和培养基因底物不同而呈现不同颜色。

表2 供试菌株在不同底物选择性培养基上的显色情况Table 2 Color development of test strains on different substrate selective media
注:“√”表示能够产生氧化带
Note:“√” means that it can produce an oxidized zone
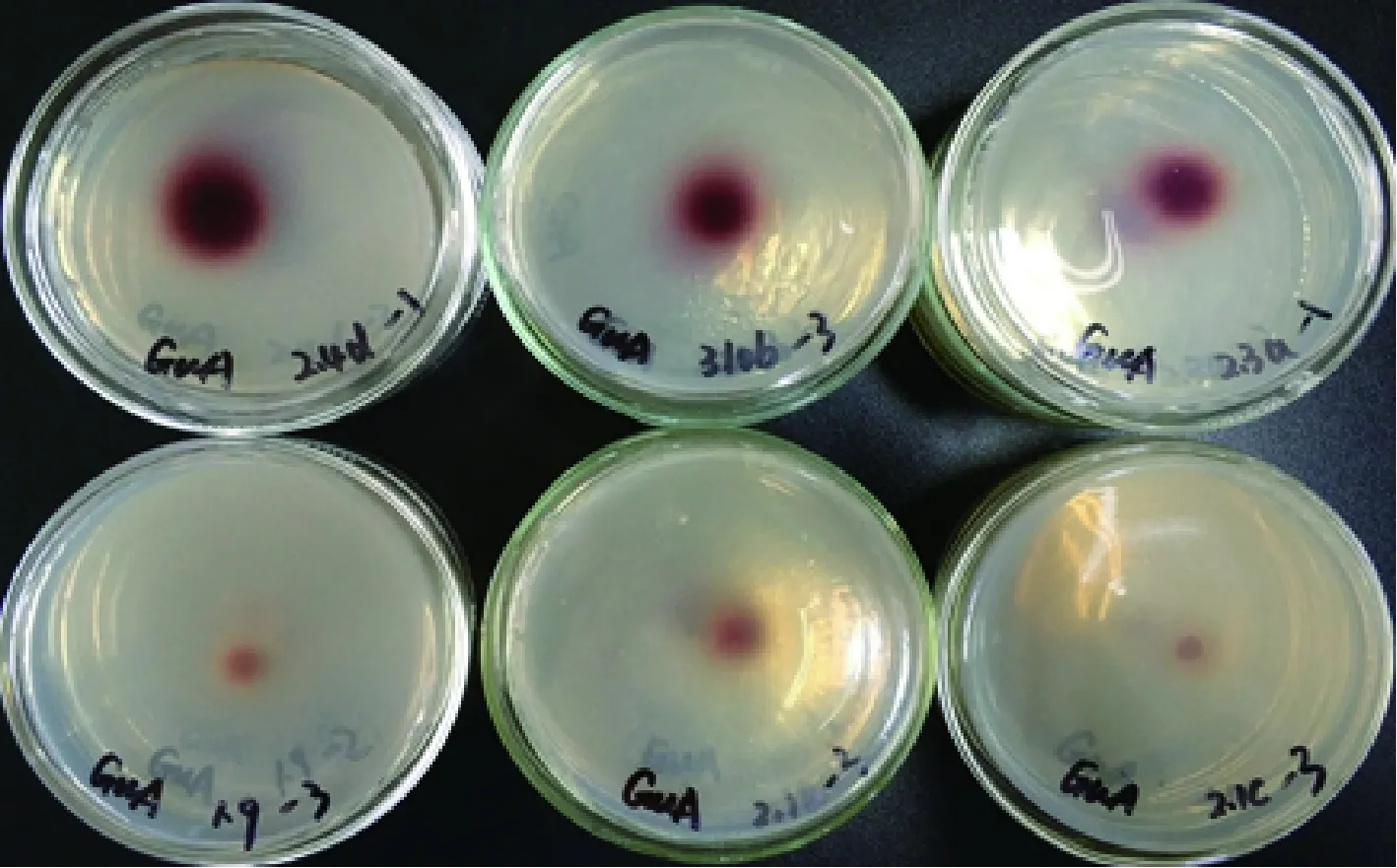
图2 菌株在愈创木酚底物培养基上的显色情况Fig.2 Coloration of strain on wood-induced phenolic substrate medium

图3 菌株在联苯胺底物培养基上的显色情况Fig.3 Coloration of strains on bibenzidine substrate medium
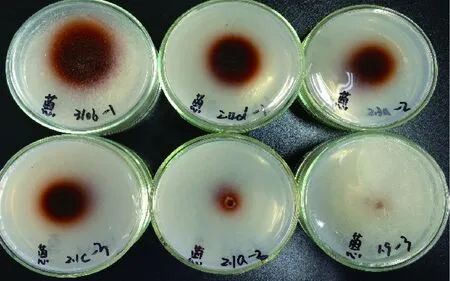
图4 菌株在蒽酮底物培养基上的显色情况Fig.4 Coloration of strain on Anthrone substrate medium

图5 菌株在邻甲苯胺底物培养基上的显色情况Fig.5 Coloration of strain on o-toluidine substrate medium

图6 菌株在邻苯二酚底物培养基上的显色情况Fig.6 Coloration of strain on catechol substrate medium
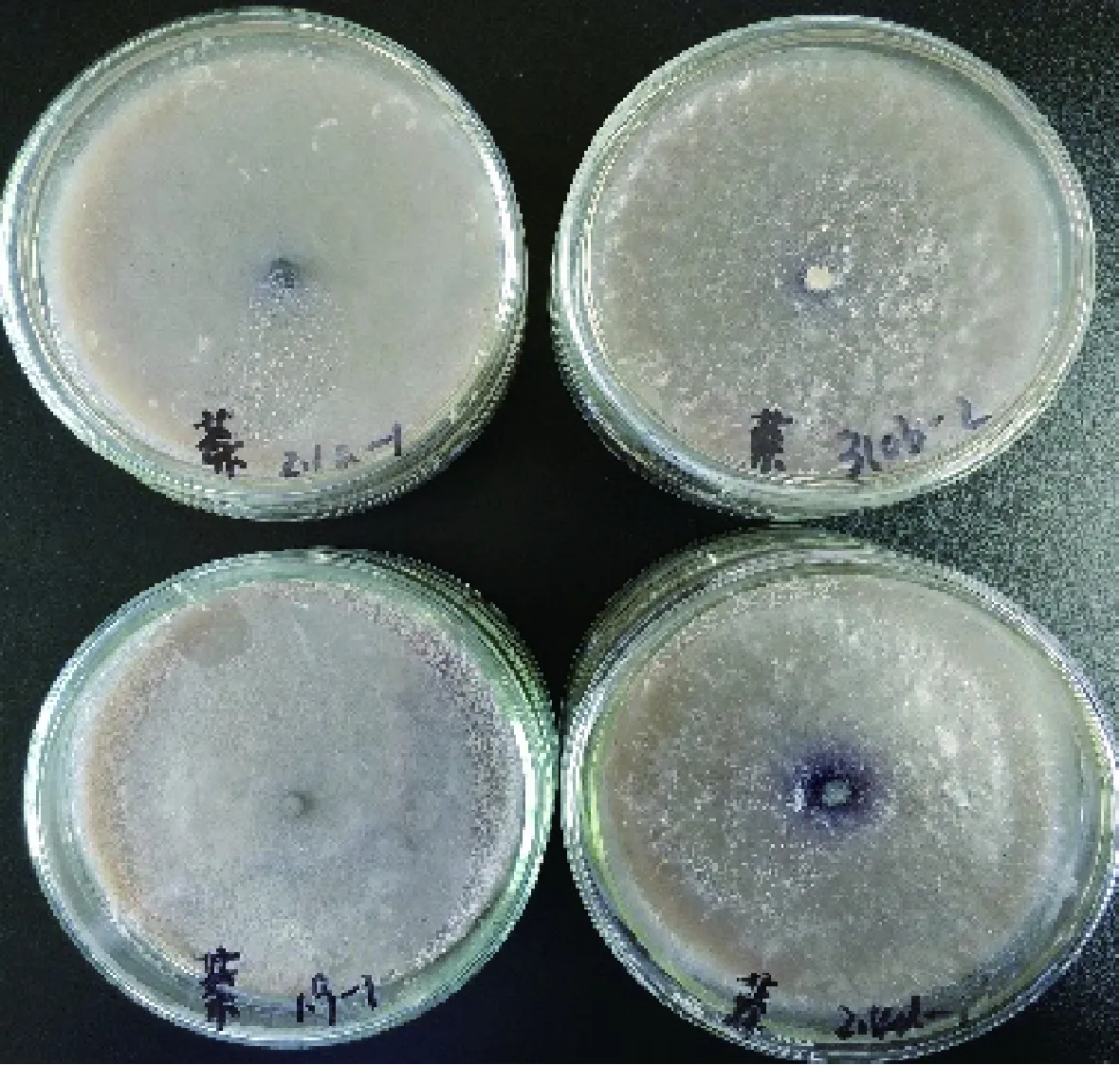
图7 菌株在α-萘酚底物培养基上的显色情况Fig.7 Coloration of strain on α-naphthol substrate medium
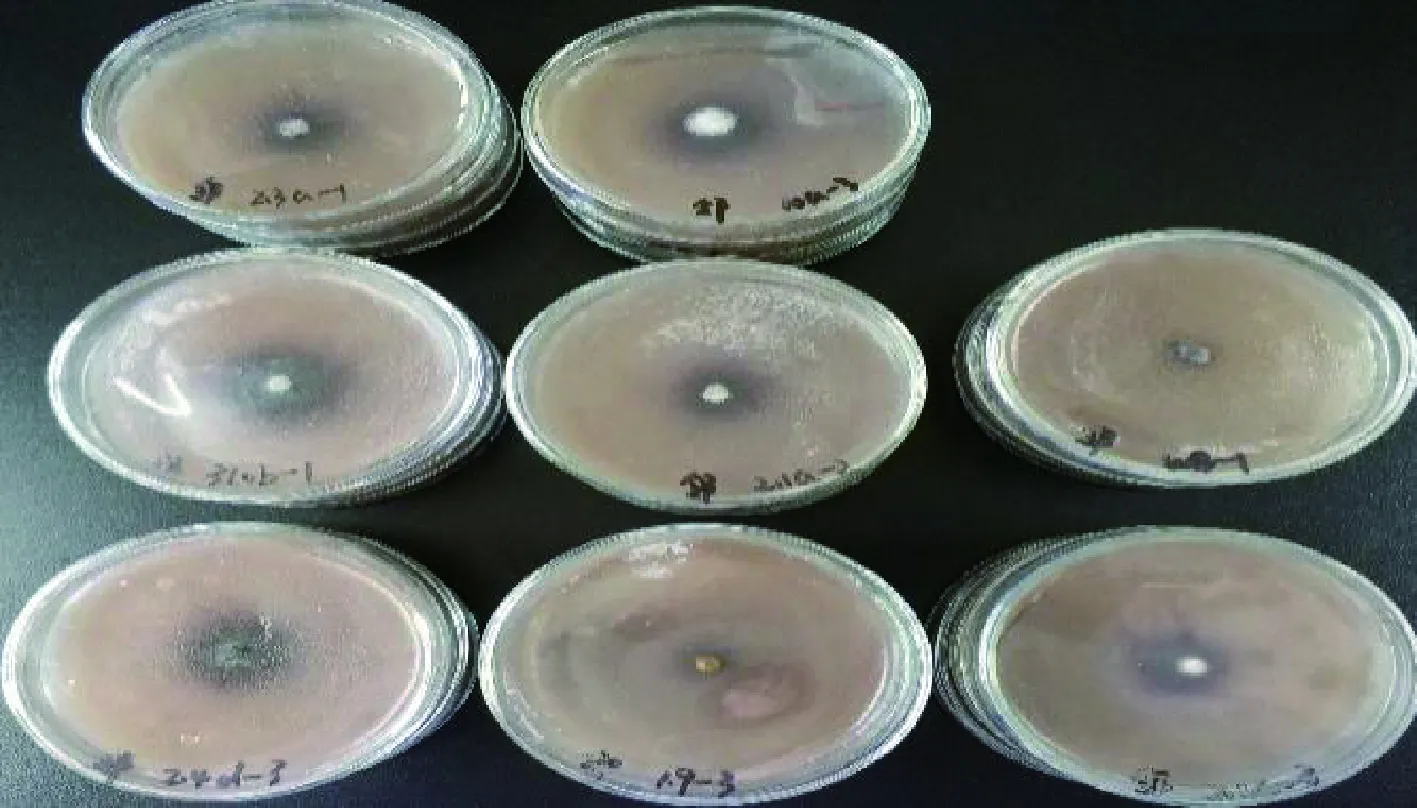
图8 菌株在邻联甲苯胺底物培养基上的显色情况Fig.8 Coloration of strain on ortho-benzidine substrate medium
2.3 供试菌株在底物选择性培养基上出现氧化带的时序
由表3可以看出,菌株1.9和菌株2.3a可氧化底物较少,菌株周围出现氧化带时间较长;菌株2.1a、310b、2.3a、2.4d可氧化底物较多,菌株周围出现氧化带时间较快,接菌24 h后菌株周围基本都已出现氧化带;菌株10a在接菌24 h后,只有在以邻联甲苯胺和联苯胺为底物的培养基上出现氧化带,接菌72 h后,在蒽酮为底物的培养基上出现氧化带,氧化带出现时间慢。菌株WB在接菌96 h后,只有在以邻联甲苯胺为底物的培养基上菌株周围出现氧化带,在其他7种底物培养基上均无氧化带出现。菌株3.7c在8种底物培养基上接菌后,无任何氧化带出现。

表3 供试菌株在不同底物选择性培养基上出现氧化带的时序Table 3 Timing of the oxidized bands on the different substrate selective medium of the tested strains
注:表中“+”表示产生氧化带
Note:"+" in the
Table indicates the occurrence of an oxide band
2.4 供试菌株在底物选择性培养基上的生长情况及氧化带大小
将9种菌株分别接在8种不同底物选择性培养基上,培养5d后,菌株2.1a,310b,2.1c,2.3a,2.4d生长状况较好,氧化带直径较大,菌株直径也较大。菌株1.9能产生氧化带底物较多,但氧化带出现时间晚,氧化带直径小,不是产漆酶优势菌株。菌株10a在蒽酮为底物的培养基上生长速度快,菌株直径大,但氧化带颜色浅,不是产漆酶优势菌株。
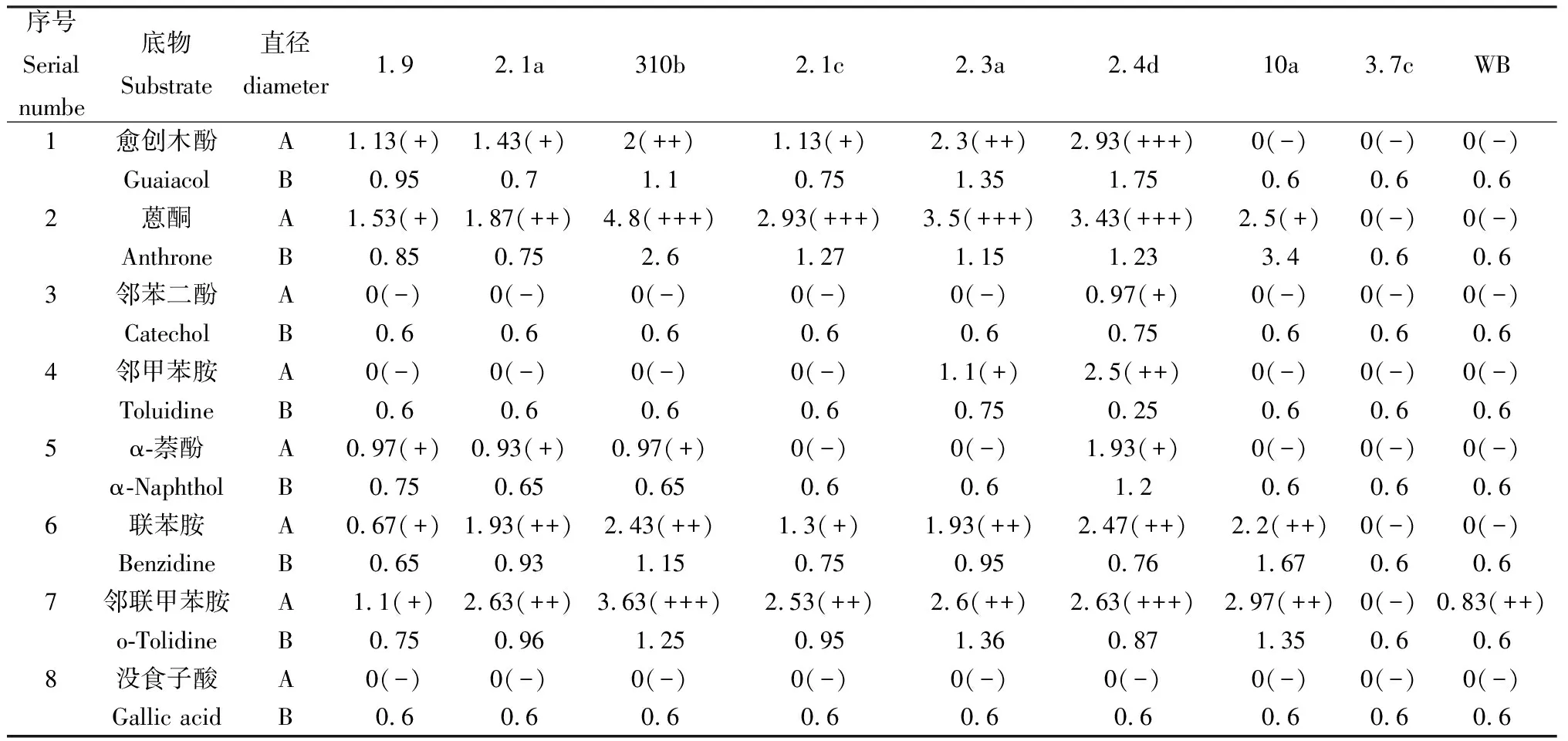
表4 供试菌株在不同底物选择性培养基上的生长情况Table 4 Growth of test strains on different substrate selective medium
注:表中A表示氧化带直径/cm,B表示菌落直径/cm。列出的氧化带直径一栏中,前面的数字表示氧化带直径,括号中的“+”表示颜色的深浅程度,“-”表示没有产生氧化带
Note:In the
Table,A represents the diameter of the oxidation zone/cm,and B represents the diameter of the colony/cm. In the column of diameter of the listed oxidation zone,the front number indicates the diameter of the oxidation zone,the "+" in parentheses indicates the degree of lightness,and the "-" indicates that no oxidation zone is produced
2.5 产漆酶菌株的复选
图9可以看出,菌株在液体摇瓶发酵后,以ABTS为氧化产物测定吸光值,结果发现菌株310b的吸光值也同样明显高于其他菌株,差异极显著(P<0.01),这说明菌株310b产漆酶活性最高。

图9 菌株在草地植物粉末诱导下的吸光值
3 讨论
漆酶作为一种氧化酶,初步统计它催化氧化不同类型的底物已达250个[20]。按底物结构可归纳为六类[21]:(1)酚及其衍生物;(2)芳胺及其衍生物;(3)羧酸及其衍生物;(4)甾体激素和生物色素;(5)金属有机化合物;(6)其他非酚底物。但是目前常见漆酶底物有多种单体或多聚体酚类、苯胺及一些杂环化合物[22],测定漆酶活力普遍使用的底物为ABTS(2,2-联氮基-双-(3-乙硝基并噻唑啉-6-磺酸)二氨盐)、DMP(邻苯二甲酸二甲脂)和愈创木酚,但由于漆酶对不同底物的氧化速率的不同而呈现多种漆酶活力的表述方式,使得各研究中漆酶的活力不易做比较。本实验中因考虑到实验成本和实验效果因素,故选用愈创木酚、蒽酮、邻苯二酚、邻联甲苯胺、邻甲苯胺、α-萘酚、联苯胺、没食子酸8种底物对9株不同产漆酶真菌菌株进行了筛选比较。
根据漆酶催化氧化还原反应产生的氧化带时序、氧化带直径平均值及其颜色深浅程度,以及菌体的生长和菌落大小对不同产漆酶菌株和不同诱导产漆酶底物做一个筛选分析。实验中发现,9株菌株在8种底物上的生长状况各不相同。在以没食子酸为底物的选择培养基上,9株菌株均不产生氧化带,菌株颜色发黑,推测没食子酸对菌株生长具有抑制作用。菌株在不同培养基上的显色反应有差别,可能是培养过程中8种底物对不同菌株漆酶生物合成的诱导作用不同,这种现象的产生除了与菌株所合成漆酶的产量、活力和类型有关外,可能还与不同菌株所产的漆酶对不同底物的催化专一性差别有关。在蒽酮和邻联甲苯胺为底物的选择性培养基上菌丝生长快,菌落直径大,产生变色圈快,变色圈的颜色深,推测这两种底物与菌株产生漆酶亲和性高。菌株在愈创木酚和联苯胺为底物的选择性培养基上菌丝生长速度、菌落直径、变色圈生长速度以及变色圈的颜色都次于蒽酮和联苯甲苯胺。菌株在邻甲苯胺和邻苯二酚为底物的选择性培养基上菌丝生长慢,菌落直径无变化,产生的变色圈直径小,颜色浅,这与芦光新等[23]对高寒草地土壤三色小皮伞菌产漆酶特性的研究中的结果稍有偏差,但结果呈现相同规律,可能的原因是芦光新在底物筛选时采用底物-PDA培养基,营养丰富,利于菌丝生长,而本文中采用察氏培养基。另外,不同菌株在8种平板培养基上的生长速度不同,因此漆酶催化氧化还原反应产生的变色圈直径与菌落大小没有必然的相关性。
菌株1.9可显色底物有5个,分别为愈创木酚、蒽酮、邻联甲苯胺、联苯胺和α-萘酚,但是氧化带出现时间都晚,可能是菌株1.9与底物亲和力差,产生漆酶的能力弱或者产生的漆酶活力低。菌株2.4d在除了α-萘酚和没食子酸以外的底物上均能产生氧化带,菌丝生长速度快,氧化带直径大、颜色深,但在以ABTS为底物测酶活时,酶活性低。菌株2.1a、2.3a、310b、2.1c在各底物培养基上菌丝生长状况和氧化带出现时间相差不多,但结果显示菌株310b产生的漆酶活力高。大多数菌株在同种培养基的不同平行平板上显示的颜色与直径大小比较接近,但不同菌株之间颜色深浅有明显的差别,同一菌株在不同平板上的显色反应也稍有差别,显色圈相对大小不完全相同,但大多数菌株呈现出了较好的一致性,说明选择平板的稳定性和高度可重复性。蒽酮、邻联甲苯胺、联苯胺和愈创木酚对漆酶的产生可能具有一定的诱导作用,但是,也有少部分菌株的颜色深浅不一致。这些现象的产生除了与菌株所合成漆酶的产量、活力和类型有关外,可能还与不同菌株所产的漆酶对于不同底物的催化专一性差别有关。
愈创木酚既是漆酶的氧化底物又是漆酶生物合成的诱导剂,α-萘酚对于漆酶的产生具有一定促进作用[24],孙姣[25]利用漆酶能够氧化愈创木酚为红褐色的显色反应,在鉴别培养基筛选到产漆酶的三株木豆内生真菌菌株。漆酶常用于染料脱色,本实验所选底物愈创木酚、邻甲苯胺、蒽酮、邻联甲苯胺、联苯胺及没食子酸或为染料、或为染料制剂,Prasad等[26]研究了来自Pycnoporuscinnabarinus的漆酶和苯胺类有毒工业染料的相互作用;Cambria等[27]研究比较了 2,5-二甲基苯胺抑制Rigidoporuslignosus漆酶和Trametesversicolor漆酶的分子机制;任大军等[28]研究以漆酶结合ABTS的介体系统发现,该系统对蒽的降解率达到 90% 以上。马利[29]发现漆酶对活性蓝4与雷玛唑亮蓝能达到不错的脱色效果。Majcherczyk等[30]以云芝菌所产漆酶对 14 种多环芳烃降解进行测试,发现其中包括苊、荧蒽、芘及苯并[a]蒽等的降解率仅约 10%,漆酶底物种类繁多,但也存在许多尚未解决的问题[31],如漆酶的稳定性不足、氧化还原电势低等,真正成熟应用降解的底物屈指可数。而本文中出现的不同菌株在不同底物之间出现差异的原因除了底物的结构和功能的不同外,其他原因还需进一步研究。
4 结论
将筛选出的9株菌株经鉴定结果为菌株1.9为Unculturedfungusclone.、2.1a为Scytalidium、310b为Marasmiustricolor、2.1c为Saccharicola、2.3a为fungalsp、2.4d为Saccharicola.、10a为Marasmiusrotalis、3.7c为Alternaria. WB为Verticilliumlongisporum。根据菌株在愈创木酚、蒽酮、邻苯二酚、邻联甲苯胺、邻甲苯胺、α-萘酚、联苯胺、没食子酸为底物的选择性培养基上的生长情况、菌落大小、漆酶催化氧化还原反应产生的变色圈直径大小及其颜色深浅程度,进行产漆酶真菌初筛,采用液体产酶发酵法选用ABTS为底物测定漆酶活力进行复筛,结果表明:除菌株3.7c以外,其余8株菌株在以愈创木酚、蒽酮、邻联甲苯胺、联苯胺为底物的培养基上基本都产生氧化带,在没食子酸底物培养基上均不产生氧化带;菌株1.9,2.1a,310b,2.4d,10a,2.1c,2.3a均具有产漆酶活力,其中菌株310b具有较强产漆酶活力。

