绿汁发酵液中的微生物多样性及其对菌糠发酵品质的影响
陈鑫珠, 高承芳, 刘 景*, 陈炳钿, 黄勤楼, 黄秀声, 翁伯琦*
(1. 福建省农业科学院畜牧兽医研究所, 福建 福州 350013; 2. 福建省新闽科生物科技开发有限公司博士后科研 工作站, 福建 福州 350008; 3. 福建省农业科学院生态研究所, 福建 福州 350013)
21世纪以来,我国社会经济快速发展,饲料市场需求不断提高,新型饲料开发显得尤为重要[1]。近年来,我国食用菌的产量逐渐增加,使得菌糠(mushroom bran)的产量也随之增加,这也使得开发菌糠饲料资源成为研究热点[1]。青贮(silage)是将新鲜的牧草或秸秆等饲料作物,利用其表面附生的乳酸菌发酵成一种青绿多汁、耐贮存、可供动物全年均衡营养配方饲料的方法。国外对青贮研究的比较早,对一些青贮原料所含可溶性碳水化合物缺乏和附着在其上的乳酸菌数目不足是导致青贮失败,开展了青贮剂的筛选、发酵效果及品质评价等方面的研究[2]。绿汁发酵液(Fermented juice of epiphytic lactic acid bacteria,FJLB) 是近年来新研发的一种新型生物性青贮添加剂,类似于乳酸菌制剂。其本质是将植物匀浆后,利用其表面附生的乳酸菌在厌氧环境中将植物绿汁中的乳酸菌发酵富集,制成的一种青贮添加剂。其最大特点是经济和环保,制作工艺流程简单、生产成本低、操作时安全,无污染,比一些商品乳酸菌制剂稳定,且不受饲草生长季节、水分含量及发酵温度的影响[3]。近年来,逐渐成为研究的热点。在青贮料中添加绿汁发酵液可以迅速降低pH值,提高乳酸含量,抑制梭菌活动,减少低蛋白质损失,且其添加效果不受青贮原料、DM含量及青贮条件影响[4]。添加绿汁发酵液可显著地提高苜蓿青贮料的营养价值。Ohshima等[5]认为,绿汁发酵液作用于苜蓿青贮不受收获季节、生育期以及贮存温度的影响,其青贮效果较好。但是,绿汁发酵液稳定性较弱,不宜长期保存,在实际大规模生产中使用较少,其优劣性还有待进一步研究。本试验正是为探究影响其作用的微生物组成情况进行分析,为探究其稳定性影响因素奠定理论基础。
传统培养法是经典的微生物研究方法,但是在分子生物技术快速发展的今天,采用传统培养法研究微生物群落结构、种群多样性及变化有其局限性,费时和费力,且结果片面,无法充分解析样品中微生物的种类、丰度及其变化情况,低估了微生物的多样性[6]。随着分子生物学技术的发展和更新换代,16S rRNA克隆建库、限制性片段长度多态性(RFLP)、变性梯度凝胶电泳(DGGE)、脉冲电泳等方法也无法满足科研分析的需要。基于微生物宏基因组学的高通量焦磷酸测序技术具有高通量、快速、省力等优点,已逐渐被广泛应用于土壤、肠道、水体、发酵食品等各微生态环境中微生物多样性的检测和研究,成为研究的热点[7]。采用高通量测序技术检测和分析绿汁发酵液中微生物多样性还未有报道。因此,本试验利用宏基因组学技术,研究不同绿汁发酵液中的微生物多样性,为全面了解不同绿汁发酵液中的微生物组成情况、有益微生物种类、提高青贮饲料营养价值和品质提供理论基础和新方法;另外,本试验以菌糠为发酵原料,调制菌糠青贮饲料,为菌糠饲料的开发利用提供技术支撑。
1 材料与方法
1.1 材料
菌糠:栽培平菇(Pleurotusostreatus)后的菌糠,由福建农林大学菌草研究所提供。配方:五节芒(Miscanthusfloridulus(Labnll.)Warb)73% 麸皮25%,石灰2%,含水量60%。
红象草(Pennisetumpurpureumred‘Red’)、甜玉米(ZeamaysL.)秸秆和葛藤(Puerarialobata(Willd.)Ohwi.)原料由泉头牧草基地种植,甘蔗(Saccharumofficinarum)梢由市场购买的果蔗取末梢2~3节。
1.2 绿汁发酵液的制作
2015年7月20日红象草(Red elephant grass,PEG)、甜玉米秸秆(corn stalk,CS)、菌糠(mushroom residue,MB)、葛藤(kudzu,K)和甘蔗梢(sugarcane top,SC)。绿汁发酵液的制备参照Bureenok等报道的方法[8]。每个材料制备3瓶绿汁发酵液,即3个重复。
1.3 菌糠青贮饲料的制作
将采集到的菌棒破膜、捣碎、混合均匀。称取18份500 g菌糠原料,分别装入30 cm×45 cm自封袋中,试验自封袋贴好标签,分别均匀喷洒前期制作的五种绿汁发酵液(每种3个重复,共15份),添加量为2 mL·kg-1绿汁发酵液+ 8 mL·kg-1蒸馏水,3份对照组处理喷洒等体积的蒸馏水,再充分混匀后装入青贮袋中,抽真空、封口。放置室温,发酵30开封。对照组和五种添加剂处理共6个处理18份,即每个处理3重复。
1.4 原料特性及发酵品质的测定
原料分析样本按常规方法测定水分和粗蛋白质含量[9];缓冲能的测定采用盐酸、氢氧化钠滴定法[10];中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量的测定参照Van Soest方法[11],半纤维素(hemicellulose,HC)=中性洗涤纤维-酸性洗涤纤维。可溶性碳水化合物(water soluble-carbohydrates,WSC)含量是用比色法[12]测定的。
分别采用MRS琼脂培养基(MRS agar medium,MRS)、营养琼脂培养基(Nutrient Agar,NA)计数发酵液上的乳酸菌。乳酸菌用厌氧箱(YQX-Ⅱ型,上海新苗),37℃培养2 d。
青贮料开封后,搅拌均匀,每个样本称20 g放入聚乙烯塑料封口袋中,加入80 mL蒸馏水,放置4℃冰箱浸泡18 h后离心,用pH计(pH计:pHS-3B,上海鹏顺科学仪器有限公司)测上清液的pH值;准确量取10 mL上清液,采用凯氏定氮仪测定氨态氮(NH3-N)含量[9];采用岛津LC-20AT型高效液相色谱仪测定乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、丙酸(propionic acid,PA)和丁酸(butyrate acid,BA)含量。
WSC、NDF、ADF、HC、CP、LA、AA、PA和BA含量以干物质基础的百分比表示。
1.5 绿汁发酵微生物菌群分析
1.5.1绿汁发酵液总微生物菌体的收集将制备好的绿汁发酵液,摇匀后,取40 mL到灭菌后的离心管,1 000 rpm离心5 min,取上清液到另一只干净的无菌管,12 000 rpm离心5 min,收集菌体沉淀。
1.5.2细菌基因组DNA的提取 每个菌体样品按照FastDNA® SPIN Kit for Soil (MP Biomedicals,Santa Ana,CA,美国)试剂盒的说明,进行发酵液总细菌基因组DNA的提取,并用紫外分光光度计检测其浓度和纯度。采用0.8%琼脂糖凝胶电泳检测DNA完整性。
1.5.316S rDNA的扩增和测序 使用上述提取的总DNA作为PCR的模板,利用特异性的引物对338F和 806R扩增细菌 16S rDNA基因序列高变区V3~V4区,同时在前引物 5’端添加Barcode序列区分样品[13]。每个样品 3次重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱,1.5%琼脂糖凝胶电泳检测。16S rRNA基因测序文库构建和Illumina Miseq测序由广州基迪奥生物科技有限公司完成。
1.6 数据统计分析
1.6.1生物信息学分析 序列分析由QIIME软件包和UPARSE pipeline完成。首先原始序列通过QIIME的默认参数过滤掉低质量的序列;然后利用UPARSE软件生成OTU(Operational Taxonomic Units)(序列相似度≥97%),利用RDP从每个OTU中选择一条序列作为OTU代表;根据获得的OTU数据,以测序样本的序列数为横坐标,OTU值作为纵坐标绘出每个样品的稀释曲线,同时根据样本中所共有和独有的OTU数目作OTU分布图。稀释曲线及α-多样性的Chao指数和Shannon指数等生物多样性指数由mothur软件平台(version v. 1. 30. 1,http:/ /www. Mothur. org /wiki /Schloss _ SOP # Alpha _diversity)完成。热图(Heatmap)、主成分分析图(PCA) 和冗余分析(RDA)采用R语言相关软件包进行分析作图。
1.6.2青贮数据统计分析 用Excel对数据进行整理,采用SPSS 17.0软件对数据进行方差分析,采用Duncan法对均值进行多重比较,对材料特性进行分析。
2 结果与分析
2.1 五种原料的化学成分及微生物组成
五种原料的化学成分及微生物组成见表1。菌糠的干物质含量和粗脂肪含量显著高于(P<0.05)其他4种原料,缓存能和半纤维素含量显著(P<0.05)低于其他4种原料;葛藤pH值、缓冲能、粗蛋白含量显著(P<0.05)高于其他4种原料,可溶性碳水化合物显著(P<0.05)低于其他4种原料;甘蔗梢的半纤维素含量显著(P<0.05)高于其他4种原料,粗脂肪含量显著(P<0.05)低于其他4种原料;玉米秸秆和甘蔗梢的可溶性碳水化合物显著(P<0.05)高于其他3种原料。5种原料微生物总量中,菌糠的乳酸菌、好气性细菌、酵母菌和霉菌的数量显著(P<0.05)低于其他4种原料。

表1 五种原料的化学成分及微生物组成Table 1 The chemical and microorganism composition of five materials
注:同行不同字母表示差异显著(P<0.05);下同
Note:Different lowercase letter in the same column indicated significant difference at the 0.05 level,the same as below
2.2 五种绿汁发酵液中的微生物OTU alpha多样性分析
2.2.1五种绿汁发酵液中的多样性指数分析 如图1所示,Shannon稀释曲线显示曲线已经趋于平坦,其覆盖度均达到96%以上(表2),表明样本测序量已经饱和,足够反映样本中绝大部分细菌物种的信息。基于OTU的结果,计算样品的alpha丰富程度,葛藤和甘蔗梢绿汁发酵液的OTU数量,葛藤绿汁发酵液的Chao1和ACE值显著(P<0.05)高于玉米秸杆、红象草和菌糠绿汁发酵液,葛藤和菌糠绿汁发酵液的Shannon值和npShannon值显著高于玉米秸秆和甘蔗梢绿汁发酵液,玉米秸秆和甘蔗梢的Simpson值显著高于葛藤、红象草和菌糠绿汁发酵液(表2)。葛藤绿汁发酵液的Chao1、ACE、Shannon和npShannon指数等指标上均处在较高的水平,Simpson指数处在较低水平,说明葛藤绿汁发酵液的菌群数量较大,多样性水平也相对较高。

图1 样品的shannon稀释曲线图Fig.1 Multy samples Shannon-wlener Curves注:corn,玉米秸秆;kudzu,葛藤;PEG,红象草;MB,菌糠;SC,甘蔗梢;1,2,3,表示样品的3个重复;下同Note:PEG,red elephant grass;MB,mushroom bran;SC,sugarcane;1,2,3 means three duplicates of the samples;The same as follow
表2 五种绿汁发酵液Alpha丰富程度表Table 2 The alpha diversity of five fermented juice of epiphytic lactic acid bacteria

Number of OTUschao1ACEShannonnpShannonSimpsonCoverageCorn2711.33±58.18b6203.19±637.79c9622.11±943.20bc3.42±0.20c3.59±0.20c0.15±0.03a0.97Kudzu3580.67±74.14a7712.72±84.41a11865.80±303.76a4.02±0.25a4.19±0.27a0.10±0.02b0.96PEG2766.00±507.71b6258.08±1093.10bc9501.77±1573.24b3.86±0.09ab4.01±0.10ab0.09±0.02b0.97MB2877.33±230.97b6312.08±507.62bc9778.15±325.20b4.04±0.10a4.21±0.10a0.08±0.00b0.96SC3449.67±126.23a7405.40±37.40ab11128.47±146.83ab3.60±0.13bc3.77±0.12bc0.17±0.03a0.97F7.404.194.698.047.5810.02P0.010.030.020.000.000.00
2.2.2五种绿汁发酵液中微生物多样性主成分分析 五种绿汁发酵液15个样品的主成分分析见图2。三个重复的样品点聚集在一起,表示三个样品重复性好。PC1的贡献率为30.7%,PC2的贡献率为25.9%。根据主成分分析,五组样品大致可分为三类,红象草和菌糠绿汁发酵液两组样品分别落在第一和第四象限,和其他组样品的距离相对较远,单独一类,甘蔗梢和玉米秸秆绿汁发酵液两组样品落在第二象限,葛藤落第三象限,三组样品均分布在X轴附近,距离较近,归类为一类。

图2 样品的PCA图(OTU水平)Fig.2 Principal component analysis of microbial community of the samples (OUT level)
2.2.3五种绿汁发酵液中微生物多样性热图分析 根据OTU的表达谱数据,使用热图来展示不同的OTU在各样品间的表达变化情况,同时可以根据热图上的聚类关系,也可以反应样本关系。因为OTU的数目较多,且多数OTU丰度都很低(包含tags数量为1),所以我们使用OTU至少在一个样本中包含tags数量达到总tags数量的0.1%作为阈值,对满足该条件的OTU进行热图分析。图3中五种绿汁发酵液的热图明显呈现出五种原料微生物优势菌株的差异性。五种绿汁发酵液的3个重复均能较好的聚集在一起,说明样品的重复性较好。玉米秸秆和甘蔗梢绿汁发酵液首先聚为一类,说明其二者菌群相似度较高,之后再与葛藤聚为一类;红象草和菌糠绿汁发酵液单独聚为一类。
2.2.4五种绿汁发酵液中物种分类树展示 根据物种的分类表达谱的数据,选取丰度较高的部分物种分类单元,我们做出了物种分类树的展示图。饼图中不同的颜色的区域代表不同的样品在该分类单元上的比率,半径的大小代表该分类单元所包含的tag数占总tag的比例,半径越大代表丰度越高,饼图旁边的百分比代表该分类单元的tag数占总tag数的百分比。
如图4所示,绿汁发酵液微生物为细菌(99.804%),主要为变形菌门(proteobacteria)(60.735%)的γ-变形菌纲Gamaproteobacteria(58.993%)和厚壁菌门(Firmicutes)(38.666%)的杆菌纲(Bacilli)(38.662%)。γ-变形菌纲主要是假单胞菌目(Pseudomonadales)(13.861%)下假单胞细菌科(Pseudomonadaceae)(13.475%)的假单胞属(Pseudomonas)(11.952%)和肠杆菌目(Enterobacteriales)(43.846%)下肠杆菌科(Enterobacteriaceae)(43.846%)的欧文氏菌属(Erwinia)(7.556%)、克雷白氏杆菌属(Klebslella)(12.128%)、沙雷氏菌属(Serratia)(11.952%)、柠檬酸细菌属(Citobacter)(1.467%)、沙门氏菌(Salmenella)(6.450%)和肠杆菌属(Enterobacter)(0.303%);杆菌纲主要是杆菌目(Lactobacillales)(38.075%)明串珠菌科(Leuconostocaceae) 的明串珠菌属(Leuconostoc)(30.751%)和魏斯氏菌属(Weissella)(1.45%),以及链球菌科(Streptococcaceae)(7.153%)的乳球菌属Lactococcus(7.117%)。其中玉米秸秆绿汁发酵液中克雷白氏杆菌属和明串珠菌属比例较高,菌糠绿汁发酵液中柠檬酸细菌属、沙门氏菌和肠杆菌属比例较高,葛藤和红香草绿汁发酵液中乳球菌属比例较高,另外葛藤绿汁发酵液中肠杆菌属比例较高。
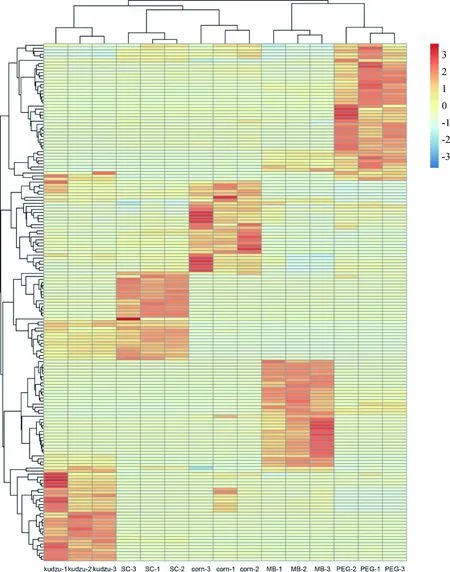
图3 样品OTU表达谱热图Fig.3 OTU heat map of samples
图4 样品菌群的发育树Fig.4 Species classification tree of samples
2.3 不同水平下微生物群落结构分析
2.3.1基于目水平的微生物群落结构分析 五种绿汁发酵液基于目水平下的微生物群落结构见图5(丰度>1%)。图5显示了15个样本共鉴定出60个目,丰度大于1%的目只有4个,总丰度分别占98.47%(玉米秸秆),97.43%(葛藤),97.15%(红象草),96.82%(菌糠)和96.07%(甘蔗梢),其中乳酸杆菌目(Lactobacillales)、肠杆菌目(Enterobacteriales)和假单胞菌目(Pseudomonadales)为优势菌目,伯克霍尔德氏菌目(Burkholderiales)在各组样品中占的比例较低,另外还有一些无类别的(Unclassified)和其他(Other)细菌。不同原料所制得绿汁发酵液目水平的微生物分布比例差异明显。玉米秸秆和红象草绿汁发酵液中优势菌目为肠杆菌目和乳酸杆菌目,分别占48.34%和35.73%;葛藤绿汁发酵液中乳酸杆菌目、肠杆菌目和假单胞菌目三者为优势菌目,分别占35.52%、31.50%和29.61%;菌糠绿汁发酵液中优势菌目为肠杆菌目,占71.48%;甘蔗梢绿汁发酵液中优势菌目为乳酸杆菌目,占59.07%,另外肠杆菌目其占25.89%。

图5 基于目水平的样本微生物群落结构Fig.5 Microbial community structure of sample on the order level注:堆叠图展示至少在一个样本中的表达丰度达到1%的物种,达不到1%的物种统一归类到Other类别中去,无法注释到该水平的tags则被归类到Unclassified类别中去;下同Note:The stack diagram shows the species that expression abundance reached 1%,the species less than 1% were classified into Other categories,the tags unable to comment are classified into the Unclassified category;The same as below
2.4.2基于科水平的微生物群落结构分析 五种绿汁发酵液基于科水平下的微生物群落结构见图6(丰度>1%)。图6显示了15个样本共鉴定出90个科,丰度大于1%的科只有4个,分别为明串珠菌科(Leuconostocaceae)、肠杆菌科(Enterobacteriaceae)、假单胞菌科(Pseudomonadaceae)和链球菌科(Streptococcaceae),另外还有一些无类别的(Unclassified)和其他(Other)细菌。4个科的菌总丰度分别为97.41%(玉米秸秆),95.61%(葛藤),95.89%(红象草),94.54%(菌糠)和93.28%(甘蔗梢)。不同原料所制得绿汁发酵液不同科水平的微生物分布比例有明显差异。玉米秸秆绿汁发酵液中优势菌科为明串珠菌科和肠杆菌科,分别占32.86%和48.34%;葛藤绿汁发酵液中明串珠菌科、肠杆菌科和假单胞菌科三者为优势菌目,分别占34.70%、31.50%和28.90%;红象草和菌糠绿汁发酵液中肠杆菌科为优势菌科,分别占53.02%和71.48%;甘蔗梢绿汁发酵液中优势菌目为明串珠菌科,占59.07%,另外肠杆菌目其占25.89%。

图6 基于科水平的样本微生物群落结构Fig.6 Microbial community structure of sample on the family level
2.4.3基于属水平的微生物群落结构分析 五种绿汁发酵液基于属水平下的微生物群落结构见图7(丰度>1%)。图7显示了15个样本共鉴定出129个属,丰度大于1%的属有9个,分别为明串珠菌属(Leuconostoc)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、柠檬酸杆菌属(Citrobacter)、欧文氏菌属(Erwinia)、克雷白氏杆菌属(Klebsiella)、沙门氏菌属(Salmonella)、沙雷氏菌属(Serratia)和假单胞菌属(Pseudomonas),另外还有一些无类别的(Unclassified)和其他(Other)细菌。9个属菌总丰度分别为85.40%(玉米秸秆),60.15%(葛藤),77.74%(红象草),72.68%(菌糠)和42.31%(甘蔗梢),葛藤和甘蔗梢绿汁发酵液中含有较大比例无法注释的菌属。不同原料所制得绿汁发酵液菌属种类和分布比例有显著差异。在可注释的这些菌属中,玉米秸秆绿汁发酵液中优势菌属为明串珠菌属(29.81%)、克雷白氏杆菌属(31.96%)和假单胞菌属(11.85%),另外,与青贮相关的乳球菌属占2.75%;葛藤绿汁发酵液中优势菌属为假单胞菌属(26.82%),明串珠菌属(6.97%)、魏斯氏菌属(2.21%)和沙门氏菌属(1.80%);红象草绿汁发酵液中乳球菌属(28.12%)和沙雷氏菌属(23.08%)为优势菌属,另外,与青贮相关的明串珠菌属占10.17%;菌糠绿汁发酵液优势菌属为沙门氏菌属占31.71%,另外,与青贮相关的明串珠菌属占6.09%;甘蔗梢绿汁发酵液中50%以上菌属无法注释,含有与青贮相关的菌属有明串珠菌属(9.43%)、乳球菌属(3.44%)和魏斯氏菌属(2.71%)。
2.4 五种绿汁发酵液对菌糠发酵品质的影响
2.4.1五种绿汁发酵液对菌糠发酵料干物质、氨态氮和pH的影响 五种绿汁发酵液对菌糠干物质、氨态氮和pH的影响见图8。各处理组干物质含量与对照组相比无显著差异(P>0.05),菌糠绿汁发酵液处理组的干物质含量显著(P<0.05)高于红象草、葛藤和甘蔗梢绿汁发酵液组;与对照组相比,菌糠绿汁发酵液处理组的氨态氮含量显著(P<0.05)降低;与对照组相比,五种绿汁发酵液组的pH显著(P<0.05)降低,红象草绿汁发酵液处理组的pH显著(P<0.05)低于其他处理组。
2.4.2五种绿汁发酵液对菌糠发酵料有机酸的影响 五种绿汁发酵液对菌糠发酵料有机酸的影响见图9。与对照组相比,五种绿汁发酵液处理组青贮料的乳酸含量显著(P<0.05)升高,丁酸含量显著(P<0.05)降低;除红象草绿汁发酵液处理组外,其他四种绿汁发酵液处理组的乙酸含量显著(P<0.05)降低;红象草绿汁发酵液处理组的丙酸含量显著(P<0.05)降低。
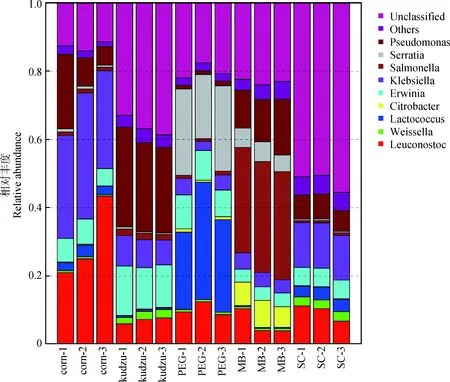
图7 基于属水平的样本微生物群落结构Fig.7 Microbial community structure of sample on the genus level

图8 五种绿汁发酵液对干物质含量、氨态氮含量和pH值的影响Fig.8 The effect of five fermented juice of epiphytic lactic acid bacteria on dry matter content,ammonia-N content and pH value注:CK,对照组;PEG,红象草绿汁发酵液处理组;Corn,玉米绿汁发酵液处理组;MB,菌糠绿汁发酵液处理组;Kudzu,葛藤绿汁发酵液处理组;SC,甘蔗梢绿汁发酵液处理组;不同字母表示差异显著(P<0.05);下同Note:CK,control;PEG,adding red elephant grass fermented juice of epiphytic lactic acid bacteria (FJLB) group;MB,adding mushroom bran FJLB group;Kudzu,adding kudzu FJLB group;SC,adding sugarcane FJLB group;Different lowercase letter indicated significant difference at the 0.05 level (P<0.05);The same as below
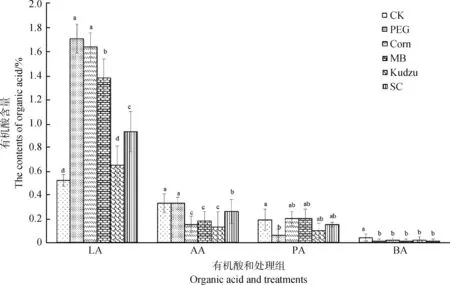
图9 五种绿汁发酵液对有机酸的影响Fig.9 The effect of five fermented juice of epiphytic LAB on the contents of organic acid
2.5 冗余分析
采用冗余分析绿汁发酵液乳酸菌菌属与青贮发酵产物的相关性等结果见图10。pH、氨态氮坐落在第一现象,与分布在第一象限的肠球菌属、魏斯氏菌属和乳杆菌属呈锐角,为正相关;丁酸在第二象限,与分布在第二象限和第三现象的片球菌属和明串珠菌属呈锐角,为正相关,且射线较长,相关系数较高;乳酸和乙酸在第三象限,与分布在第三象限的明串珠菌属、Y轴负半轴的链球菌属和第四象限的乳球菌属呈正相关,且相关系数较高;干物质和丙酸分布在第四象限,与Y轴负半轴的链球菌属和第四象限的乳球菌属呈正相关,且相关系数较高。
采用冗余分析绿汁发酵液乳酸菌菌种与青贮发酵产物的相关性等结果见图11。肠系膜明串珠菌(Leuconostocmesenteroides)和无乳链球菌(Streptococcusagalactiae)的射线最长,对青贮有机酸的影响最大。丁酸和乳酸在第一象限,与肠系膜明串珠菌呈锐角,为正相关;氨态氮在第二象限,靠近X轴负半轴,与附近的嗜酸球菌(Pedococcusacidilactici)、干酪肠球菌(Enterococcuscasselillvus)、细辛肠球菌(Enterococcusasini)、短乳杆菌(Lactobacillusbrevis)、葡萄魏氏菌(Weissellaviridescens)和格氏乳球菌(Lactococcusgarviease)呈锐角,为正相关;pH在第三现象,与第三象限上的嗜酸球菌、干酪肠球菌、细辛肠球菌、短乳杆菌、葡萄魏氏菌、硫肠球菌(Enterococcussulfureus)和格氏乳球菌呈锐角,为正相关;干物质、乙酸和丙酸在第四象限,与无乳链球菌呈锐角,为正相关。

图10 属水平上的RDA分析Fig.10 RDA analysis on the genus level

图11 种水平上的RDA分析Fig.11 RDA analysis on the specie level
3 讨论
青贮主要是利用原来中的乳酸菌进行厌氧发酵,使的青贮料成为一个酸性环境,而酸性环境能够有效抑制有害微生物的生长繁殖,从而保存原料的营养物质[14-17]。许多原料附生的乳酸菌数量较少,添加乳酸菌制剂是人工扩大青贮原料中乳酸菌群体的有效方法[18-19]。本次试验结果表明,试验原料菌糠中的乳酸菌数量较少,仅2.23 lg cfu·g-1FM。一般来说,使乳酸菌迅速增殖并占主导地位的原料中,乳酸菌的有效浓度以105·g-1鲜草为标准值[20]。本试验菌糠原料远低于这个标准值,因此必须采用人工添加乳酸菌制剂的方法进行发酵。绿汁发酵液是人工制成的一种新型的纯天然的青贮添加剂。Naoki[4],Ohshima[21]等报道在青贮料中添加绿汁发酵液可以迅速降低青贮料的pH值,提高乳酸含量,抑制梭菌活动,减少蛋白损失,且其添加效果不受青贮原料、收获季节、生育期、干物质含量及青贮条件影响,其青贮效果较好。郑丹等[22]表明,添加绿汁发酵液后促进同质乳酸菌的发酵,有效地抑制了丁酸菌及其他有害微生物活性,减少了蛋白质的分解,提高了乳酸菌对水溶性碳水化合物的利用效率及杂交狼尾草青贮发酵品质。本试验也获得相似结果,五种绿汁发酵液能够有效的改善菌糠的发酵品质,提高菌糠青贮料的乳酸含量,降低了其pH值、乙酸含量和丁酸的含量。这与Shao[23]在黑麦草中,许庆芳[24]等在苜蓿中,叶杭等[25]香蕉叶中添加绿汁发酵液的效果相似。
绿汁发酵液其实质是人工培养法对原料表面附生的乳酸菌在无氧条件下进行自然富集,因此可作为乳酸菌菌剂的替代物。Cai等报道[26],与青贮密切相关的乳酸菌主要是乳杆菌属(Lactobacillus),片球菌属(Pediococcus),肠球菌属(Enterococcus),明串珠菌属(Leuconostoc),乳球菌属(Lactococcus),链球菌属(Streptococcus),魏斯特菌属(Weissella)。这些菌属中的菌株能够在厌氧条件下,进行乳酸发酵,产生乳酸,降低青贮料的pH值,从而抑制一些需氧的不良细菌的生长繁殖,保存青贮料的营养物质。本试验对菌属与青贮发酵品质进行关联性分析的冗余分析结果中射线较长,与菌糠青贮发酵关系较大的是菌属为片球菌属、明串珠菌属、链球菌属和乳球菌属。高通量测序结果中,玉米秸秆绿汁发酵、葛藤绿汁发酵液、红象草绿汁发酵液、菌糠绿汁发酵液和甘蔗梢绿汁发酵液中相关的菌株占得比例为32.56%(明串珠菌属29.81%和乳球菌属2.75%)、9.18%(明串珠菌属6.97%和魏斯氏菌属2.21%)、38.29%(乳球菌属28.12%和明串珠菌属10.17%)、6.09%(明串珠菌属6.09%)和15.58%(明串珠菌属9.43%、乳球菌属3.44%和魏斯氏菌属2.71%),这个结果中红象草绿汁发酵液中与青贮有关的乳酸菌属占的比例最高,在红象草绿汁发酵液液中占据了绝对优势的比例,这应该是其在6个处理组中获得最低pH值和最高的乳酸含量,效果最佳的主要原因。绿汁发酵液中含有许多有其他菌属的细菌,其中欧文氏菌属为兼性好气菌,代谢为呼吸型或发酵型,pH值5.3~9.2均可生长,最适pH值 7.2;克雷白氏菌属为兼气性厌氧菌,若pH值低于6.0或高于8.0则生长缓慢;沙门氏菌,为兼性厌氧,最佳pH值为6.5~7.5;沙雷氏菌属为兼性厌氧,几乎所有的菌株能在pH 5~9下生长[27]。这些菌株均为兼性厌氧,在发酵初期会与青贮相关的乳酸菌进行竞争,只有当青贮料的pH降到5.0以下时,其生长才被抑制,因此,这些菌占比例较大时,其添加效果就不稳定,具体体现在玉米秸秆绿汁发酵液中,其与青贮有关的乳酸菌占32.56%的比例,但仅克雷白氏杆菌属占31.96%,因此无法突出乳酸菌优势菌群的效果。而假单胞菌属,这些菌专性需氧的革兰氏染色阴性无芽胞、有荚膜杆菌,不发酵糖类,pH值低于5.0或高于9.0则基本不生长[27],因此其对青贮发酵影响不大,并且这些菌属许多为专性需氧菌,在厌氧条件下其生长被抑制[28],而与青贮相关的乳酸菌为厌氧菌,在厌氧的条件的,能够迅速生长繁殖,迅速提高其在发酵料中的的比例,正面影响青贮发酵进程。这可能就是葛藤绿汁发酵液中,虽然假单胞菌属占最高比例,是葛藤绿汁发酵液的优势菌,但葛藤绿汁发酵液的添加效果却仅次于红象草绿汁发酵液的原因。近年来,一些报道表示绿汁发酵液的使用存在不稳定,通过本试验结果可表明,其主要原因是其中与青贮相关的乳酸菌属所占比例较低,其他兼性厌氧菌属占比例较高造成的。冗余分析的结果也证明,正是这些菌属的不同,造成青贮品质的差异。本试验中,在绿汁发酵液中,嗜酸球菌、干酪肠球菌、细辛肠球菌、短乳杆菌、葡萄魏氏菌和格氏乳球菌等菌株与青贮料的pH值和氨态氮有密切的相关性,这些菌株在乳酸菌商品添加剂中较为常用的菌株,已经有较肯定的效果,然而肠系膜明串珠菌和无乳链球菌与对青贮发酵产物中的乳酸、乙酸、丙酸和丁酸的产生有较大的相关性,目前对这两株菌在青贮的的应用研究较少报道,需进一步深入研究。
4 结论
5种绿汁发酵液均能够显著提高青贮料的乳酸含量,显著降低青贮料的丁酸含量,提高菌糠青贮料的发酵品质。不同原料制备的绿汁发酵中微生物种群分布有明显差异,在青贮发酵中,效果不完全不同。本试验五种绿汁发酵液中,红象草绿汁发酵液与青贮相关的乳酸菌比例最高,在6个处理组中获得最低pH值和最高的乳酸含量,效果最佳。通过Miseq高通量测序技术分析,能够清楚的解析绿汁发酵液中微生物的分布情况,阐明绿汁发酵液中微生物的分布与青贮料品质的关系。

