半乳糖凝集素-3在桥本甲状腺炎小鼠子宫内膜的表达
李 莉,樊 华,夏 琴,柳田田,程 锦,朱德发
桥本甲状腺炎(Hashimoto′s thyroiditis,HT)又被称为慢性淋巴细胞性甲状腺炎,是一种逐年高发的自身免疫性甲状腺疾病,多见于女性。近年来研究[1]发现HT可引起女性不孕。不孕是由多种因素综合作用的结果,有文献[2]指出妊娠期间子宫内膜容受性降低是女性不孕的因素之一。稳定的子宫内膜容受性能够促进胚胎与内膜的相互作用,利于胚胎着床。半乳糖凝集素-3(galectin-3)是一种通过其糖识别域识别细胞表面糖蛋白、糖脂和β半乳糖苷结构并与其结合的蛋白质,是半乳糖凝集素家族中的一员[3]。有研究[4]表明galectin-3可在子宫内膜着床窗口期能够调节子宫内膜的容受性,改善内膜细胞间粘附能力,增强胚胎对子宫内膜的植入,从而参与生殖过程。galectin-3在子宫内膜中的表达具有时空特异性,主要参与到人月经周期分泌中晚期、小鼠动情期以及胚泡种植的过程中[4-5]。有研究[6]发现小鼠动情期是一关键时期,在此期内能够进行排卵,与妊娠关系密切。对于galectin-3有利于妊娠并维持其过程的原因,有研究[7]表明在于此蛋白能调节机体免疫机制的平衡。目前,关于galectin-3在桥本小鼠妊娠准备阶段子宫内膜的表达情况在国内报道较少见。该研究选取未妊娠的NOD雌鼠,旨在观察对照组和桥本组小鼠子宫内膜动情周期galectin-3的表达水平,为进一步探讨HT引起女性不孕的机制提供相关的实验依据。
1 材料与方法
1.1实验动物取8~9周龄清洁级健康NOD雌性小鼠64只,20~23 g,购自北京华阜康生物科技有限公司,于安徽医科大学毒理实验室动物标准饲养条件下饲养,保证室温20~24 ℃,湿度40%~60%,实验过程遵循《安徽医科大学实验动物管理和使用指南》。
1.2主要试剂及仪器猪甲状腺球蛋白(porcine thyroglobulin,pTg)、完全弗氏佐剂(complete Freund′s adjuvant,CFA)、不完全弗氏佐剂(incomplete Freund′s adjuvant,IFA)均购自美国Sigma公司;三碘甲状腺原氨酸(triiodothyronine,T3)试剂盒、四碘甲状腺原氨酸 (tetraiodothyronine,T4)试剂盒、甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)、甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)试剂盒均购自德国Roche公司;ELISA试剂盒(USCNLIFE、CEA463Mu);瑞氏染色液(南京建成科技有限公司);苏木精-伊红染色试剂盒(上海科汇生物技术有限公司);兔抗鼠galectin-3多克隆抗体(美国Abcam公司);免疫组化化学染色试剂盒(北京中杉金桥生物技术有限公司);DAB显色试剂盒(北京中杉金桥公司);普通PCR仪(杭州晶格科学仪器有限公司);高速台式冷冻离心机(安徽嘉文仪器装备有限公司);荧光定量PCR仪、逆转录试剂盒(美国Thermo Scientific 公司);细胞因子试剂盒、BD FAC-SCalibur流式细胞仪(美国BD公司);荧光显微镜(日本Olympus公司);形态学图像分析系统(Image-ProPLus 6.0,美国MEDIA CYBERNETICS公司)。
1.3动物模型制备NOD雌性小鼠适应性喂养1周后,随机分为2组:正常对照组(CON组)、桥本甲状腺炎组(HT组),每组各32只。HT组造模步骤:将25 μg pTg溶于100 μl PBS溶液中,随后CFA与pTg溶液按1 ∶1混于研钵中,在冰浴条件下研磨成“油包水”状,即完全乳化。再用注射器抽取制备好的乳状剂,固定好小鼠,在小鼠尾根部1 cm处皮下注射,每只0.1 ml。对照组注射等量不含pTg的CFA。第14天将模型组的CFA替换成IFA制备成乳液,操作方法同前,对照组注射等量不含pTg的IFA。造模周期为49 d。实验经由安徽医科大学伦理委员会审核批准。
1.4方法
1.4.1动情周期确定 小鼠动情周期分为动情前期、动情期、动情后期、动情间期,周期为4~5 d,每只小鼠每日动情时期各不相同,为保证CON、HT两组小鼠处死时的动情各期数量相当(均为8只),故采取1周内进行小鼠阴道脱落细胞瑞氏染色涂片,当日做完涂片确定所处时期后立即静脉取血、颈椎脱臼法处死小鼠。
1.4.2血清甲状腺激素水平测定 下腔静脉取血1 ml,3 000 r/min离心10 min,分离血清,于4 ℃冰箱保存。电化学发光免疫分析法检测血清T3、T4、TgAb、TPOAb,ELISA法检测血清促甲状腺激素(thyrotropin,TSH)。
1.4.3标本制备 取血后小鼠立即颈椎脱臼处死,于冰台迅速暴露小鼠腹腔“Y”形子宫,完整取出后于子宫“Y”形中间分叉处剪断,将左半边子宫于4%多聚甲醛中固定24 h,石蜡包埋,矢状位连续切片,片厚5 μm,用于HE染色、免疫组化染色;右半边子宫浸泡于4%多聚甲醛溶液中固定,待做组织匀浆用于子宫局部细胞因子检测。
1.4.4HE染色 通过小鼠阴道脱落细胞瑞氏染色确定小鼠动情周期后再结合HE染色法观察动情各期小鼠子宫内膜的形态及腺体变化。将子宫切片经脱蜡、复水后,苏木精染料染色20 min,盐酸乙醇分色、蓝化后伊红染料染色10 s,再经脱水、透明后烘干封片。光学显微镜下拍摄图片。
1.4.5免疫组织化学染色 小鼠子宫蜡片置于60 ℃烤箱30 min,二甲苯脱蜡3次,每次15 min,梯度乙醇水化;TritonX-100细胞通透,30%过氧化氢阻断内源性过氧化物酶;柠檬酸盐微波炉加热暴露抗原决定簇;山羊血清封闭;以上各步骤间使用PBS洗涤3次,每次3 min。galectin-3抗体(1 ∶50)室温孵育1 h后孵育过夜(4 ℃);HRP标记山羊抗兔IgG孵育30 min(37 ℃);以上各步骤间使用PBS洗涤5次,每次5 min;DAB显色,苏木精复染20 s,PBS返蓝10 min,常规脱水、透明、封片。每张切片镜下随机选取5个视野在同一放大倍数下(×400)进行观察,应用光学显微镜拍摄;运用IPP6.0图像分析软件分析免疫反应产物的光密度值,取平均光密度(average optical density,AOD)值。
1.4.6RT-PCR反应 每100 mg子宫标本中加入1 ml TRIzol提取RNA后,进行分离、沉淀、洗涤溶解后于-80 ℃保存;在0.2 ml EP管中,加入总RNA(质量为1 μg)、10 μmol/L Oligo(dT)1 μl、DEPC水补足至12 μl,进行离心、加热、水浴;在上述EP管中加入5×Reaction Buffer 4.0 μl、10 mmol/L dNTP Mix 2 μl、RibolockTMRnase inhibitor 1 μl、RevertAidTMM-MLV Reverse Transcniptase 1 μl于42 ℃加热60 min,70 ℃加热5 min;取出上述反应液,即为cDNA,-80 ℃保存备用;取出cDNA作为荧光定量模板,使用Thermo Scientific公司的RevertAid Reverse Transcniptase建立反应体系;进行目的基因扩增;galectin-3上游引物:5′-ACGCCATGATCTAAGCCAGA-3′;下游引物:5′-GCGATGGGTATCTCTCAGCC-3′。观察反应结果,进行产物分析。
1.4.7流式微球捕获技术(CBA法)检测细胞因子 将子宫组织匀浆后作为待测样品,准备好缓冲液等试剂,将白细胞介素-2(interleukin-2,IL-2)、白细胞介素-4(interleukin-4,IL-4)两种细胞因子标准品冻干粉转移到离心管中,用稀释液进行重悬、梯度稀释、混匀后将分装的捕获微球立即混匀并装入流式管中,标记为混合微球;各实验管中加入混合好的捕获微球50 μl,将标准管中加入上述梯度稀释好的标准品,样本管中加入50 μl待测样品,弃去上清液。所有管均室温避光孵育2 h,同时用流式仪器调校微球进行实验条件设置,清洗捕获微球/样本/标准品复合物,上机检测,进行数据分析。

2 结果
2.1小鼠血清甲状腺激素及抗体水平与CON组相比,HT组TgAb、TPOAb水平升高(P<0.05),T3、T4、TSH水平差异无统计学意义。见表1。
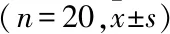
表1 各组小鼠T3、T4、TSH、TgAb、TPOAb水平
与CON组比较:*P<0.05
2.2小鼠子宫内膜动情期HE染色动情期是有利于小鼠交配的最关键时期,故选取两组小鼠动情期子宫内膜初步比较。光镜下显示:HT组较CON组,内膜增厚明显,腔上皮多呈分支绒毛状结构,固有层腺体多而大。见图1。
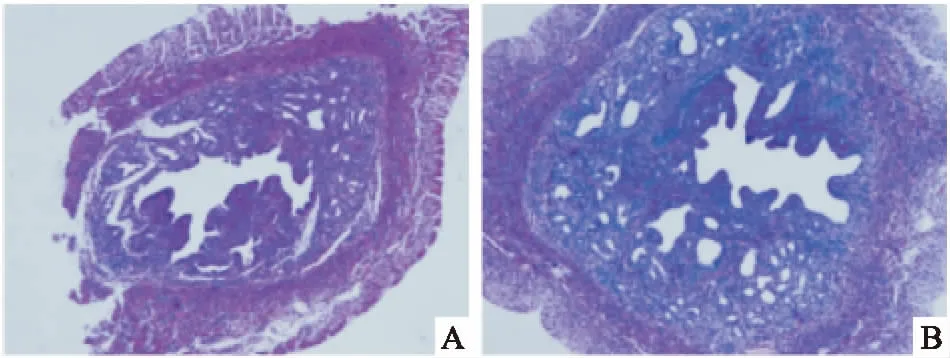
图1 两组小鼠子宫内膜动情期 HE×50A:CON组动情期;B:HT组动情期
2.3免疫组化光镜结果光镜下可见galectin-3在各动情周期小鼠子宫内膜组织中均有表达,呈棕黄色颗粒,主要分布于腔上皮、腺上皮胞质中,尤其是顶端面,间质细胞胞质中分布较少,各细胞核中则几乎无分布。见图2。
2.4免疫组化AOD值结果与CON组比较,HT组galectin-3的AOD值在动情期、动情后期降低(P<0.05),而在动情前期、动情间期的差异无统计学意义。见表2。
2.5RT-PCR结果与CON组比较,HT组galectin-3 mRNA在四期间的表达均降低(P<0.05),差异有统计学意义。见表3。
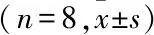
表2 两组小鼠动情周期免疫组化染色AOD值
与CON组比较:*P<0.05
表3 两组小鼠动情周期galectin-3 mRNA表达水平
与CON组比较:*P<0.05
2.6小鼠子宫组织细胞因子水平HT组IL-2水平(0.346±0.015)低于CON组(0.712±0.020)(P<0.05,t=14.461);IL-4水平(0.333±0.015)低于CON组(0.676±0.021)(P<0.05,t=13.333),差异有统计学意义。

图2 galectin-3在动情周期小鼠子宫内膜的表达 ×400A:CON组;B:HT组;1:动情前期;2:动情期;3:动情后期;4:动情间期
3 讨论
阴道涂片法是目前常用的小鼠动情周期判定方法之一,本实验先采用阴道脱落细胞瑞氏染色涂片法确定小鼠动情周期后,再结合HE染色法光镜下观察各期小鼠子宫内膜形态。宋婉玲 等[6]的研究表明,动情期是排卵并接受交配的最佳时期,此期内膜较其他三期明显变厚,故本实验直接选取CON组和HT组的动情期HE染色涂片进行观察。HE染色显示,HT组的子宫内膜肉眼较CON组变厚,腺体也较大而多,推测可能是由于造模成功导致桥本鼠子宫出现上述结果,具体机制尚不清楚。
免疫组化结果示,galectin-3主要表达于子宫内膜腔上皮、腺上皮和基质细胞细胞质,且腔上皮表达强于腺上皮与基质,这与Popovici et al[8]的文献报道一致。免疫组化法与RT-PCR法显示,HT组galectin-3表达在动情期较CON组降低,这提示动情期作为参与妊娠的关键时期,其出现可能有利于galectin-3的表达;同时提示HT组小鼠子宫内膜虽具有接受胚胎植入的能力,但其中galectin-3的低表达可能减弱了内膜基质细胞间的黏附作用,不利于维持妊娠。Quintino-Moro et al[1]在文中也提及HT女性患者可以受孕,但受孕概率较低。此外,免疫组化与PCR法显示,HT组galectin-3在动情后期表达低于CON组,而动情前、间期两组无差异,推测可能是由于galectin-3表达和性激素含量有关,而性激素的分泌受动情周期调控。Talebi et al[9]的研究表明,受精后动情后期雌激素水平开始降低,孕激素水平逐渐升至高峰。galectin-3含量受雌孕激素调控,且孕激素能够协同galectin-3表达增加[10];若未受精,后期黄体萎缩,孕激素开始退化[11]。这提示HT组的较低受孕率可能导致后期孕激素含量降低,促使galectin-3表达低于CON组。galectin-3 mRNA和蛋白质的表达谱在动情周期中的差异,可能是转录后调控使galectin-3蛋白的稳定性受到了影响,Yang et al[4]研究galectin-3在基因与蛋白水平的表达也不完全一致。
本实验HT小鼠是通过尾部皮下注射免疫球蛋白进行造模,对于HT组小鼠动情期蛋白的低表达推测可能与子宫局部的免疫状况相关。有报道[12-13]表明,IL-2、IL-4是免疫机制平衡中相对立的两种细胞因子。IL-2、IL-4在体内主要是由活化的T淋巴细胞产生,T淋巴细胞存在于机体各个器官,包括子宫组织,其中IL-2主要起促进炎症作用,IL-4主要起抵抗炎症作用[12-13]。本实验通过CBA法检测两组小鼠子宫局部IL-2、IL-4的水平。结果显示,HT组的IL-2、IL-4较对照组降低,提示HT小鼠体内的免疫机制可能发生失衡,并推测这可能与HT组小鼠galectin-3蛋白的低表达有关。Karlsson et al[14]的研究表明,galectin-3参与IL-2及中性粒细胞介导的炎症反应并在炎症病灶处大量产生,以清除炎症部位的炎性介质,减轻炎症反应。同时体外试验表明, galectin-3的消除可阻断IL-4的存活,减弱其抗炎的效应[15]。这提示了在本实验中,HT组小鼠内膜的galectin-3可能倾向于调节促炎与抗炎反应的稳定,维持免疫机制的平衡,使得自身水平处于不断变化之中。Kouo et al[7]的研究表明galectin-3可通过免疫调节改变机体免疫状态的平衡。
综上所述,HT小鼠子宫内膜galectin-3蛋白在不同周期均有表达,动情期升高明显,但较正常对照组降低,提示桥本小鼠可以妊娠,但在受精结合的关键环节即动情期可能受到影响。对于其妊娠受到影响的原因,推测可能与其子宫内膜局部细胞因子的改变有关。

