N-(4-丁酸甲酯)-4-羟基-1,8-萘酰亚胺葡萄糖醛酸苷的高效制备
白洪越,孔水仙,王 宇,侯熙彦,吕 侠*
(1.大连民族大学生命科学学院,生物技术与资源利用教育部重点实验室,辽宁 大连 116600;2.大连医科大学附属第二医院,辽宁 大连 116027)
尿苷二磷酸葡萄糖醛酸转移酶(UGTs)是人体重要的II相代谢酶,不仅肩负着大量外源物的代谢清除,同时还在维系机体内源性物质代谢平衡中发挥着重要作用[1]。很多药物、中草药及天然化合物可抑制或激活UGTs酶的活性,引起临床上不良的药物/草药-药物相互作用或导致内源性物质的代谢紊乱。荧光探针具有操作简便,生物样本需要量少,高通量等优点。N-(4-丁酸甲酯)-4-羟基-1,8-萘酰亚胺(NMHN)能够同时被多种UGTs亚型快速代谢,生成的代谢产物也具有较好的荧光属性,能够作为UGTs广谱荧光探针底物,同时快速检测多个UGTs亚型的活性[2]。再者生成的代谢产物也可作为β-葡萄糖醛酸苷酶的荧光探针底物用于β-葡萄糖醛酸苷酶的活性检测。因此迫切需要构建NMHNG的高效制备方法。与化学合成法相比,生物合成法制备葡萄糖醛酸苷产物具有产率高、副产物少、制备过程简单等优点[3]。本文利用牛肝微粒体能够高效催化NMHN发生葡萄糖醛酸化反应生成NMHNG,同时借助固相萃取柱实现了NMHNG的高效分离及纯化,获得了纯度大于98%的代谢产物。
1 实验部分
1.1 试剂与仪器
Bruker ARX 500 MHz 超导核磁共振波谱仪(瑞士Brucker公司);UPLC-UV-ESI-MS 高效液相色谱-串联质谱仪(日本岛津公司); Allegra X-30R高速冷冻离心机(美国克曼库尔特有限公司);MS-100恒温混匀仪(杭州奥盛仪器有限公司);Synergy H1 型全功能微孔板检测酶标仪(美国博腾仪器有限公司)。
三羟甲基氨基甲烷(Tris)、聚氧乙烯十六烷基醚(Brij58)、尿苷二磷酸葡萄糖醛酸钠盐(UDPGA)和MgCl2均购自Sigma公司;各种属肝微粒体均购自瑞德肝脏疾病研究有限公司; UniElut C18AEX阴离子固相萃取小柱购自华谱有限公司。
1.2 实验过程
1.2.1 NMHN葡萄糖醛酸化的种属差异
UGTs孵育体系的建立:在1.5 mL离心管中依次加入底物NMHN(终浓度500 μmol/ L)、各个种属肝微粒体(终浓度为0.5 mg/mL)、MgCl2(50 mmol/L)、Tris-HCl(50 mmol/L),于恒温混匀仪上预先孵育5 min,再加入UDPGA(40 mmol/ L)起始反应,反应6h后加入乙腈终止反应。4℃ 14770r/min 离心20 min后取上清液于UPLC-UV-ESI-MS分析不同属肝微粒体对NMHN生物转化率。
1.2.2 NMHNG的制备与鉴定
UGTs孵育体系的建立同上,使用猪肝微粒体制备NMHNG(转化率可达94.9%)。SPE柱由甲醇和水顺序洗脱活化,将混合上清液上样于SPE柱,依次用6mL超纯水、6mL甲醇和6mL 5%的甲酸甲醇顺序洗脱。收集含有代谢产物的馏份,旋转蒸干后,通过质谱和核磁共振波谱鉴定其结构。
2 结果与讨论
2.1 种属差异实验结果
NMHN在9种动物肝微粒体催化下均能发生葡萄糖醛酸化反应生成NMHNG,猴肝微粒体,大鼠肝微粒,小鼠肝微粒体,豚鼠肝微粒体,猪肝微粒体,狗肝微粒体,兔肝微粒体,牛肝微粒体和人肝微粒体的转化率分别为28.1%,73.9%,59.9%,87.7%,94.9%,64.9%,75.9%,90.9%,和43.5% .其中猪肝微粒体催化NMHN发生葡萄糖醛酸化反应的生物转化率最高,因此选择猪微粒体为酶源用于NMHNG的制备。
2.2 NMHNG的分离及纯化
由图1a可知,UGTs反应混合液中NMHNG的含量高于90%,但是仍有约10%的NMHN的存在。SPE柱分离纯化后,UGTs反应混合液中的NMHNG与NMHN及UGTs反应混合液中的其它杂质实现了快速较好的分离,获得了4.0 mg NMHNG,其纯度高于98%,实际产率高达80%。由图1b和1c所示,UPLC-UV-ESI-MS给出NMHN的准分子离子峰[M+H]+,m/z: 314.05,NMHNG的准分子离子峰[M+H]+,m/z: 490.10,NMHNG的分子量比NMHN的分子量增加了176,确定其为NMHN的但葡萄糖醛酸化产物。
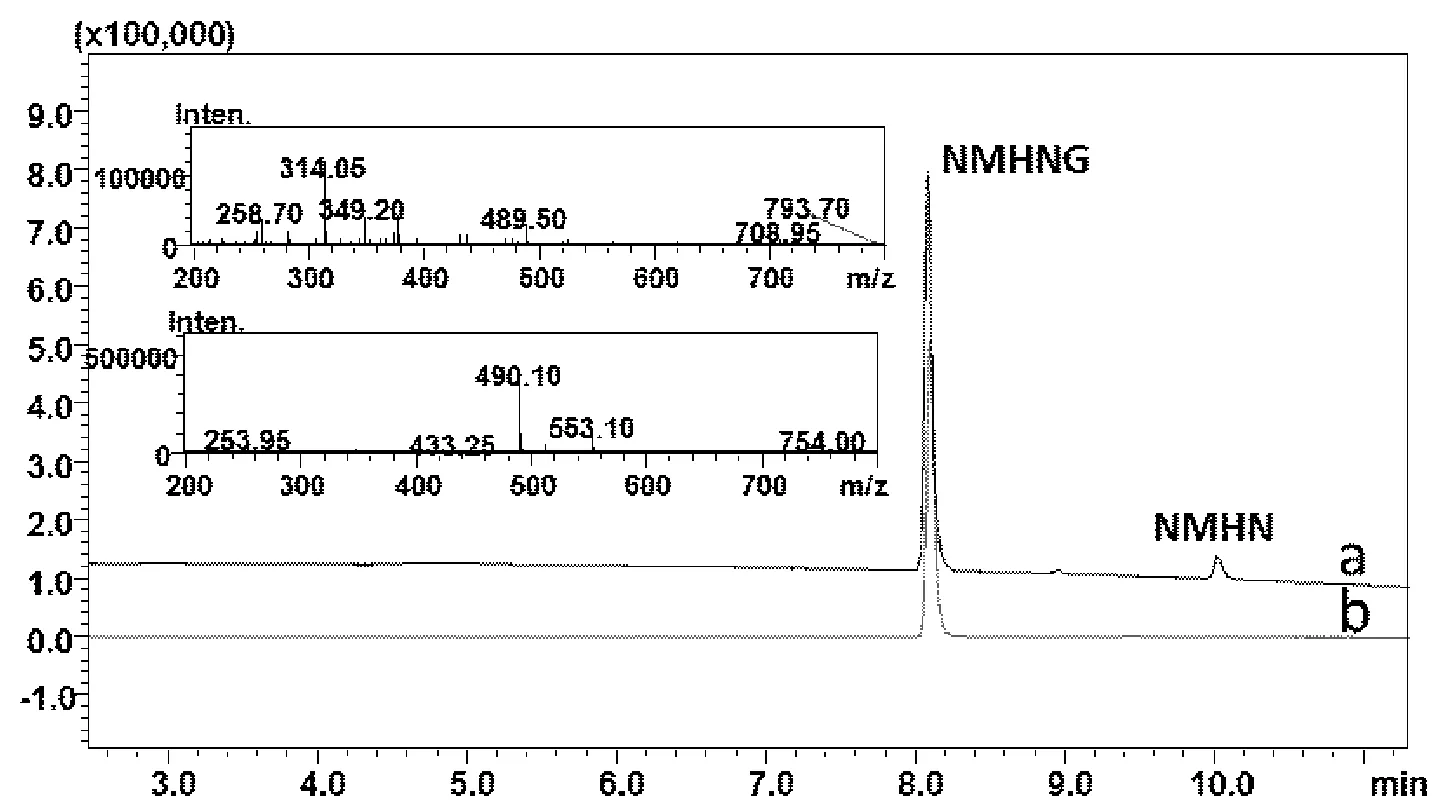
Fig.1 UPLC-UV chromatography of the reaction mixture (a) and the glucuronide of NMHN after isolation and purification by SPE(b) and the MS spectra of NMHN and NMHNG (Inset)
2.3 NMHN葡萄糖醛酸苷的结构表征
NMHNG黄色粉末(乙腈),紫外最大吸收波长为240 nm和360 nm,ESI-MS给出其准离子峰m/z 490.10 [M+H]+,其分子量489比NMHN大176,结合核磁共振氢谱和碳谱推测其分子式为C23H23NO11。与NMHN的13C NMR相比,NMHNG的13C NMR中出现6个新的葡萄糖醛酸的碳信号(δ99.94,72.9,75.57,71.3,75.4,170.0),其它碳信号与NMHN非常相似。从远程相关谱图HMBC谱中看到(δ5.44) 的葡萄糖醛酸的端基氢信号与C-4(δ157.7)有相关。1H NMR 中NMHNG的葡萄糖醛酸特征信号端基质子 H(δ5.44,J=7.2Hz)偶合常数大于7,证实其为β构型糖苷键。综合上述信息,可确定NMHN在猪肝微粒体的催化下生成了NMHN-β-D-葡萄糖醛酸苷结合物,氢谱和碳谱核磁共振化学位移归属见表1。
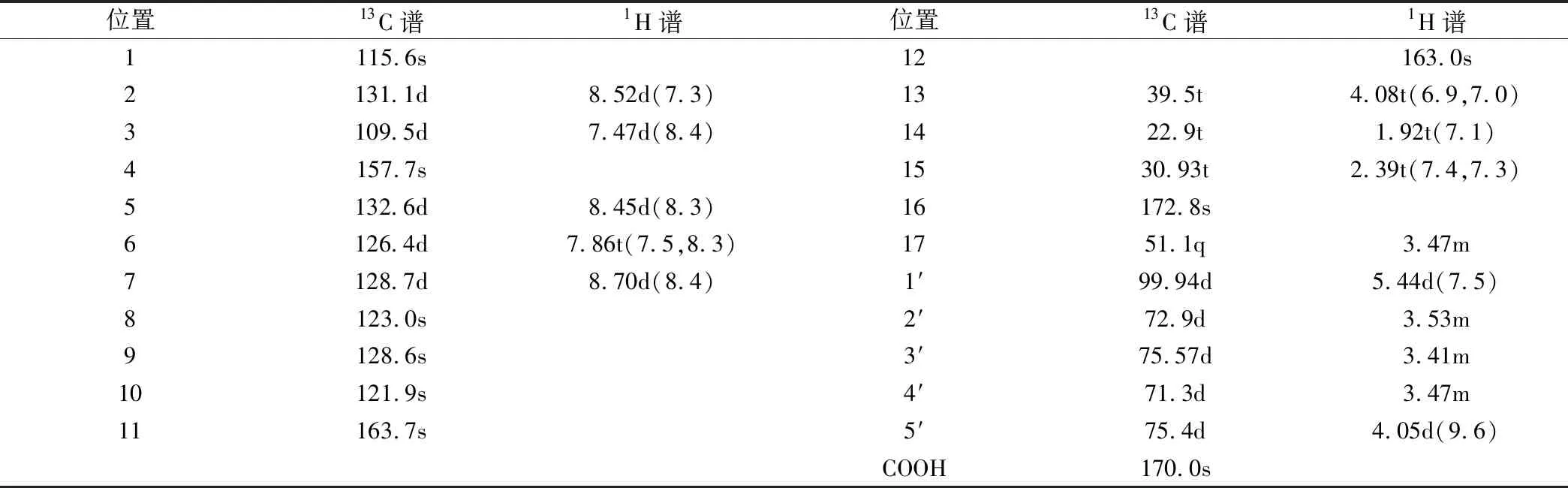
Table 1 Proton and carbon NMR chemical shift assignments for the glucuronide of NMHNG (DMSO-d6,δ in ppm,J in Hz)
3 结论
本文考察了不同种属肝微粒体对NMHN的生物转化效率,利用能够高效转化NMHN生成NMHNG的猪肝微粒体,使用生物合成的方法制备了NMHNG。同时通过固相萃取小柱实现了反应混合液中NMHNG的富集、分离和纯化,借助现代波谱分析手段对NMHNG的结构进行了表征。该生物合成法产率高、制备物纯度高、制备过程简单,为NMHNβ-D-葡萄糖醛酸苷的高效制备提供了方法。
——α-葡萄糖醛酸酶的研究进展*

