连翘果、连翘叶乙醇提取物的抑菌活性及成分分析
, ,, ,
(1.山西中医药大学中药与食品工程学院,山西晋中 030619;2.山西大学生命科学学院,山西太原 030006)
连翘(Forsythiasuspensa)为木犀科连翘属植物,连翘的主要化学成分有苯乙醇苷类、木脂素类、五环三萜类、黄酮类、挥发油及酚酸类等[1]。连翘果有抑菌、强心、利尿、镇吐等药理作用[2],为双黄连口服液、双黄连粉针剂、银翘解毒冲剂等中药制剂的主要原料,对枯草芽孢杆菌、副伤寒杆菌、大肠杆菌、痢疾杆菌、白喉杆菌及霍乱弧菌、金黄色葡萄球菌、链球菌等具有抑制作用[1]。连翘叶作为药材副产物,已入选新食品原料,其化学成分主要包括木脂素类、挥发油及其萜类、苯乙醇苷类、黄酮类、生物碱类、有机酸类及多糖类等[3]。连翘叶具有抑菌、保肝、抗氧化、抗衰老、保护心脏、降血糖、抗疲劳、抗癌、降脂等药理作用[4]。研究表明,连翘叶提取物对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、白色念珠菌有较强的抑制作用,且其抑菌活性强于连翘果实和连翘花[5-6]。连翘叶的抑菌活性具有良好的热稳定性,在中性和弱酸性环境中抑菌活性较强,Ca2+、Cu2+、Fe3+能增强连翘叶抑菌能力[7],具有开发为天然食品防腐剂的潜力。
大量研究表明,连翘果和连翘叶对多种细菌、真菌具有抑制作用,连翘苷、连翘脂素、熊果酸、芦丁为连翘中主要的抑菌活性成分[8],也有实验表明,连翘酚才是连翘的有效抑菌成分[9]。由此可见,目前对连翘中主要抑菌成分存在不同的认识。为了进一步研究连翘果、连翘叶乙醇提取物的抑菌活性及其组成成分的差异,本实验采用抑菌圈实验比较了连翘果与连翘叶乙醇提取物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑制作用;分析了连翘果、连翘叶乙醇提取物对金黄色葡萄球菌生长曲线的影响,采用紫外分光光度法测定了金黄色葡萄球菌培养液中大分子物质及碱性磷酸酶含量的变化情况;进一步采用气质联用技术分析了连翘果、连翘叶乙醇提取物中的挥发性成分,并探讨了其组成成分与抑菌作用的关系。
1 材料与方法
1.1 材料与仪器
蛋白胨、牛肉膏、琼脂粉 分析纯,北京奥博星生物技术有限责任公司;氯化钠 分析纯,天津市光复科技发展有限公司;乙醇 分析纯,天津市天力化学试剂有限公司;甲醇 色谱纯,德国Merck;碱性磷酸酶试剂盒 南京建成生物科技有限公司;连翘果(成熟果实)、连翘叶(六月份采摘) 山西省安泽县连翘GAP生产基地;大肠杆菌(EscherichiacoliATCC 25922)、金黄色葡萄球菌(StaphylococcusaureusATCC 26112)、枯草芽孢杆菌(BacillussubtilisATCC 6051) 山西大学生命科学学院微生物学实验室提供。
U-3000型紫外分光光度计 美国奥泰科技(中国)有限公司;SY-2000型旋转蒸发器 上海亚荣生化仪器厂;DY04型高压灭菌锅 上海东亚压力容器制造有限公司;HZC-250型恒温振荡培养箱 北京乾明基因技术有限公司;7890B-5977B型气相色谱质谱联用仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 连翘果、连翘叶乙醇提取物的制备 连翘果、连翘叶粉碎过筛后,分别以1∶10 (g/mL)料液比加入70%乙醇,80~82 ℃回流提取2 h,提取两次,过滤后合并滤液,滤液旋转蒸发浓缩得到连翘果、连翘叶乙醇提取物。取连翘果、连翘叶乙醇提取物分别用蒸馏水稀释,制成50 mg/mL的分散液用于抑菌圈实验。
1.2.2 菌悬液的制备 分别将活化好的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌在无菌环境下用接种环从试管斜面挑取一环于10 mL已灭菌的液体肉汤培养基中,充分震荡均匀后放入37 ℃恒温培养12 h,调整菌悬液浓度为105CFU/mL备用。
1.2.3 抑菌圈实验 细菌抑菌圈试验采用滤纸片法,将灭菌融化后的肉汤培养基冷却至45 ℃后倾注于平板中,每皿约20 mL。待平板充分凝固后,向平板上滴加0.2 mL已稀释至105CFU/mL的菌悬液,涂布均匀,静置至表层菌液充分干燥。将直径为8 mm的灭菌滤纸片放入已干燥的涂布菌液的平板上,每片滤纸片加样20 μL,每种样品一片,使用生理盐水做空白,每个平板重复3个,37 ℃恒温倒置培养,根据预实验培养16 h时抑菌圈最大,本实验培养16 h 后测定抑菌圈直径。
1.2.4 最小抑菌浓度的测定 采用试管倍比稀释法[10]测定样品对金黄色葡萄球菌的最低抑菌浓度。取11支试管标记为1~11号,首先在每支试管中加入液体培养基2 mL,高压灭菌后在1号试管中加入样品2 mL振荡均匀,然后吸取2 mL至2号试管,振荡均匀后再吸取2 mL至3号试管,如此连续倍比稀释至10号试管,并从10号试管中吸取2 mL弃去,11号试管为不含样品的生长对照。在每管内加入浓度为105CFU/mL菌悬液各0.1 mL,于37 ℃中培养12 h,用肉眼观察不发生浑浊、沉淀、表面生长任一现象的最小的样品浓度为该样品的最低抑菌浓度。如培养液肉眼不易辨明菌体的生长情况,可从各管中各取0.1 mL接于固体平板上,于37 ℃培养12 h观察有无菌落生长,并加以判断。
1.2.5 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌抑菌机理的研究
1.2.5.1 对生长曲线的影响 金黄色葡萄球菌活化后,接种于液体肉汤培养基,置于37 ℃培养箱中培养12 h,稀释为105CFU/mL的菌悬液,取菌悬液与连翘果、连翘叶乙醇提取物分别混合,使连翘果、连翘叶乙醇提取物的终浓度分别为其最低抑菌浓度,37 ℃,150 r/min摇床培养,另外以无菌水代替样品做空白对照。每培养2 h取样,采用分光光度计在600 nm测菌液的OD值[11]。
1.2.5.2 对培养液中大分子物质的影响 取105CFU/mL的菌悬液与连翘果、连翘叶乙醇提取物分别混合,使样品浓度分别为其最低抑菌浓度,37 ℃,150 r/min摇床培养,另外以无菌水代替样品做空白对照。每间隔2 h取菌液3 mL,12000 r/min离心5 min取上清液,在260 nm测定OD值,该值可以代表细胞内DNA/RNA的泄漏程度由此反映出细胞膜的受损情况[12]。
1.2.5.3 对培养液中碱性磷酸酶(AKP)含量的影响 取稀释为105CFU/mL的菌悬液与连翘果、连翘叶乙醇提取物分别混合,使样品浓度分别为其最低抑菌浓度,37 ℃,150 r/min摇床培养,另外以无菌水代替样品做空白对照。混合培养后取菌液1 mL,3500 r/min离心10 min,取上清液用AKP试剂盒方法测定,期间每2 h测定一次。
1.2.6 气质联用(GC-MS)分析 取连翘果、连翘叶乙醇提取物以色谱级甲醇稀释后,过 0.22 μm有机滤膜,采用安捷伦7890B-5977B气相色谱质谱联用仪进行分析。
色谱条件:色谱柱为HP-5MS毛细管色谱柱(0.25 mm×30 m,0.25 μm);进样口温度250 ℃,采用不分流进样,载气为高纯氦气,流速为1.2 mL/min;进样量1 μL;离子源温度230 ℃,EI源电压70 eV,四级杆温度150 ℃。程序升温:初始温度50 ℃,以10 ℃/min的速率升至80 ℃,保持3 min,再以15 ℃/min的速率升至300 ℃,保持5 min。检索谱库:NIST14。
1.3 数据统计分析
所有数据以平均值(Mean)±标准差(SD)表示(n=3),Origin 8.5软件作图。
2 结果与分析
2.1 连翘果、连翘叶乙醇提取物的抑菌圈实验结果
连翘果、连翘叶乙醇提取物对3种供试细菌抑菌圈结果见表1。由表1可以看出,两种提取物对3种供试细菌都具有一定的抑制效果,连翘果、连翘叶乙醇提取物对枯草芽孢杆菌的抑菌圈直径分别为(13.3±0.5)、(14.7±0.7) mm,对大肠杆菌的抑菌圈直径分别为(11.0±0.6)、(12.7±1.2) mm,对金黄色葡萄球菌的抑菌圈直径分别为(12.0±0.9)、(15.0±0.8) mm,表明连翘叶乙醇提取物的抑菌圈直径普遍大于连翘果乙醇提取物,该结果与前期研究结果一致[5-6]。
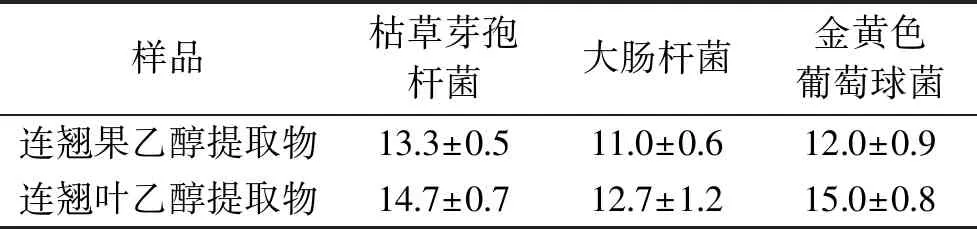
表1 连翘果、连翘叶乙醇提取物对供试细菌的抑菌圈直径(mm)Table 1 Diameter inhibition zone of ethanol extracts from Forsythia suspensa fruit and Forsythia suspensa leaves against tested bacteria(mm)
2.2 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌的最低抑菌浓度
采用倍比稀释法测定连翘果、连翘叶乙醇提取物对金黄色葡萄球菌的最低抑菌浓度,由于培养液肉眼不易辨明菌体的生长情况,从各管中取培养液接于固体平板上,于37 ℃培养12 h观察有无菌落生长,具体实验结果见表2,连翘果、连翘叶乙醇提取物对金黄色葡萄球菌的最低抑菌浓度分别为6.250、3.125 mg/mL。

表2 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌的最低抑菌浓度Table 2 The MIC of ethanol extracts from Forsythia suspensa fruit and Forsythia suspensa leaves against Staphylococcus aureus
2.3 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌的抑菌机理研究
2.3.1 对生长曲线的影响 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌生长曲线的影响如图1所示。从图1可以看出,对照组具有典型的生长曲线特征。两种样品处理组在其最低抑菌浓度下抑制了金黄色葡萄球菌的生长,培养14 h后,两个样品组的OD600有一定程度的增加,但在整个生长过程中OD600始终低于对照组,表明连翘果、连翘叶乙醇提取物对金黄色葡萄球菌的生长繁殖起到了明显的抑制作用,且连翘叶乙醇提取物对金黄色葡萄球菌生长繁殖的抑制作用大于连翘果乙醇提取物。

图1 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌生长曲线的影响Fig.1 Effects of ethanol extract from Forsythia suspensa fruits and Forsythia suspensa leaves on growth curve of Staphylococcus aureus
2.3.2 对培养液中大分子物质的影响 细胞膜的完整性是菌体正常生长代谢的一个主要影响因素,核酸等大分子物质的泄漏则表明细胞膜完整性遭到了破坏[13]。连翘果、连翘叶乙醇提取物对金黄色葡萄球菌培养液中核酸等大分子物质的影响如图2所示。从图2可以看出,对照组在整个生长过程中的OD260值非常稳定,表明无细胞内容物外溢;而样品组随着时间的推移,OD260值快速上升后趋于稳定,说明样品组细胞内容物外溢,核酸等大分子物质流出;初步判断连翘果、连翘叶乙醇提取物能作用于金黄色葡萄球菌细胞膜,损坏了细胞膜的完整性,致使核酸泄漏,且16 h前连翘叶乙醇提取物的作用速度大于连翘果乙醇提取物,但16 h后连翘果乙醇提取物的作用强度大于连翘叶乙醇提取物。
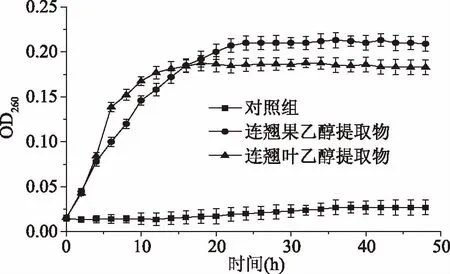
图2 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌大分子物质泄漏的影响Fig.2 Effects of ethanol extract from Forsythia suspense fruit and Forsythia suspensa leaves on large molecules leakage of Staphylococcus aureus
2.3.3 对培养液中AKP含量的影响 AKP是存在于细胞壁与细胞膜之间的一种酶,正常情况下在细胞外不能检测到其活性,但当细胞壁遭到破坏后,细胞壁通透性增加使AKP泄漏到细胞外,通过检测胞外AKP含量的变化可反映出细胞壁的破坏情况[14]。连翘果、连翘叶乙醇提取物对金黄色葡萄球菌培养液中AKP的影响如图3所示。从图3可以看出,对照组培养液中AKP含量0~6 h缓慢增加,后趋于稳定,且一直处在较低的水平;连翘果、连翘叶乙醇提取物处理组0~8 h AKP含量快速增加,且在0~8 h内连翘叶乙醇提取物处理组培养液中AKP的含量高于连翘果乙醇提取物处理组,10 h以后连翘果乙醇提取物处理组培养液中AKP的含量高于连翘叶乙醇提取物处理组。由此可知,连翘果、连翘叶乙醇提取物可破坏金黄色葡萄球菌细胞壁的完整性,造成菌体细胞壁通透性增加,且连翘叶乙醇提取物的作用速度大于连翘果乙醇提取物。
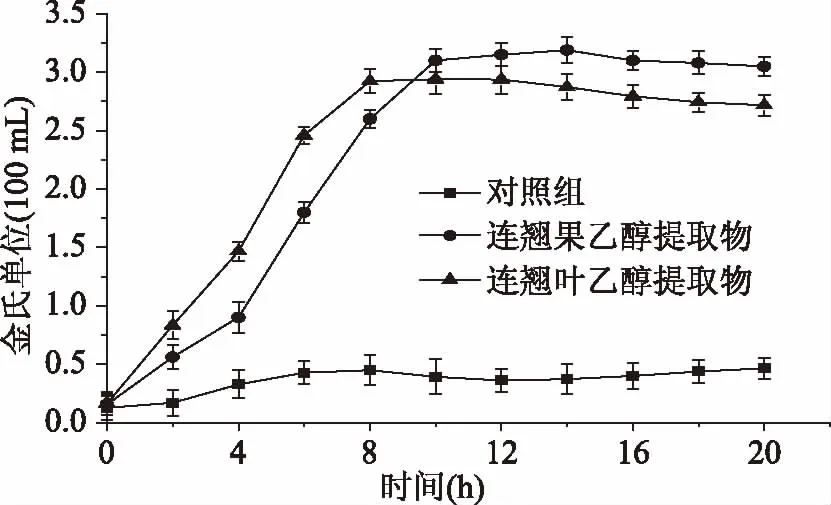
图3 连翘果、连翘叶乙醇提取物对金黄色葡萄球菌培养液中碱性磷酸酶含量的影响Fig.3 Effects of ethanol extract from Forsythia suspensa fruit and Forsythia suspensa leaves on the content of alkaline phosphatase of Staphylococcus aureus
2.4 连翘果、连翘叶乙醇提取物的GC-MS分析结果
对连翘果、连翘叶乙醇提取物进行气质联用分析,总离子流图如图4。
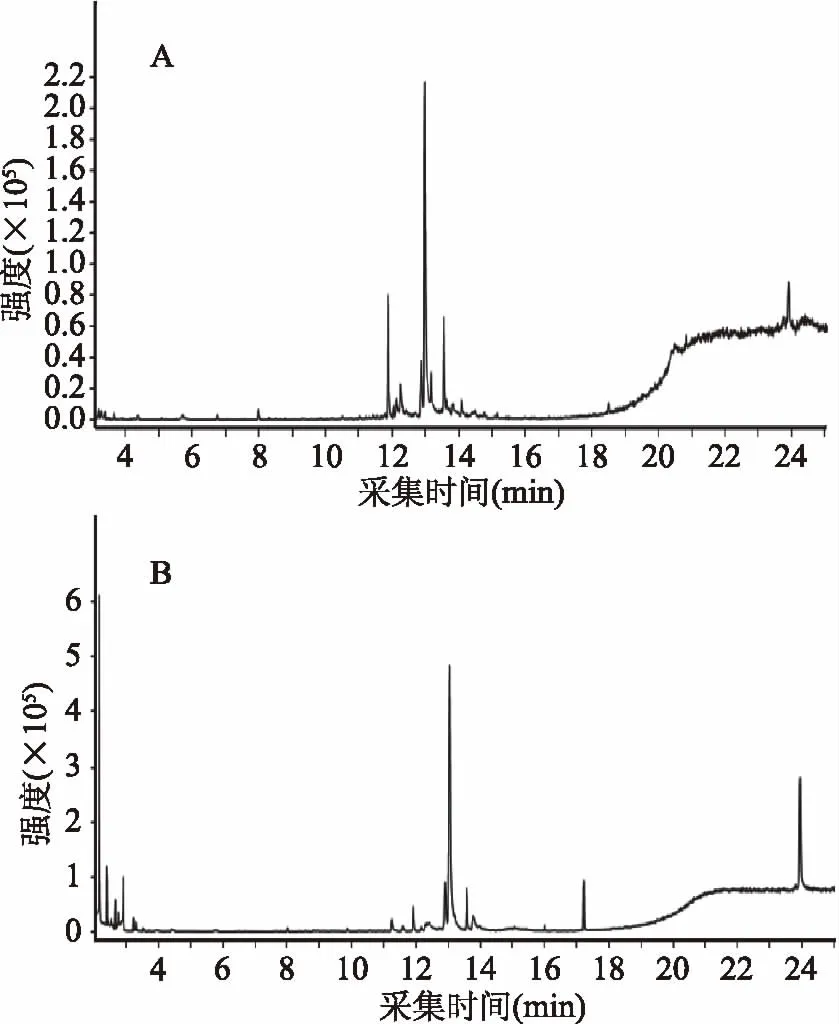
图4 连翘果(A)、连翘叶(B)乙醇提取物总离子流图Fig.4 Total ionic chromatogram of ethanol extract from Forsythia suspense fruit(A) and Forsythia suspensa leaves(B)
在保留时间 2~25 min内,对各个峰经计算机数据系统检索,人工谱图解析得到多种物质,其名称、分子式、百分含量列于表3中。连翘果乙醇提取物中鉴定出22种物质,主要包括醇类(38.55%)、酚类(14.00%)、酮类(11.07%)、酯类(6.11%)、烯烃类(3.64%)、烷烃类(1.49%)、醛类(1.56%)等;连翘叶乙醇提取物中鉴定出26种物质,包括醇类(34.97%)、烯烃类(12.71%)、酚类(12.26%)、烷烃类(11.05%)、酯类(6.90%)、酮类(2.51%)等;连翘叶乙醇提取物中烯烃和烷烃类物质是主要的成分,含量在10%以上,而连翘果乙醇提取物中烯烃和烷烃类物质含量很少,酚酮类物质含量较多。醇类是连翘果和连翘叶乙醇提取物中最主要的挥发性成分,含量在30%以上,连翘果、连翘叶乙醇提取物中还含有醛类、酮类物质。研究发现,醇类、醛类、酮类物质可进入菌体细胞内,破坏细胞内蛋白质,抑制微生物的新成代谢[15]。连翘果乙醇提取物鉴定出3种酚类物质包括对羟基苯乙醇(2.73%)、3-羟基-2-甲基苯甲醛(4.00%)、2,5,-二羟基苯乙酸(7.27%);连翘叶乙醇提取物中鉴定出6种酚类物质,除了对羟基苯乙醇(1.73%)、3-羟基-2-甲基苯甲醛(0.11%)、2,5,-二羟基苯乙酸(7.10%),还包括苯酚(1.20%)、1,3-苯二醇单乙酸脂(1.30%)、2-羟基-3-甲基苯甲醛(0.82%),酚类物质具有杀菌效果是天然植物挥发性物质中主要的杀菌剂[16]。连翘果、连翘叶乙醇提取物中分别鉴定出1.49%和11.05%的烷烃类物质,根据文献报道烷烃类也具有一定的抑菌效果[17]。
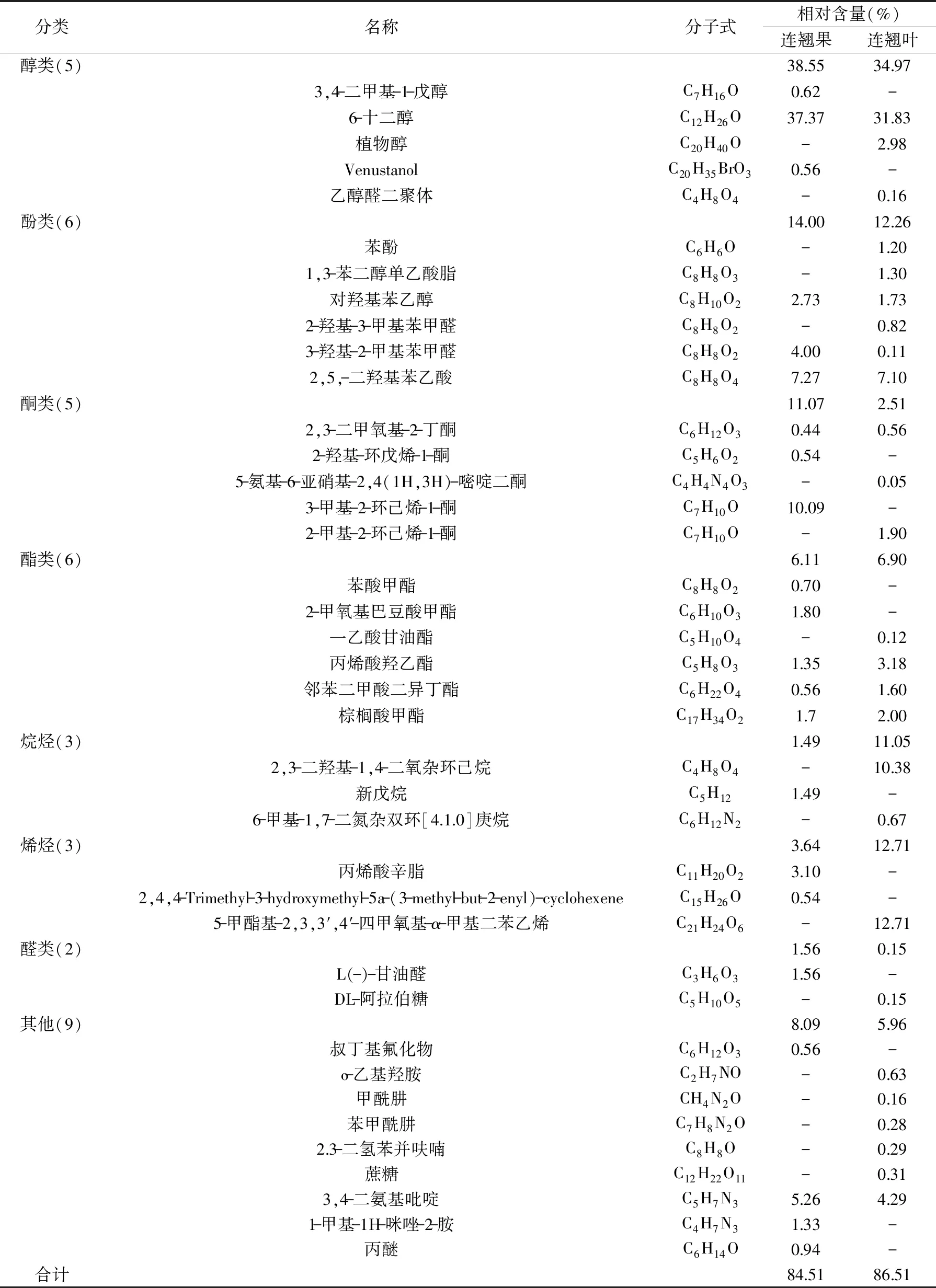
表3 连翘果与连翘叶乙醇提取物的化学成分Table 3 Chemical compositions of Forsythia suspense fruit and Forsythia suspensa leaves extract
3 结论
连翘果与连翘叶乙醇提取物对细菌具有抑制效果,连翘叶乙醇提取物对三种供试细菌的抑制作用大于连翘果乙醇提取物;连翘果和连翘叶乙醇提取物对金黄色葡萄球菌的最低抑菌浓度分别为6.25、3.125 mg/mL。连翘果、连翘叶乙醇提取物可以影响金黄色葡萄球菌细胞壁、细胞膜的完整性,导致菌体中核酸等大分子物质及碱性磷酸酶的泄漏,从而抑制金黄色葡萄球菌的生长繁殖,且连翘叶乙醇提取物对金黄色葡萄球菌生长繁殖的抑制作用大于连翘果乙醇提取物。连翘果与连翘叶乙醇提取物中含有多种醇类、酚类、醛类、酮类、烷烃、烯烃类物质,这些物质对其抑菌活性有较大的贡献,而且其抑菌活性的差异主要与这些物质的种类和含量有关。

