基于AFP+AFP-L3+PIVKA-Ⅱ的电泳荧光仪性能分析
邢 晏,冯长焕,杜利君
(1.西华师范大学数学与信息学院,四川 南充 637000;2.南充市中心医院医学检验科,四川 南充 637000)
原发性肝癌(PHC)主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)及 HCC-ICC 3大种类,是我国目前第4位常见恶性肿瘤及第3位肿瘤致死病因[1]. 我国每年约有11万人死于肝癌,占全球肝癌死亡患者的45%[2].甲胎蛋白异质体(AFP-L3)来源于甲胎蛋白(AFP),与异常凝血酶原(PIVKA-Ⅱ)都是PHC特异性较高的肿瘤标志物,AFP阳性HCC与AFP阴性HCC相比,恶性程度较高,预后较差[3].临床上约有30%肝癌患者呈血清AFP阴性,而一些乙型肝炎和肝硬化患者血清AFP呈阳性,血清AFP的敏感性和特异性尚不能满足临床需求[4].PIVKA-Ⅱ 有助于HCC早期诊断.由于各种原因,肝癌组织能产生 PIVKA-Ⅱ并进入血液[5-6],但是PIVKA-Ⅱ结果受诸多因素影响,可能会给诊断PHC的特异度[7-8]带来误差.近年来研究[9-10]显示,联合检测多种血清标志物对肝癌诊断具有很好互补作用,尤其是对AFP的阴性患者.AFP作为较好的筛查指标,单项检测中,AFPd -L3特异度最高,PIVKA-Ⅱ灵敏度最高.将AFP,AFP-L3,PIVKA-Ⅱ三者联合检测可以大大提高HCC的诊断效能,弥补单项检测的不足[11].
全自动电泳荧光免疫分析仪μTASWakoi30正是通过使用LBA 法在液相中进行抗原抗体反应后,分离并检测形成的免疫复合体,实行AFP+AFP-L3+PIVKA-Ⅱ三联合检测,快速高效,极大地提高了检测的敏感性与特异性,提升了早期HCC的诊断率.同时,也便于对HCC与BLD患者进行鉴别诊断、疗效评估和复发监测等.尤其在HCC高危人群监测中,联合检测可以更早提示HCC的存在,从而实现早发现、早诊断、早治疗,大大改善患者预后.为了验证仪器检测结果的准确性,给临床提供快捷准确的检验报告及诊断依据,笔者对全自动电泳荧光免疫分析仪μTASWakoi30 进行了精密度、线性范围及准确性等性能的验证分析.
1 材料与方法
1.1 材料
1.1.1 检测样本 在专业技术人员指导下选择南充市中心医院门诊体检患者的新鲜血清,要求标本无溶血、无黄疸、无浑浊.
1.1.2 仪器和试剂 仪器:μTASWakoi30全自动电泳荧光免疫分析仪.试剂:甲胎蛋白及其异质体比率测定试剂盒(批号TQ659);异常凝血酶原测定试剂盒(批号TQ660); 与试剂盒相应的原装配套质控品校准液、芯片盒、稀释液、清洗液等.试剂均由日本和光纯药Wako提供,在有效日期内使用,使用环境的湿度、相对湿度、供电电压及接地状况等符合要求.
1.2 方法
1.2.1 质控检测 连续3天实验,每天实验前均按要求进行质控检测.
1.2.2 精密度验证 分别取AFP-L3与PIVKA-Ⅱ高、中、低3个质量浓度或者质量分数水平的血清标本作为待测样品,其中:血清标本1 AFP 2 108.56 μg/L,AFP-L3 28.4%,PIVKA-Ⅱ 22 763.13 μg/L;血清标本2 AFP 594.31 μg/L,AFP-L3 88.51%,PIVKA-Ⅱ 1 160.47 μg/L;血清标本3 AFP 5.69 μg/L,AFP-L3 <0.5%,PIVKA-Ⅱ 12.07 μg/L.分装-20 ℃保存,连续检测3天,每天重复检测5次,参照各自试剂说明书评价精密度.
1.2.3 线性验证 将AFP,AFP-L3,PIVKA-Ⅱ按尽可能接近厂商声明的检测限各取一高值血清样本,以WAKO质量浓度1 883.2 μg/L、罗氏浓度>1 210 μg/L为标准分别按1∶0,1∶1,1∶4,1∶19,1∶190,0∶1 共6种比例用稀释液稀释后重复检测2次,求其实测均值,对照各自预测值参考CLSI的EP-6A2文件进行线性评估.
1.2.4 准确性验证 分2组每组准备2份已知质量浓度的不同血清样本,按校准品与血清体积比35 mL/120 mL,70 mL/120 mL分别加入AFP-L3校准品(101 μg/L)及PIVKA-Ⅱ校准品(409 AU/L)作为待测样本,每份样本重复检测3次,取平均值,与理论值进行比较,参考试剂说明书判断其回收率是不在80%~120%区间.
1.3 统计学方法
采用SPSS 19.0统计软件对检测结果进行分析.
2 结果分析
2.1 质控检测
通过3天质控检测可知,质控1的AFP分别为52.30,53.50,54.10 μg/L,AFP-L3相应为27.60%,27.60%,27.70%;质控2的AFP分别为210.40,218.40,219.50 μg/L,AFP-L3相应为19.80%,19.80%,19.60%;质控1的PIVKA-Ⅱ分别为104.00,108.00,110.00 AU/L;质控2的PIVKA-Ⅱ分别为2 121,2 184,2 228 AU/L.其各项质控对应的实测均值X、标准差SD、精密度CV具体见表1.
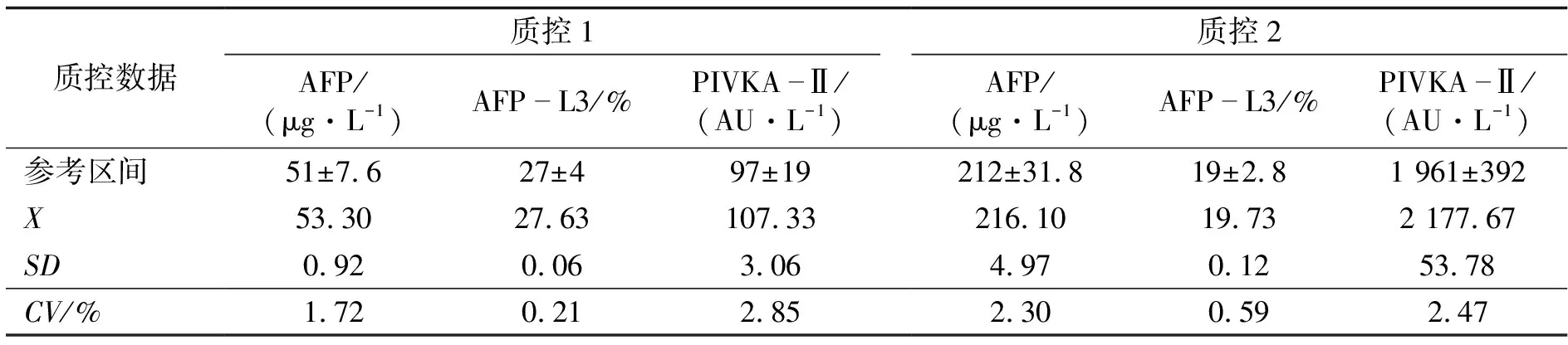
表1 μTASWakoi30质控数据比较
2.2 精密度验证
AFP,AFP-L3,PIVKA-Ⅱ高、中、低3个水平样本连续3天的检测结果列于表2.

表2 μTASWakoi30精密度数据分析
由表2可知,AFP 3个水平的精密度依次为2.47%,3.12%,4.84%,相应AFP-L3精密度依次为1.37%,0.20%,0%,PIVKA-Ⅱ精密度依次为1.29%,4.08%,6.40%.
2.3 线性验证
各取一高值AFP,AFP-L3,PIVKA-Ⅱ血清样本按稀释比例1∶0,1∶1,1∶4,1∶19,1∶190,0∶1 共6种比例稀释后进行检测,具体检测结果见表3.

表3 μTASWakoi30线性值
结合预测值进行线性拟合,统计分析结果显示:AFP线性回归方程为y=0.997 1x-5.018 4,R2=0.999 7;PIVKA-Ⅱ线性回归方程分别为y=0.975 5x+843.4,R2=0.998.线性回归方程如图1~2所示.

图1 AFP线性回归分析Fig. 1 AFP Linear Regression Analysis
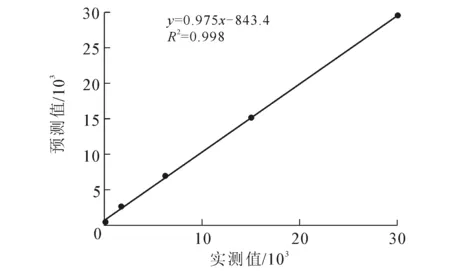
图2 PIVKA-Ⅱ 线性关系分析Fig. 2 Analysis of PIVKA-Ⅱ Linear Relation
2.4 准确性验证
比较在不同血清样本中AFP,AFP-L3,PIVKA-Ⅱ实测均值与理论值,计算回收率, 结果见表4.
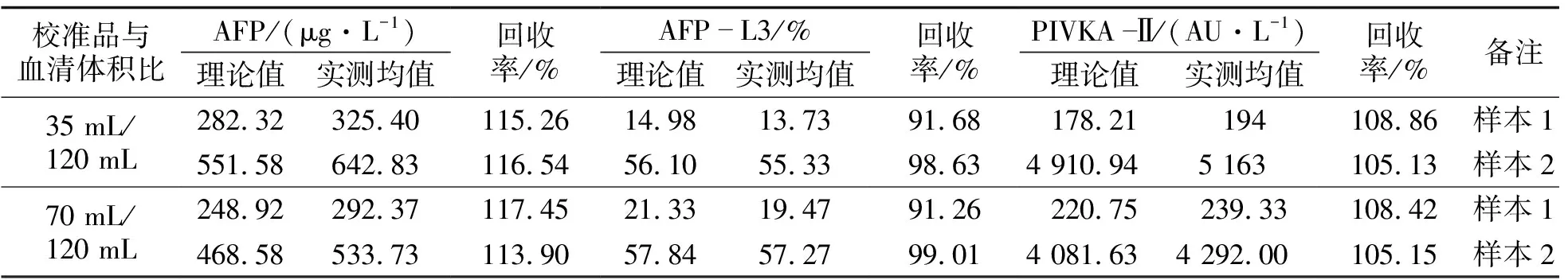
表4 μTASWakoi30准确性验证数据
由表4可知,回收率均在试剂要求的80%~120%区间内,在校准品与血清体积比70 mL/120 mL下,最高回收率(AFP)为117.45%,最低回收率(AFP-L3)91.26%.
3 讨论
近年来,甲胎蛋白异质体AFP-L3和异常凝血酶原PIVKA-Ⅱ作为新的HCC标志物已得到广泛应用.国内外多项研究均表明,联合PIVKA-Ⅱ和AFP 检测可提高肝癌诊断的敏感性[12-13],PIVKA-Ⅱ对诊断原发性肝癌有较高特异性,且血清中的PIVKA-Ⅱ水平与AFP水平无相关性,对AFP假阴性肝癌的诊断有一定的价值[14].秦燕等[15]研究发现,AFP对小于3 cm的肝脏肿瘤具有最高的诊断价值,PIVKA-Ⅱ对中晚期肝癌的诊断价值高于AFP.AFP和PIVKA-Ⅱ联合 AFP-L3能明显提高在肝硬化患者中筛选肝癌和小肝癌患者的能力.由此可见,AFP,AFP-L3及PIVKA-Ⅱ各有优点,但目前该指标的检测我国尚未广泛应用于临床.医学检测应用中发现,由日本和光纯药出品的全自动电泳荧光免疫分析仪μTASWakoi30实行AFP,AFP-L3与PIVKA-Ⅱ联合检测,可以提高 HCC 患者早期诊断的灵敏度和特异度.笔者根据国家《医疗机构临床实验室管理办法》和《临床实验室对商品定量试剂盒分析性能的验证(ws/t 420-2013)》的规定和要求[16],对其主要性能指标进行验证.结果表明,AFP,AFP-L3及PIVKA-Ⅱ质控实测值均在正常范围,标准差最高为PIVKA-Ⅱ的53.78,最低为AFP-L3%的0.06,精密度CV均在10%以内(最高为2.85%),质控效果良好;从AFP,AFP-L3及PIVKA-Ⅱ 3个不同水平血清标本的实测均值和标准差来分析其精密度CV,均低于10%,其最高值为4.84%,满足试剂说明书要求;通过高值AFP,AFP-L3及PIVKA-Ⅱ样本在1∶0,1∶1,1∶4,1∶19,1∶190,0∶1共 6种不同稀释比例条件下检测,实测均值与理论值线性拟合良好,AFP线性回归方程为y=0.997 1x-5.018 4,R2=0.999 7,PIVKA-Ⅱ线性回归方程为y=0.975 5x+843.4,R2=0.998;在不同水平校准品与血清体积比条件下,对实测均值与理论值进行计算,发现在35 mL/120 mL条件下最高回收率(AFP)117.45%,最低回收率(AFP-L3)91.68%,均在试剂说明的80%~120%正常范围,表明检测准确性高.由此说明,通过μTASWakoi30电泳荧光分析仪既能解决筛查 HCC的AFP灵敏度和特异度问题[17],又能丰富PIVKA-Ⅱ在肝癌早期诊断当中的应用.

