响应面法优化松多酚微粒制备工艺
刁 岩,陈 斌,王 蕊,李 桥,赵海田,张 华,王 路,魏力军,*,王振宇,*
(1.哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨 150001;2.中国航天员科研训练中心 航天营养与食品工程重点实验室,北京 100094;3.哈尔滨工业大学生命科学与技术学院,黑龙江 哈尔滨 150001)
多酚类化合物是一类在化学结构上具有相似性的化合物的统称,其结构上的特点为,均具有一个及一个以上的酚羟基结构单元[1]。研究发现,多酚类化合物对飞行任务中航天员的多种生理或病理变化具有防护和修复作用的潜在能力[2-7]。天然植物多酚具有剂量小、效果强、生物活性多样等特点,而这些使其成为良好的功能性食品添加剂。根据多酚类化合物结构的特点可将植物多酚划分为酚酸类、类黄酮类、二苯乙烯类和木粉素类化合物[8-9]。松科植物体内含有大量的多酚类化合物,具有一系列独特的化学性质和生物活性,统称为松多酚(pine polyphenols fromPinus koraiensis,PPH)。研究发现该类物质不但具有清除体内自由基[10]、抑制脂质过氧化[11]、抗癌抗肿瘤[12]、抗炎镇痛[13]及抗菌抗病毒[14]等多种生理活性,还具有较好的辐射防护和修复的作用[15-16]和对失重骨丢失的防护作用[17],能够起到降血脂[18]、降血压[19]、降血糖[20]、抗血栓[21]及增强机体免疫功能[22]的作用。人体每日摄取一定量的天然多酚能够有效预防和抑制疾病的发生[23-24]。因此在空间飞行任务中具有防护航天员机体多种生理或病理改变的潜在能力。此外,PPH含有的酚羟基等多种官能团,能通过氢键、疏水键或者共价键与高分子化合物接枝、共聚或共混也可与多种金属离子发生络合反应,从而制备出一系列新型先进材料。
但是PPH化学结构不稳定,其在体外极易被氧化失活,并且由于机体吸收PPH的部位在肠道,口服PPH经过上消化道会使其生物活性降低或者全部丧失。本研究利用黑木耳多糖酸性片段(acidic polysaccharides fragments fromAuricularia auricula,AAP),通过聚电解质自组装原理将PPH包裹为PPH微粒并且将其制备工艺进行优化以降低机体上消化道对PPH生物活性的影响。为多酚类物质的综合开发利用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
红松球果鳞片和黑木耳采自中国大兴安岭;多聚赖氨酸(polylysine,PLL) 北京索莱宝科技有限公司;乙醇(纯度99.7%)、十六烷基三甲基溴化铵(99.5%)、硫酸(95%~98%) 天津科密欧化学试剂有限公司;石油醚(99.8%) 天津嘉宇精细化工有限公司;没食子酸(98%) 卡迈舒生物科技有限公司;丙酮(99.5%)、Folin-Ciocalteu试剂(98%) 天津光复精细化工研究所;乙醚、NaCl(99.5%)、Na2CO3(99.5%)天津大茂化学试剂厂;苯酚(9 8%) 北京鼎国生物技术有限公司;葡萄糖(99.5%) 天津海晶精细化工厂;大孔树脂(D101) 南开大学化工厂。
Infinite M200酶标仪 瑞士Tecan公司;ZHWY-211C恒温培养振荡器 上海志诚分析仪器有限公司;PB-10 pH计 赛多利斯仪器系统有限公司;FD-18真空冻干机上海田枫实业有限公司;XL30扫描电镜 荷兰Philips公司;FP16072导电胶带 北京中镜科仪技术有限公司。
1.2 方法
1.2.1 PPH的制备
将红松球果鳞片在40 ℃条件下烘干,粉碎后过40 目筛。料液比1∶20(g/mL)加入60%乙醇溶液后,4 ℃放置5 h。取出后超声(40 ℃)90 min,每隔30 min一次,3 次后放入4 ℃冰箱过夜。取出后,4 000 r/min离心10 min,取上清液用布氏漏斗过滤。旋转真空浓缩至40%溶液后经真空冷冻干燥得粉末。干燥粉末用蒸馏水溶解(固液比为1∶100(g/mL))后加入石油醚搅拌2 h后取水相加入Sevag试剂(5∶1,V/V)搅拌2 h。3 000 r/min离心取上清液经真空冷冻干燥得红松球果鳞片总多酚提取物粉末待用。
将红松球果鳞片总多酚提取物的粉末用蒸馏水溶解,使多酚质量浓度为1 mg/mL(以没食子酸当量计),利用大孔树脂(D101)进行进一步纯化。色谱柱直径比高为1∶30,上样量为1/4柱体积(1 mg/mL)。上样后蒸馏水洗脱2 个柱体积,然后用60%乙醇溶液洗脱2 个柱体积(流速4 mL/min),并且每1/4柱体积收集1 次,一共收集8 次(S1~S8)。其中S3为PPH,其得率为(369.19±2.74)mg/g。
1.2.2 AAP的制备
将经过干燥的黑木耳粉碎后过40 目筛。料液比1∶100(g/mL)加入蒸馏水后80 ℃水浴4 h。取出后超声(80 ℃)90 min,每隔30 min一次。重复3 次后合并滤液4 000 r/min离心20 min。收集上清液浓缩,加入3 倍体积的95%乙醇溶液沉淀过夜。所得到的沉淀分别经无水乙醇、丙酮和乙醚进行清洗,溶于少量的去离子水冻干为粉末。干燥粉末用蒸馏水溶解(固液比为1∶100)后加入H2O2(9∶1,V/V)过夜。然后用Sevag法除去蛋白质,加入Sevag试剂(5∶1,V/V)搅拌2 h。3 000 r/min离心取上清液,多次重复直到完全除去蛋白质。上清液经浓缩后加入3 倍体积的95%乙醇溶液沉淀24 h。所得到的沉淀分别经无水乙醇、丙酮和乙醚进行清洗,溶于少量的去离子水经真空冷冻干燥得黑木耳多糖粉末。将黑木耳多糖粉末溶于蒸馏水中(1∶1 000)后加入3%的十六烷基三甲基溴化铵溶液直至无沉淀析出为止。4 000 r/min离心20 min后用4 mol/L NaCl溶解。将溶液透析、浓缩后加入3 倍体积的95%乙醇溶液沉淀24 h。所得到的沉淀分别经无水乙醇、丙酮和乙醚进行清洗,溶于少量的去离子水冻干为粉末。将粉末用蒸馏水溶解使其多糖质量浓度为10 mg/mL(以葡萄糖当量计)。利用Sephadex G-100对其进行进一步纯化。色谱柱直径比高为1∶30,样品的上样体积为10 mL(10 mg/mL)。以蒸馏水为洗脱液,洗脱速率为0.2 mL/min,通过收集器自动收集,并采用苯酚-硫酸法进行多糖跟踪检测。收集最高主峰的多糖片段溶液经真空冷冻干燥得AAP。AAP得率为(119.6±10.85)mg/g。
1.2.3 PPH质量浓度的测定
采用改进的Folin-Ciocalteu法测定PPH含量[25]。0.5 mL稀释的样品溶液被转移到10 mL测试管,之后添加0.5 mL的Folin-Ciocalteu试剂,快速混匀,室温静置5 min,之后添加1.0 mL的10% Na2CO3溶液,并用蒸馏水校正总体积为3 mL,混匀,室温避光静置2 h。蒸馏水代替样品溶液作为空白对照,用紫外-可见分光光度计,于波长760 nm处测吸光度。以没食子酸(0~70 μg/mL)标准溶液制作标准曲线,回归方程为y=0.012 22x+0.012 256(R2=0.999 1,n=6,y为没食子酸溶液的吸光度,x为没食子酸质量浓度(μg/mL))。通过没食子酸回归方程和样品溶液稀释倍数计算多酚质量浓度。
1.2.4 AAP质量浓度的测定
采用苯酚-硫酸法[26]测定AAP含量。0.4 mL稀释的样品溶液被转移到10 mL测试管,之后添加0.2 mL的5%苯酚溶液,混匀后加入1 mL的浓硫酸。将测试管置于沸水中加热5 min,冷却至室温后,将溶液加入到96 孔板中(每孔200 μL),蒸馏水代替样品溶液作为空白对照,用紫外-可见分光光度计测量波长490 nm处吸光度。以葡萄糖(0~90 μg/mL)为标准品制作标准曲线。回归方程为y=2.315 51x+0.001 05(R2=0.999 6,n=6,y为葡萄糖溶液的吸光度,x为葡萄糖质量浓度(μg/mL))。通过葡萄糖回归方程和样品溶液稀释倍数计算AAP质量浓度。
1.2.5 PPH微粒制备工艺单因素试验
1.2.5.1 AAP质量浓度对PPH微粒包埋率的影响
pH 8.0的磷酸盐缓冲溶液(phosphate buffer saline,PBS)中使PLL(45 μg/mL)、PPH(120 μg/mL)与AAP(400、600、800、1 000、1 200 μg/mL)混合均匀后室温搅拌(100 r/min)3 h。8 000 r/min离心5 min后取上清液测定多酚含量。按公式(1)计算包埋率:

式中:E为包埋率/%;PT为加入PPH的总量/μg;PS为上清液中PPH含量/μg。
1.2.5.2 PLL质量浓度对PPH微粒包埋率的影响
pH 8.0的PBS中使AAP(800 μg/mL)、PPH(120 μg/mL)与PLL(5、15、25、35、45 μg/mL)混合均匀后室温搅拌(100 r/min)3 h。8 000 r/min离心5 min后取上清液测定多酚含量,并按公式(1)计算包埋率。
1.2.5.3 PPH质量浓度对PPH微粒包埋率的影响
pH 8.0的PBS中使AAP(800 μg/mL)、PLL(25 μg/mL)与PPH(40、60、80、100、120 μg/mL)混合均匀后室温搅拌(100 r/min)3 h。8 000 r/min离心5 min后取上清液测定多酚含量。按公式(1)计算包埋率。
1.2.6 响应面试验设计
通过单因素试验测定的水平范围,应用Design-Expert 8.0软件,按照Box-Behnken试验设计原理,设定3因素3水平的响应面试验,将包埋率作为响应值,AAP质量浓度、PLL质量浓度以及PPH质量浓度分别编码为X1、X2和X3,对PPH微粒的制备工艺进行优化,设置17 个试验点,如表1所示。
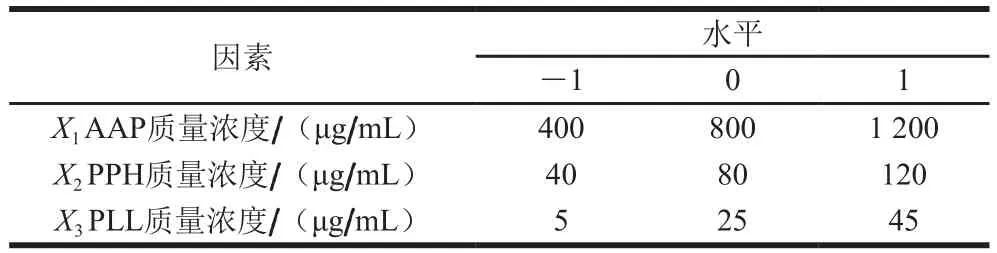
表1 响应面试验因素与水平Table 1 Coded levels and corresponding actual levels of independent variables used in Box-Behnken design
1.2.7 PPH微粒形貌观察
根据响应面试验优化的参数,将PPH微粒制备完成后加入蒸馏水洗涤2 次。8 000 r/min离心5 min后加入无水乙醇重悬。将重悬液滴在导电铜片上。待乙醇挥发后经过表面喷金处理,用扫描电子显微镜观察并拍照。
1.2.8 PPH微粒载药量的测定
根据响应面试验优化的参数,pH 8.0的PBS中使PLL、PPH与AAP混合均匀后室温搅拌(100 r/min)3 h。8 000 r/min离心5 min后取上清液测量多酚含量。沉淀用蒸馏水洗2 次后进行真空冷冻干燥。准确称量PPH微粒的质量。按公式(2)计算载药量:

式中:D为载药量/%;M为PPH微粒的质量/μg。
1.2.9 PPH微粒的体外缓释
模拟体外胃环境观察PPH微粒释放率:以pH值为1.2的人工胃液为释放介质,取10 mL缓冲溶液于15 mL离心管中。称取6 份PPH微粒每份200 mg置于释放介质中。将离心管放在浴恒温振荡器内,37 ℃、80 r/min匀速振荡。分别在1、2、3、4、5、6 h后8 000 r/min离心。15 min后弃去上清液,将沉淀用蒸馏水洗净后,真空冷冻干燥并且称量剩余质量。根据载药量计算PPH微粒释放率。
模拟体外肠环境观察微球释放量:以pH值为7.4的人工肠液(PBS)为释放介质,取10 mL缓冲溶液于15 mL离心管中。称取6 份PPH微粒每份200 mg置于人工胃液介质中37 ℃,以80 r/min匀速振荡6 h后8 000 r/min离心。15 min后弃去上清液,将沉淀用蒸馏水冲洗3 遍,然后将沉淀置于人工肠液中。将离心管放在浴恒温振荡器内,温度调至37 ℃,以80 r/min速率匀速振荡。分别在1、2、3、4、5、6 h后8 000 r/min离心15 min。将沉淀用蒸馏水洗净后,真空冷冻干燥并且称量剩余质量。根据载药量计算PPH微粒释放率。
1.3 数据统计
本研究中所有数据由SPSS 17.0软件统计得出,结果表示为 ±s。P<0.05,差异显著。数据均通过3 次独立实验获得。
2 结果与分析
2.1 单因素试验结果及分析
AAP是一种带有羧基的多糖片段,也是一种带有阴离子基团的聚电解质,根据聚电解质自组装原理,利用带有阳离子基团的聚电解质,通过二者在水溶液中可以自发的组装,从而将PPH包裹来制备PPH微粒。因此,首先对AAP、PLL与PPH在水溶液中的质量浓度对PPH微粒的包埋率进行检测。

图1 AAP质量浓度(A)、PLL质量浓度(B)、PPH质量浓度(C)对PPH微粒包埋率的影响Fig. 1 Effects of AAP (A), PLL (B) and PPH (C) concentration on encapsulation efficiency
如图1A所示,PPH微粒的包埋率随着AAP质量浓度的增大而增加。当AAP质量浓度为800 μg/mL时,PPH微粒的包埋率出现最大值(83.84±1.34)%,随后继续增加AAP的质量浓度包埋率变化极其缓慢,并在此后呈现较平稳趋势。因此在PLL和PPH质量浓度确定时应选取800 μg/mL作为AAP的最佳质量浓度进行优化试验。
如图1B所示,PPH微粒的包埋率随着PLL质量浓度的增大而增加。当PLL质量浓度为25 μg/mL时,PPH微粒的包埋率出现最大值(84.44±0.98)%,随后继续增加PLL的质量浓度包埋率迅速降低。这是因为随着PLL质量浓度的不断增加,当其与AAP质量浓度的比例超过一个临界点时,溶液中聚电解质的自组装方式发生改变[27]。当AAP过量时,其与PLL在溶液中组装成紧凑形式的微粒[28],而当PLL过量时,其与AAP在溶液中组装成松散形式的微粒[29]。因此在AAP和PPH质量浓度确定时应选取25 μg/mL作为PLL的最佳质量浓度进行优化试验。
如图1C所示,PPH微粒的包埋率随着PPH质量浓度的增大而增加。当PPH质量浓度为80 μg/mL时,PPH微粒的包埋率出现最大值(83.48±0.56)%,随后继续增加PPH的质量浓度包埋率变化较为缓慢,并在此后呈现略微降低的趋势。因此在AAP和PLL质量浓度确定时应选取80 μg/mL作为PLL的最佳质量浓度进行优化试验。
2.2 响应面试验设计及结果分析
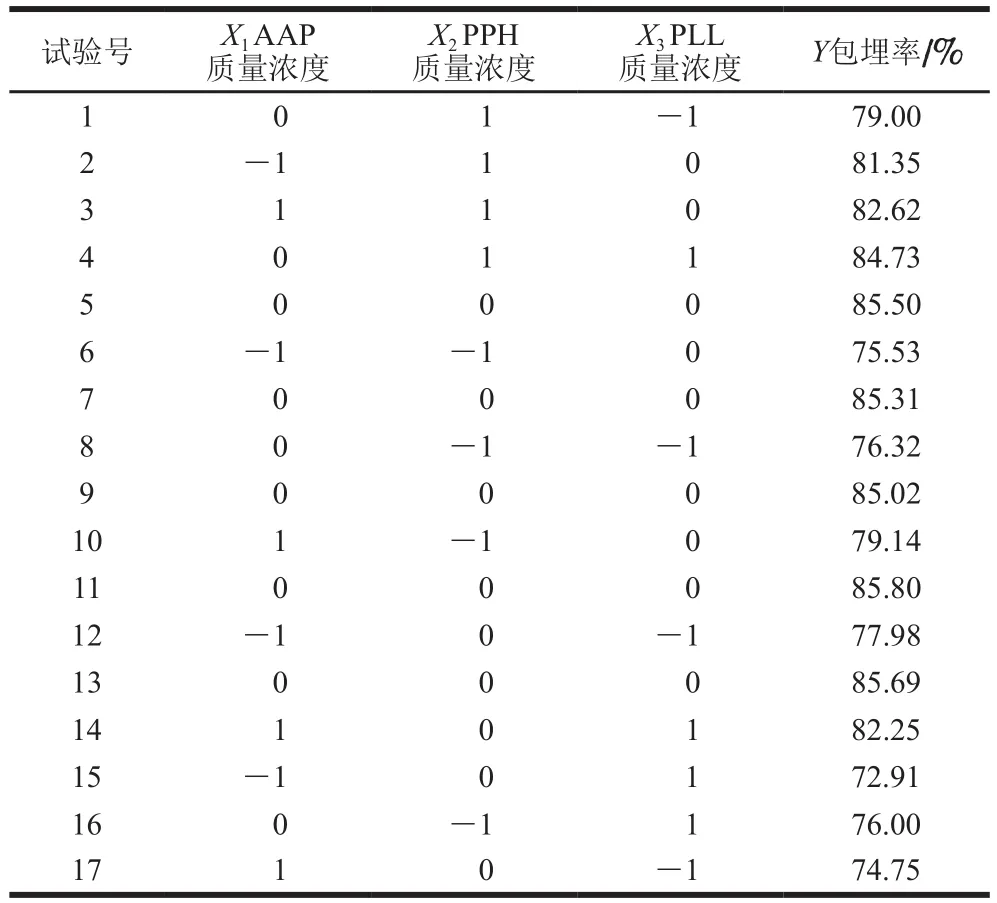
表2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis
在各单因素试验的基础之上,以PPH微粒包埋率(Y)作为响应值,以AAP质量浓度(X1)、PLL质量浓度(X2)和PPH质量浓度(X3)作为自变量,建立3因素3水平的试验设计。利用Design-Expert软件进行Box-Behnken试验设计与数据分析,如表2所示。
对设计方案中17 组试验数据,运用Design-Expert软件进行多元回归拟合,得到以包埋率Y为响应值,X1、X2、X3为自变量的二次多项回归方程,回归方程为:Y=85.46+1.37X1+2.59X2+0.98X3-0.59X1X2+3.14X1X3+1.51X2X3-3.92-1.88-4.57。
如表3所示,模型项显著,其拥有较高的F值(108.69),较低的P值(P<0.000 1)。并且该模型失拟项不显著(P>0.05)表明模型建模成功。由表3二次多项回归方程方差分析可知,决定系数(R2=0.992 9)接近1,说明该模型实际值与预测值拟合性较高;校正系数(R2Adj=0.983 8)较大,即表明模型可以解释98.38%的PPH微粒包埋率的变化,即大多数变异可以被该模型预测,进一步说明了回归方程拟合度较好;变异系数(0.7%)较小,表明试验可靠性较高[30]。可以用此模型对试验数据进行分析和预测。除交互因素X1X2不显著(P>0.05)外,其余项对该模型均有显著(P<0.01)作用。这说明各因素对响应值的影响不是直接线性关系[31]。交互因素X1X2不显著,即AAP与PPH的质量浓度交互作用不显著。但是交互因素X1X3和X2X3显著,即APP与PLL质量浓度以及PPH与PLL质量浓度的交互作用显著。这是由于PPH为多酚类化合物,在碱性条件(pH 8.0)下酚羟基可以失去一个质子而使基团带负电荷。而PLL为带正电荷的阳离子聚电解质,可以通过静电引力将PPH吸附,从而通过聚电解质自组装反应组装成微粒结构。但是AAP为阴离子聚电解质,也带有负电荷可与PPH分子产生静电斥力而不利于微粒的形成。所以会产生交互因素X1X2不显著而交互因素X1X3和X2X3显著的结果。

表3 回归模型方差分析Table 3 Analysis of variance (ANOVA) of regression model

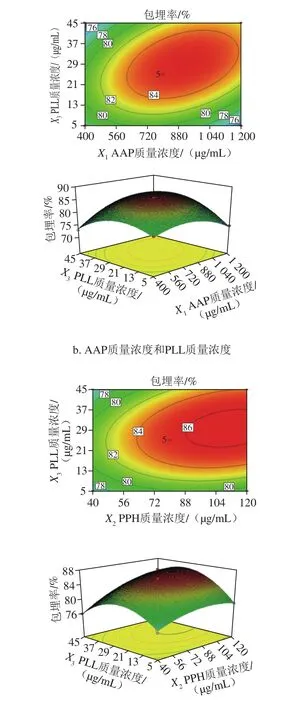
图2 各因素交互作用对PPH微粒包埋率的响应面与等高线图Fig. 2 Response surface and contour plots showing the interactive effects of factors on encapsulation efficiency
3D响应面和等高线代表两个变量之间的交互作用,以及每一变量的试验水平与响应值之间的关系[32]。图2可直观地反映各因素及其交互作用对PPH微粒包埋率的影响结果。其中等高线的形状可以反映2 个变量之间交互作用的强弱,椭圆形表示2 个变量间交互作用较强,圆形则表示较弱[33-34]。在控制2 个自变量之外的因素不变的情况下,2 个有交互的自变量对响应值的影响也可以从响应面图的曲面上看出[35]。如图2所示,从响应面的最高点和等高线可以看出,在所选的范围内存在极值,既是响应面的最高点,同时也是等高线最小椭圆的中心点。
由图2a可知,PPH和AAP质量浓度对PPH微粒包埋率的交互作用较弱。表现为PPH质量浓度变化对PPH微粒包埋率变化的影响相对较小,响应面的坡度较缓;AAP质量浓度变化对PPH微粒包埋率变化的影响较大,响应面的坡度较陡。由图2b可知,PLL和AAP质量浓度对PPH微粒包埋率的交互作用较强。表现为PLL质量浓度和AAP质量浓度对PPH微粒包埋率变化的影响均较大,响应面的坡度较陡。从图2c可知,PLL和PPH质量浓度对PPH微粒包埋率的交互作用较强。表现为PLL质量浓度变化对PPH微粒包埋率变化的影响较大,响应面的坡度较陡;PPH质量浓度变化对PPH微粒包埋率变化的影响相对较小,响应面的坡度较缓。
2.3 最优工艺条件的预测及验证
对回归方程求解,AAP质量浓度为897.82 μg/mL、PPH质量浓度为111.17 μg/mL以及PLL质量浓度为31.4 μg/mL时PPH微粒的包埋率为最大值(86.8%)。为比较实验值和预测结果的准确性,考虑到实际实验的可操作性,将最优的预测条件进行修正后对模型进行实际验证。即实际操作实验条件为AAP质量浓度900 μg/mL、PPH质量浓度110 μg/mL以及PLL质量浓度30 μg/mL,此时的PPH微粒包埋率为(86.57±1.07)%,载药量为(24.03±0.81)%。结果表明,经过响应回归方程拟合出的理论值与实际值偏差小,证明用响应面法对优化红所多酚微粒的制备工艺有指导意义。
2.4 优化后PPH微粒的形貌及其体外缓释模拟

图3 PPH微粒的形貌(A)及其体外缓释模拟(B)Fig. 3 SEM picture of pinecone polyphenols microparticles (A) and release rate of PPH in simulated gastric and intestinal environments (B)
如图3所示,微粒的直径在200~500 nm左右。无论在模拟胃环境或是肠道环境中,微粒多酚的释放量均随着时间的延长逐渐升高。但是在模拟胃环境中直到6 h后其多酚释放量也仅有(6.50±0.14)%,而在模拟肠道环境中6 h后PPH微粒的多酚释放量为(87.84±2.912)%,远大于模拟胃环境中的释放量。
3 结 论
本研究利用聚电解质自组装原理将PPH制备为PPH微粒,并且在单因素试验基础上,对响应面法制备工艺进行优化。建立AAP质量浓度、PPH质量浓度和PLL质量浓度对PPH微粒包埋率的二次回归方程模型,经验证,该数学模型可靠,可以用于PPH微粒包埋率的预测。结合单因素试验和响应面优化模型确定PPH微粒制备工艺参数为AAP质量浓度900 μg/mL、PPH质量浓度110 μg/mL以及PLL质量浓度30 μg/mL。在此最优条件下,PPH微粒包埋率为(86.57±1.07)%,载药量为(24.03±0.81)%。优化后的PPH微粒直径为200~500 nm,其在模拟胃环境中释放率较低而在模拟肠环境中释放率较高。

