青砖茶渥堆发酵中微生物的变化
张丹丹,王佳佳,朱 雯,玉 云,马煜明,高玉佩,黄友谊*
(农业部华中都市农业重点实验室,华中农业大学园艺林学学院,湖北 武汉 430070)
青砖茶为湖北特色黑茶,其外形为长砖形、干色青褐、香气纯正、汤色橙红、滋味醇和,主要销往边疆地区,其减肥[1]、降脂[2]、抗氧化[3-4]作用明显,深受消费者欢迎。目前,关于青砖茶品质分析[5-6]、香气[7-8]、功能性[9-10]及活性成分分离[11-12]等已有相关研究,但有关青砖茶渥堆发酵中微生物的研究甚少。青砖茶为微生物渥堆发酵茶叶,且微生物在渥堆发酵中占重要作用[13],是青砖茶品质形成的重要因素。陈云兰等[14]从青砖成品茶中分离到类似茯砖茶中“金花菌”的散囊菌;王波[15]对青砖茶整个加工过程中真菌及其散囊菌黄色素进行研究,表明青砖茶渥堆发酵中丝状真菌最多,细菌其次,放线菌第三,酵母最少,存在曲霉属、青霉属和散囊菌属等近10 个属的真菌;郑鹏程等[16]采用纯培养技术从青砖茶渥堆样品中分离出青霉菌属、黑曲霉、塔宾曲霉、粉红黏帚霉、篮状菌属5 株真菌,其中黑曲霉数量最多。目前仅有上述关于青砖茶微生物的研究,且不同研究因取样、不同堆层等结果各有差异。因此,对青砖茶渥堆发酵中微生物的研究十分必要,尤其是不同堆层间在不同渥堆发酵时期的微生物,本研究以期为了解微生物形成青砖茶的品质提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 茶叶
渥堆发酵的原料为一芽四五叶至一芽五六叶的晒青毛茶,原料的茶树品种为中茶108(Camellia sinensis (L.)O. Kuntze. cv. Zhongcha 108),含水量约为13.4%。
1.1.2 试剂
蛋白胨 英国Oxoid公司;琼脂 中国Biosharp公司;孟加拉红培养基 青岛高科园海博生物技术有限公司;牛肉浸膏(生物试剂)、可溶性淀粉、NaCl、NaOH、KNO3、K2HPO4、MgSO4·7H2O、FeSO4·7H2O、重铬酸钾(均为分析纯) 国药集团化学试剂有限公司。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏5.0 g、蛋白胨10.0 g、NaCl 5.0 g、琼脂20.0 g、蒸馏水加至1 000 mL,pH 7.0。121 ℃高压蒸汽灭菌20 min。
孟加拉红培养基:KH2PO41 g、MgSO4·7H2O 0.5 g、蛋白胨5 g、葡萄糖10 g、琼脂20 g、孟加拉红33.4 mg、氯霉素2 mL、蒸馏水加至1 000 mL,pH值自然。121 ℃高压蒸汽灭菌20 min。
高泽氏一号培养基:可溶性淀粉20 g、KNO31.0 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、琼脂20 g、蒸馏水加至1 000 mL,pH 7.2~7.4。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
TS型恒温摇床 上海天呈实验仪器制造有限公司;SPL-250型生化培养、GFL-125型电热鼓风干燥箱 天津市莱玻特瑞仪器设备有限公司;SPX-160B型生化培养箱上海福玛实验设备有限公司;SW-CJ-IFD型洁净工作台苏州安泰空气技术有限公司;YX-280A型手提式压力蒸汽灭菌器 合肥华泰医疗设备有限公司;HYC-310型医用冷藏箱、DW-25L262型医用低温保存箱 青岛海尔特种电器有限公司;FE20型pH计 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 青砖茶渥堆发酵
在湖北洞庄茶业有限公司渥堆发酵车间的规模化发酵生产中取样,以7.2 t中茶108晒青毛茶进行渥堆发酵。晒青毛茶含水量13.4%,后加水使茶叶含水量至40%左右,茶堆的堆高约1 m,长约10 m,宽约5 m。渥堆发酵时间为2016年7月14日—8月12日,共渥堆发酵28 d。在渥堆发酵第9天进行一翻,第19天进行二翻,第28天出堆。整个渥堆发酵时期的环境温度约31~34 ℃,空气湿度约50%~60%。
1.3.2 样品采集
渥堆发酵茶样共分上层样、中层样、下层样、混合样4 种。分别取渥堆发酵样距表层20、45、70 cm左右处3 种深度的茶样为上层样、中层样、下层样,混合样即上中下等重混合均匀的茶样,混合样的实验结果可作为上、中、下层茶样的对照,突出分层取样的作用。每层高度的茶样均按照5 点取样法进行取样,每处取样250 g左右,5 处的样品拌均匀后,按四分法取适量茶样于自封袋中,至少用两层封口袋,多余茶样放回茶堆,以-20 ℃冰箱低温保存备用。
1.3.3 青砖茶渥堆发酵样的微生物分离
称取10 g不同的渥堆发酵茶样,分别置于装有190 mL无菌水并放有小玻璃珠的250 mL三角瓶中,置摇床上以180 r/min、28 ℃振荡1 h,使微生物细胞分散,静置10 min。后吸取菌液0.2 mL于装有0.8 mL无菌水的离心管中混合均匀,即成10-2稀释液。再取10-2菌液0.1 mL移入装有0.9 mL无菌水的离心管中,即成10-3稀释液。依此类推,连续稀释,制成10-4、10-5、10-6等系列稀释度的菌液,供涂布平板用,各做3 个重复。取上述各稀释度的菌液0.1 mL于平板上,涂布均匀,待菌液渗透于培养基内后,适温培养,至长出菌落后即可计数,取其平均值。牛肉膏蛋白胨培养基用于分离细菌,于37 ℃恒温倒置培养;孟加拉红培养基用于分离霉菌、酵母,于28 ℃恒温正置培养;高泽氏一号培养基用于分离放线菌,于28 ℃恒温倒置培养。微生物数量计算如下式所示:

1.3.4 青砖茶渥堆发酵中堆温测定
每天上午10:00—10:30间测定渥堆距表层约45 cm深处的温度,测量位置同上述取样的5 点取样法,取平均值。渥堆距表层70 cm左右深处的茶叶紧实,温度计难以插入,易断,此为生产中茶叶,温度计断裂漏出的液体会影响茶叶品质。温度升高时上、中、下层温度均会一定程度有所升高,综合考虑,测量距表层45 cm左右处的温度来观察渥堆中的温度变化。
1.3.5 青砖茶渥堆发酵中水分测定
渥堆初对茶叶洒水使茶叶含水量较高,茶叶难以打磨成粉,把一芽四五叶或一芽五六叶含梗较多的茶样用剪刀剪碎,后对其进行水分测定,测定方法同GB/T 8304—2013《茶 水分测定》中的水分测定方法,其中把方法中称取的3 g茶样改为称取5 g茶叶样品进行水分测定,平均测量3 次,取平均值。
1.3.6 青砖茶渥堆发酵中pH值测定
参照Abe等[17]方法,取1 g茶样于9 mL的去离子水中,摇床180 r/min摇匀30 min后,用pH计测量pH值,重复3 次,取平均值。
1.4 数据处理与分析
每组实验均3 次重复,数据均采用Excel 2010和SPSS 19.0数据统计软件进行方差分析和显著性比较,所有数据均以 ±s表示,P<0.05,差异显著。
2 结果与分析
2.1 青砖茶渥堆发酵中霉菌动态变化

图1 部分青砖茶渥堆发酵茶样的菌落分离图Fig. 1 Microbial colonies from Qingzhuan tea samples during pile fermentation
对青砖茶渥堆发酵中的微生物进行分离计数,图1为部分青砖茶渥堆发酵茶样的菌落分离图。霉菌的动态变化如图2所示,渥堆发酵前期即一翻前,上层样中霉菌数量迅猛增加,渥堆发酵第8天时霉菌的数量上升至最大值,为1.62×108CFU/g,是渥堆原料(8.26×106CFU/g)的19.61 倍,且显著高于其他上层样以及中层样、下层样的霉菌数量(P<0.05)。一翻前中层样、下层样的霉菌数量明显降低,均低于1.00×105CFU/g;最低为中层样渥堆发酵第3天,为5.06×103CFU/g,较原料显著降低了1 632.41 倍(P<0.05);混合样为上、中、下层均匀混合的茶样,其霉菌数量介于上层样与中、下层茶样之间。一翻后,上层样的霉菌数量相比翻堆前明显下降,中层样、下层样霉菌数量均增加。随着中后期渥堆的进行,不同堆层的霉菌数量上下波动。总体来说,青砖茶渥堆发酵前期,上层样霉菌数量增加显著(P<0.05),达1.62×108CFU/g,而中、下层霉菌数量急剧减少;渥堆发酵中后期,上层样中霉菌数量降低,不同堆层的霉菌数量变化不明显,在3.60×105~1.51×107CFU/g间上下浮动。这和王波[15]所测青砖茶真菌数量趋势略有不同,但整体真菌数量值相似,其在1.6×106~9.7×107CFU/g之间。温志杰等[18]研究表明六堡茶渥堆发酵上层样的霉菌数量第12天达到最大值1.5×107CFU/g,低于本实验上层样第8天的最大值。
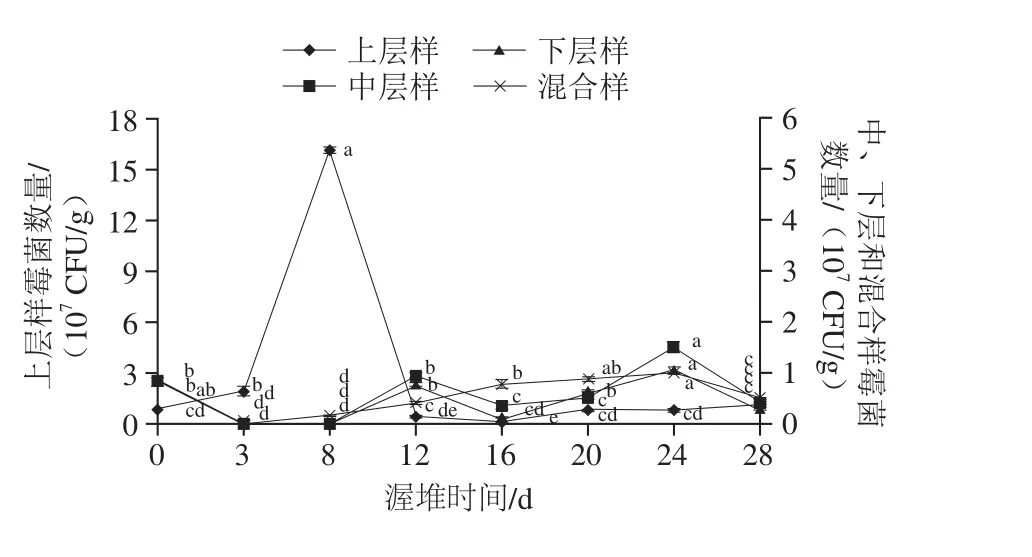
图2 青砖茶渥堆发酵中霉菌的数量Fig. 2 Changes in mold count during pile fermentation of Qingzhuan tea
2.2 青砖茶渥堆发酵中酵母动态变化

图3 青砖茶渥堆发酵中的酵母数量Fig. 3 Change in yeast cunt during pile fermentation of Qingzhuan tea
如图3所示,渥堆发酵一翻前,上层样酵母数量先增加后降低,第3天达到最大值4.42×107CFU/g,是渥堆原料(3.46×105CFU/g)的127.75 倍,且显著高于其他上层样以及中层样、下层样的酵母数量(P<0.05)。中层样、下层样的酵母数量较原料有所降低,最低为中层样,其渥堆发酵第3天时仅为3.61×103CFU/g,较原料降低了98.96%。在一翻后至二翻前,除渥堆发酵第12天的上层样中酵母数量略有增加,为1.71×106CFU/g,其他时间上、中、下层的酵母数量均较低。二翻后,不同堆层的酵母数量整体有所增加,上下波动,但均高于渥堆原料。整个渥堆过程中,酵母数量相对较低,多数时期均低于2.00×106CFU/g,这和王波[15]的结果相似,但低于温志杰等[18]的六堡茶中酵母数量。
2.3 青砖茶渥堆发酵中细菌动态变化

图4 青砖茶渥堆发酵中的细菌数量Fig. 4 Changes in bacterial count during pile fermentation of Qingzhuan tea
如图4所示,渥堆发酵一翻前,上、中、下层样中细菌数量均随渥堆发酵的进行而不断下降,且中、下层样下降更明显,均低于1.00×106CFU/g;其中中层样渥堆发酵第8天时降至最低,为1.98×105CFU/g,较渥堆原料(2.81×107CFU/g)降低了99.3%,并与渥堆原料差异显著(P<0.05)。一翻后,上层样的细菌数量较翻堆前有所下降,而中层样、下层样却有所增加,且在渥堆发酵第12天时中、下层样的细菌数量高于上层样。渥堆发酵第16天时上层样的细菌数量增加,中层样、下层样的细菌数量下降。二翻后,不同堆层的细菌数量整体增高,上层样在渥堆发酵第20天时显著增加,达到最大值3.10×108CFU/g,是渥堆原料的11.03 倍;中层样、下层样的细菌数量也在二翻后分别达到了最高点,但低于上层样中的数量。上层样的细菌数量整体高于中层样细菌数量,这同温志杰等[18]所测六堡茶渥堆发酵样的结果一致。青砖茶的细菌数量在整个渥堆发酵中普遍较高,高于王波[15]的青砖茶渥堆发酵中细菌数量3.5×104~5.9×105CFU/g。樊竹青等[19]研究发现,细菌为普洱茶整个渥堆中的优势菌,且随着翻堆次数增加细菌数量有增加趋势,与本实验细菌数量结果较相似。
2.4 青砖茶渥堆发酵中放线菌动态变化
如图5所示,渥堆发酵一翻前,上层样放线菌数量略有增加;中层样、下层样的放线菌数量下降明显,且在渥堆发酵前期保持较低浓度,均低于1.20×105CFU/g;放线菌数量在下层样渥堆第8天时达到最低值7.37×104CFU/g,比渥堆原料(1.46×107CFU/g)降低了99.5%,并与渥堆原料差异显著(P<0.05)。一翻后,上层样的放线菌数量下降,中、下层样增加;在渥堆发酵中期放线菌数量整体下降。二翻后,不同堆层的放线菌数量整体增高,似细菌,上层样中放线菌数量在出堆前达到最大值,为1.36×108CFU/g,是渥堆原料的9.32 倍,且与其他上层样差异显著(P<0.05)。

图5 青砖茶渥堆发酵中的放线菌数量Fig. 5 Change in actinomycetes count during pile fermentation of Qingzhuan tea
2.5 青砖茶渥堆发酵中堆温、含水量、pH值变化

图6 青砖茶渥堆发酵中的堆温变化Fig. 6 Changes in pile temperature during pile fermentation of Qingzhuan tea
如图6所示,渥堆发酵第9、19天时堆温明显下降,其分别为一翻、二翻时,说明翻堆可明显降低堆温。在一翻前,随着渥堆发酵的进行堆温不断升高;渥堆发酵前3 d,堆温由29.67 ℃上升至63.33 ℃,且前3 d堆温间差异显著(P<0.05),第8天时平均堆温高至68.17 ℃;这同胥伟[20]对康砖茶各个堆层温度研究结果相似,其研究表明40、80 cm堆层处的温度高于20 cm处,5 cm处的温度相比最低。一翻后,整体堆温立马下降至与室温相近,随着渥堆发酵的再次进行,堆温先升高后降低,第13天时堆温达到渥堆中期的最高值54.17 ℃,后渥堆发酵温度逐渐下降。二翻后,渥堆发酵温度基本恒定,接近环境室温,保持在30.00 ℃左右。本实验结果不同于杨瑞娟等[21]对普洱茶渥堆发酵堆温的测定结果,其所测堆温在每次(4 次)翻堆后温度都立马回升至60 ℃左右,而本实验的堆温随着翻堆次数的增加而整体下降。

图7 青砖茶渥堆发酵中的茶叶含水量Fig. 7 Changes in water content during pile fermentation of Qingzhuan tea
青砖茶渥堆发酵中的含水量随着渥堆发酵的进行不断降低(图7),这同杨瑞娟[21]、Abe[17]等测定的普洱茶渥堆发酵中茶叶含水量结果一致。青砖茶渥堆发酵的原料含水量为13.40%,对其洒水使其潮水量达40%左右后,再进行渥堆发酵。一翻前,上层样的含水量较中、下层样下降速率快,渥堆发酵第8天时降至25.66%,而中层样、下层样分别降至35.91%、36.18%。一翻后,各堆层的含水量下降速率整体较快,至渥堆发酵第16天时各堆层的含水量基本稳定在15.00%左右波动,出堆前混合样的含水量为15.20%。

图8 青砖茶渥堆发酵中的pH值Fig. 8 Changes in pH value during pile fermentation of Qingzhuan tea
青砖茶渥堆发酵过程中pH值整体在4.70~6.30之间(图8),呈酸性,同李晨晨[22]、Zhang Wei[23]等测定的普洱茶渥堆发酵中pH值。一翻前,中层样、下层样的pH值不断下降,且趋势一致,第8天时均达到渥堆发酵中的最低值,分别为4.75、4.71,且均与其他发酵时间的pH值有显著差异(P<0.05);而上层样的pH值先降低后升高,第3天时降至与中层样、下层样相同,但之后又逐渐上升。一翻后,上、中、下层样的pH值均随着渥堆发酵的进行不断增加,下层样增加较中层样稍慢些,二翻前上层样、中层样pH值均达到5.80或以上。二翻后,各堆层的pH值上下波动,但均达到过5.80以上,其中上层样在第28天时达到最大为6.33。
2.6 青砖茶渥堆发酵中微生物生长与堆温、含水量、pH值的相关性
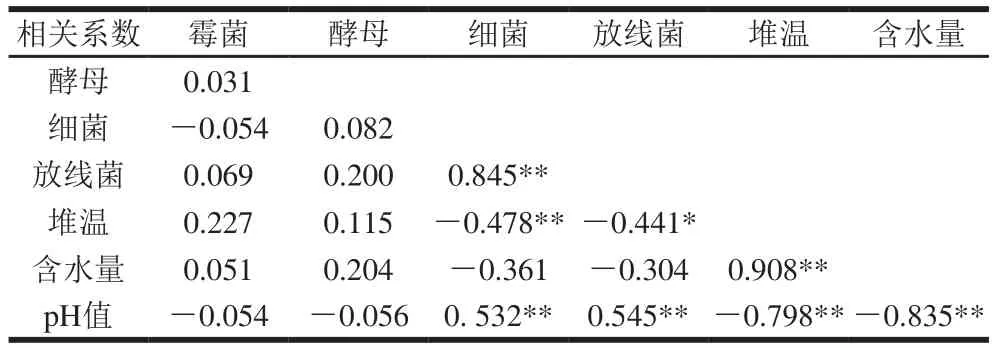
表1 微生物生长与堆温、含水量、pH值的相关系数Table 1 Correlation coefficients between microbial growth and pile temperature, water content and pH value
由表1可知,在整个青砖茶渥堆发酵过程中,细菌生长繁殖与放线菌生长繁殖、pH值之间呈极显著正相关(P<0.01),与堆温呈极显著负相关(P<0.01),与含水量无显著相关(P>0.05)。放线菌本身属于细菌,因此与细菌相似,其生长繁殖与pH值呈极显著正相关(P<0.01),与堆温呈显著性负相关(P<0.05)。堆温与含水量呈极显著正相关(P<0.01),与pH值呈极显著负相关(P<0.01);含水量与pH值呈极显著负相关(P<0.01)。但霉菌、酵母生长繁殖均与堆温、含水量、pH值无显著相关性(P>0.05)。
3 讨 论
3.1 青砖茶渥堆发酵中微生物的生长规律
青砖茶渥堆发酵中,一翻前,上层样与中、下层样间微生物差异明显,上层样霉菌数量持续增加,酵母数量先增加后降低,细菌、放线菌数量无显著差异;中、下层样霉菌、酵母、细菌、放线菌数量均急剧下降至最低。一翻后,不同堆层的茶叶被混匀,导致不同堆层的各类微生物均在一定范围内上下波动。真菌为一翻前上层样的主要菌群,细菌、放线菌为二翻后的主要菌群,这和杨晓苹等[24]、吕昌勇[25]的结果相似。然而,在青砖茶渥堆发酵过程中的菌群数量以细菌最多,放线菌、霉菌其次,酵母最少。与王波[15]对青砖茶微生物研究结果相比,其细菌变化趋势和本实验上层样相似,霉菌、酵母略有不同;王波[15]结果中放线菌少于细菌、酵母最少均与本实验结果一致,但霉菌数量差异大。上层样中霉菌、酵母、细菌的变化规律与郑云华[26]对康砖茶的研究略有差异。上、中、下层微生物变化规律与温志杰等[18]对六堡茶渥堆样中上、中、下层微生物的研究差异大。王辉[27]、温志杰[18]等的研究均表明渥堆发酵中不同层间的微生物差异明显。本实验以青砖茶渥堆的上、中、下层样为研究对象,同其他研究的混合样差异大,且多数研究的微生物变化规律类似本实验上层样非混合样。不同砖茶的渥堆发酵工艺稍有不同,且不同茶堆原料的老嫩程度、茶梗含量及取样方法的不同均可影响茶堆微生物的变化规律。因此,合理取样对研究砖茶渥堆中的微生物十分重要,也表明对不同堆层的微生物进行研究非常有必要。
本实验利用传统微生物法对青砖茶渥堆发酵中微生物浓度变化进行研究,因传统微生物法局限性只能对培养皿上可分离出活菌数进行计数,后期可对渥堆发酵过程中的样品进行宏基因组分析[28-30],从分子角度较为全面了解青砖茶渥堆发酵过程中微生物变化。
3.2 影响青砖茶渥堆发酵中微生物生长的因素
渥堆初期,对原料潮水使其含水量至40%左右,高含水量的茶叶随着渥堆进行,促使堆温不断升高,堆温与含水量呈极显著正相关(P<0.01)。渥堆上层因空气间的对流、热传递等作用,使其通氧量大、温度适宜,加上适宜的水分、酸碱度(霉菌[31]、酵母[32-33]生长最适pH值约为4.0~6.0),为霉菌、酵母提供了良好的生存条件,故霉菌、酵母大量繁殖。酵母一般在高于40 ℃的温度下难以生长[32-34],渥堆发酵第3天堆温升至60 ℃及以上,其表层温度也随之增加,故3 d后酵母数量有所下降。不同霉菌其适宜温度差异大,部分耐热霉菌的致死温度高达65 ℃或以上[31],故上层样中霉菌数量能随着渥堆进行不断增加。一翻前,中、下层样的温度高达60 ℃及以上,pH值随堆温的升高不断下降,pH值与堆温呈极显著负相关(P<0.01),处于酸性环境(pH 4.7~5.1),这种高温、酸性、低氧的条件不适合大多数微生物生长,促使各类微生物的数量降至最低。一翻后,茶叶含水量、堆温明显下降,且pH值、微生物菌群被充分混匀,堆中作用复杂,局部出现类似一翻前上层样适合真菌的生存条件及中、下层不利微生物的生长条件,综合作用下,不同层间的霉菌、酵母、细菌、放线菌均在一定范围内上下波动。二翻后,茶叶含水量稳定在15%左右,堆温保持在30 ℃左右,较低的含水量、30 ℃适宜的温度、偏中性的环境为细菌提供了良好的生存环境,使细菌、放线菌大量繁殖,也因此细菌、放线菌繁殖与pH值呈极显著正相关(P<0.01),与堆温呈显著性负相关(P<0.05)。
3.3 青砖茶渥堆发酵品质形成的机理
青砖茶渥堆发酵前期,上层样主要以真菌作用为主,在微生物及其酶的作用下,可促使青砖茶逐步形成陈香[7]、滋味醇和[6]的特点;中、下层样微生物极少,以湿热反应为主,湿热反应可促使酚类化合物的异构化和热裂解,提高没食子酸的含量,降低茶叶pH值[35-36],形成干茶的红褐色泽。一翻后,上、中、下层茶样混匀,微生物菌群可利用酚类化合物的降解物,或分解复杂化合物,在微生物作用、酶反应、湿热反应的综合作用下改善青砖茶茶叶品质[37-38]。渥堆后期,细菌、放线菌过度繁殖,在细菌作用为主的同时,也可增加茶叶污染致病菌的概率[39],后期可对青砖茶安全性进行深一步研究,为消费者提供安全健康的青砖茶。
4 结 论
青砖茶渥堆发酵过程中,不同堆层间微生物数量差异大,尤其一翻前上层样与中、下层样微生物差异显著,上层样的酵母、霉菌数量分别增至最大,但中、下层样的各类微生物数量均降至最低。一翻后,不同堆层的各类微生物随着渥堆进行均在一定范围内上下波动。真菌数量在一翻前上层样相对高湿、高温的环境下达至最大,细菌、放线菌数量在渥堆后期较为干燥、相对较低的温度下达至最大,渥堆发酵茶叶中的温湿度会直接影响不同类微生物的数量。翻堆对青砖茶渥堆发酵相当重要,可一定程度控制霉菌数量,避免堆温过高烧坏茶叶,并使上、中、下层茶叶中的各类微生物均匀分配,达到生产上渥堆发酵均匀的目的。另外,实验也证明了分层取样对了解青砖茶渥堆发酵过程中的微生物变化十分必要。

