柞蚕微孢子虫体外培养技术体系的建立
岳冬梅,王林美,李佩佩,叶 博,赵振军,张 波,李树英,范 琦
(辽宁省海洋水产科学研究院/大连生物技术研究所,辽宁大连 116024)
柞蚕(Antheraeaepemyi)为鳞翅目大蚕蛾科柞蚕属昆虫,是我国特有的昆虫资源,有着悠久的放养历史。作为我国传统的食用昆虫、泌丝昆虫及工业原料,柞蚕为国家外贸的增长和人们生活水平的提高做出了重大贡献。然而,柞蚕业的发展受到柞蚕微粒子病的困扰,柞蚕微粒子病在丝茧生产上一般年份的发病率为30%~70%,有些年份可高达90%以上[1],给柞蚕生产带来了重大的经济损失,蚕农每年损失达上亿元。因此,迫切需要探明微粒子病病原的发育特点、侵染方式和分子特征,从而建立更有效的微粒子病防控体系,减少柞蚕业损失。
柞蚕微粒子病现已证实是由微孢子虫(Microsporidium)侵染柞蚕导致,微孢子虫属微孢子门微孢子目,是专性细胞内寄生的单细胞真核生物[2],无法直接进行离体培养,只能通过细胞及活体材料等进行培养、增殖。已报道微孢子虫属超过150个、种超过1 400个[3],宿主范围包括脊椎和无脊椎动物。目前研究发现,柞蚕微粒子病主要病原除柞蚕微孢子虫(Nosemapernyi,Np)外,还有柞蚕微孢子新种(Nosemasp)、修饰内网虫(Endoreticulatusschubergi)、讷卡变形孢虫(Vairimorphanecatrix)和链孢变形孢虫(Vairimorphachainsporum)[4-5]。
在细胞和分子水平上分析微孢子虫种株及发育机制是开展早期检测、预防及开发治疗药物的基础,因而建立柞蚕微孢子虫有效的体外培养方法,分离感染柞蚕的不同微孢子虫株,建立柞蚕微孢子虫分离、培养和保存的技术体系十分必要,这将加快对柞蚕微孢子虫发育特点、侵染方式及分子特征的了解,从而有效提升柞蚕微粒子病的控制,降低柞蚕业损失。
1 材料与方法
1.1材料和主要仪器设备柞蚕品种为二化性青六号,凤城蚕业研究所提供。相差倒置荧光显微镜(Leica,德国);超净工作台(苏州苏净集团);低速离心机(上海安亭科学仪器厂);生化培养箱(上海一恒科学仪器有限公司);细胞培养瓶及吸管(江苏江阴科学器材公司)。TC-100培养基购自德国PAN公司;胎牛血清(fetal calf serum,FBS)购自美国Hyclone公司;青链霉素混合液(青霉素、链霉素各10 000 单位/mL)购自北京索莱宝科技有限公司;柞蚕微孢子虫为研究室制备。
1.2柞蚕微孢子虫的分离
1.2.1接种用柞蚕微孢子虫的制备。将野外采集的发病材料参照姜义仁等[6]的方法,经Percoll密度梯度离心法精制微孢子虫,生理盐水调制成浓度为108个/mL孢子悬液,置于4 ℃冰箱内保存备用。
1.2.2柞蚕微孢子虫添食柞蚕。饲养柞蚕至5龄起蚕,按照每头蚕添食 600个柞蚕微孢子虫的用量,将制备好的微孢子虫混悬液稀释成6×104个/mL,取10 μL孢子液涂抹在约2 cm2的柞叶上,每头蚕饲喂1片叶进行添食,而后正常放养柞蚕直至上簇结茧。
1.2.3原代细胞培养法分离柞蚕微孢子虫。将感染柞蚕微孢子虫的蚕蛹,用75%乙醇浸泡15 min,于超净台内无菌水冲洗2~3次,放置于无菌纱布上吸干体表水分。无菌操作剪开腹部,取柞蚕蛹单个卵巢或精巢组织,于无菌的盛有生理盐水的小平皿中,剔除卵巢或精巢上粘连的脂肪组织和被膜等,放置于200目灭菌不锈钢MLM-筛网上,无菌小棒研磨,用400 mL的TC-100培养液冲洗,接种于48孔细胞培养板(底面积为0.7 cm2/孔)中,置于 27 ℃生化培养箱中静置培养,每天利用相差倒置荧光显微镜观察细胞生长及孢子增殖情况,5~7 d后筛选出有孢子增殖的无其他污染物的柞蚕原代细胞。
1.3柞蚕微孢子虫在卵巢原代细胞中的扩繁
1.3.1柞蚕正常卵巢原代细胞的制备。取多个健康柞蚕雌蛹,用75%乙醇浸泡15 min,于超净台内无菌水冲洗2~3次,放置于无菌纱布上吸干体表水分。无菌操作剪开腹部,用眼科剪刀和镊子解剖取出卵巢组织,放置于盛有无菌生理盐水的小平皿中,剔除卵巢上粘连的脂肪组织和被膜等,再将卵巢转移至盛有无菌生理盐水的小烧杯中,洗涤3次。将卵巢组织剪成0.5~1.0 mm3大小的组织块,加细胞培养液,用灭菌吸管温和抽吸后,直接将悬液连同组织块一起接种于6孔细胞培养板中,将小块均匀涂布于板底[7]。一般每孔接种10~15个卵巢为宜,然后于培养孔中加入适量培养基,27 ℃静置培养,5~7 d更换1/3培养液。
1.3.2柞蚕微孢子虫在卵巢原代细胞中的扩大培养。将单个卵巢或精巢组织培养的柞蚕微孢子虫悬液,每5~7 d按1∶2的比例加入健康蛹制备的生长状态良好的柞蚕卵巢原代细胞中,用吸管轻轻混匀后,27 ℃生化培养箱中静置培养,每天观察微孢子虫增殖扩繁情况。
1.4柞蚕微孢子虫在柞蚕蛹中的扩繁将通过卵巢原代细胞培养增殖出的微孢子虫培养液,5 000 r/min离心5 min,去上清,加入500 μL 0.2 mol/L的KOH溶液,静置于27 ℃条件下发芽40 min[8],然后用生理盐水调孢子浓度至1×106个/mL,蛹体表面乙醇消毒,然后用一次性无菌注射器注射柞蚕健康蛹,每个蛹注射100 μL,将未经发芽处理的孢子,生理盐水调浓度至1×106个/mL,直接注射柞蚕蛹作为对照组,室温下培养7 d后,转入4 ℃低温保存。
1.5柞蚕微孢子虫的继代和保存低温保存的微孢子虫注射蛹,依次用75%乙醇浸泡15 min、无菌水冲洗2~3次。无菌条件下取柞蚕蛹单个卵巢或精巢组织,按“1.2.3”中方法制备原代细胞。27 ℃静置培养,待微孢子虫增殖后,即分离到柞蚕微孢子虫一代,然后再次采用单卵巢(精巢)制备原代细胞分离孢子、正常卵巢原代细胞扩繁孢子和注射柞蚕健康蛹继代保存微孢子虫的交替方法,实现柞蚕微孢子虫株(系)的分离、继代、扩繁及保存。
2 结果与分析
2.1柞蚕微孢子虫的分离及在原代细胞中的扩大培养采用单个精巢或卵巢制备原代细胞,分离培养柞蚕微孢子虫的方法,分离筛选出无其他污染物的柞蚕微孢子虫,结果如图1所示。图1C和图1D分别是经过5~7 d培养后,单个精巢和单个卵巢组织制备的原代细胞中培养增殖出的微孢子虫情况,可见2种原代细胞均可以培养增殖出柞蚕微孢子虫。

注:A.单精巢制备的原代细胞;B.单卵巢制备的原代细胞;C.单精巢原代细胞分离培养的柞蚕微孢子虫;D.单卵巢原代细胞分离培养的柞蚕微孢子虫Note:A.Primary cells prepared from single testis;B.Primary cells prepared from single ovary;C.Isolation and culture of N. pernyi from single testis primary cells;D.Isolation and culture of N. pernyi from single ovary primary cells图1 柞蚕微孢子虫的分离培养Fig.1 Isolation and culture of N. pernyi
将分离培养出的柞蚕微孢子虫在正常卵巢原代细胞中进行扩繁培养(图2A),柞蚕微孢子虫可以继续感染原代细胞,进而大量增殖扩繁。
柞蚕卵巢原代细胞的培养方法最为成熟,且细胞状态好,不易褐化死亡,存活时间较长,利于微孢子虫的增殖。将分离培养出的柞蚕微孢子虫在正常卵巢原代细胞中进行扩大培养(图2B),柞蚕微孢子虫可以在原代细胞中不断扩繁,5~10 d增殖速度较快,15~20 d增殖速度变缓,变缓原因可能与原代细胞后期状态变差、部分细胞死亡有关。

图2 柞蚕微孢子虫在卵巢原代细胞中的扩大培养Fig.2 Expansion culture of N. pernyi in ovary primary cells
2.2柞蚕微孢子虫在柞蚕蛹中的扩繁图3为柞蚕蛹注射了柞蚕微孢子虫后,其精巢和卵巢原代细胞增殖培养微孢子虫情况,结果表明,孢子注射蛹体后可以继续感染蛹的精巢和卵巢组织,且分离的精巢和卵巢原代细胞可以大量增殖出柞蚕微孢子虫。

注:A.精巢原代细胞;B.卵巢原代细胞Note:A.Primary culture of testis cells;B.Primary culture of ovary cells图3 注射孢子后柞蚕蛹的单卵巢(精巢)原代细胞分离增殖的柞蚕微孢子虫Fig.3 Isolation and proliferation of N. pernyi from primary cells of single ovary(testis)of A. pernyi pupa after injecting spore
表1为不同保存温度条件下柞蚕蛹中微孢子虫增殖情况,结果表明,4 ℃存放条件下柞蚕微孢子虫对蚕蛹感染率低且增殖十分缓慢;22 ℃存放条件下柞蚕蛹孢子可以在蛹中快速大量增殖,有利于短期内获得大量微孢子虫,但柞蚕蛹发病严重容易死亡,进而不利于孢子的长期储存;在22 ℃条件下放置7 d后,转入4 ℃存放条件下柞蚕微孢子虫可以高效感染柞蚕蛹,且微孢子虫在蛹中缓慢增殖,对柞蚕蛹影响较小,有利于微孢子虫的长期储存。

表1 柞蚕微孢子虫在柞蚕蛹中的扩繁情况
注:变温表示22 ℃培养7 d后转入4 ℃;柞蚕蛹初始注射浓度为1×106个/蛹
Note:Variable temperature means 22 ℃ training after 7 days to 4 ℃,initial injection concentration ofA.pernyipupa was 1×106spores/pupa
2.3柞蚕微孢子虫的保存图4为储存不同时间后柞蚕微孢子虫的发芽情况,注射前微孢子虫发芽率为52.41%,注射后的柞蚕蛹在4 ℃储存90 d与180 d的微孢子虫发芽率分别为65.68%、64.84%,二者发芽率没有明显差别,并较注射前微孢子虫发芽率略高,说明微孢子虫在蛹体储存过程中保持较好活力,可长期保存。
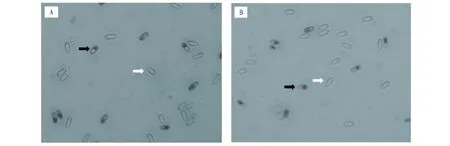
注:A.保存90 d;B.保存180 d;黑色箭头为未发芽微孢子虫;白色箭头为发芽后微孢子虫Note:A.Keep for 90 days;B.Keep for 180 days;Black arrow.Ungerminated spores;White arrow.Germinated spores图4 柞蚕蛹中储存的柞蚕微孢子虫发芽情况(400×)Fig.4 Germination of N. pernyi stored in A. pernyi pupa(400×)
图5是不同保存条件下储存90 d后,柞蚕微孢子虫的发芽情况,储存于0~4 ℃活蛹体内的柞蚕微孢子虫发芽率达65.68%,远远高于其他储存条件下微孢子虫的发芽率,表明在4 ℃低温活蛹储存条件下,最有利于微孢子虫活力的保持。

注:1.4 ℃保存,柞蚕蛹体;2.4 ℃保存,生理盐水;3.-20 ℃保存,生理盐水;4.液氮保存,生理盐水;5.液氮保存,30 %甘油;6.液氮保存,10%DMSONote:1.4 ℃ cryopreservation,pupa;2.4 ℃ cryopreservation,physiological saline;3.-20 ℃ cryopreservation,physiological saline;4.Liquid nitrogen cryopreservation,physiological saline;5.Liquid nitrogen cryopreservation,30% glycerin;6.Liquid nitrogen cryopreservation,10% dimethy sulfoxide图5 不同保存条件下柞蚕微孢子虫发芽率Fig.5 The germination rate of N. pernyi under different preservation conditions
3 讨论
目前家蚕微孢子虫株分离及体外培养的相关研究已取得了很多进展,但柞蚕微孢子虫在这方面的研究鲜有报道。家蚕微孢子虫株的分离,多采用幼虫期添食微孢子虫,染病家蚕在室内人工饲养传代,微孢子虫在家蚕体内不断增殖,经过多代传代培养后,继而分离出优势的微孢子虫株。然而,柞蚕不同于家蚕,它是野外放养昆虫,生长环境复杂,室内饲养很难成活,因而无法采用这种方法分离微孢子虫的纯净株,且这种方法周期长,费时费力,添食不当或环境污染等因素很容易引起其他微孢子虫株的二次污染。
家蚕微孢子虫株体外培养方面,现在主要通过稳定的家蚕细胞系和可被家蚕微孢子虫侵染的其他昆虫细胞系来实现。这种方法需要先从家蚕体中获得家蚕微孢子虫,让其侵染细胞,随着细胞的传代培养,微孢子虫在细胞内不断增殖,经过多代培养后逐渐分离出家蚕微孢子虫株,并随着细胞继代培养而保存下来,从而实现家蚕微孢子虫的分离、培养及保存[9-12]。但这些方法的首要前提是需要稳定的细胞系且该细胞系能被微孢子虫感染、微孢子虫在侵染细胞后能在细胞中不断增殖。
柞蚕微孢子虫株分离及体外培养技术的建立存在相当大的难度,因为尚未有稳定地柞蚕细胞系建立,虽然柞蚕卵巢细胞已被公开能被柞蚕微孢子虫侵染,但其继代培养十分困难,难以使柞蚕微孢子虫长期稳定地进行传代、增殖。同时,前期工作显示柞蚕微孢子虫在其他昆虫细胞系sf21、High5和BmN中不能侵染和增殖,因而通过侵染细胞、进行细胞传代培养来实现柞蚕微孢子虫株(系)的培养、增殖及保存,借鉴现有技术很难实现。
该研究采用柞蚕精巢或卵巢原代细胞增殖柞蚕微孢子虫。柞蚕精巢或卵巢原代细胞是从柞蚕体内分离,是柞蚕微孢子虫的天然宿主细胞,因而具备柞蚕微孢子虫感染增殖的最佳条件,相较其他异源细胞更适于孢子侵染增殖[13-14]。利用柞蚕蛹进行柞蚕微孢子虫的增殖培养及保存,相比现行依赖细胞系的技术具有显著优势:①作为柞蚕微孢子虫继代培养、保存的载体,材料易得,储存容易,便于操作。柞蚕是野外放养的变态昆虫,1年可放养1~2次,以蛹期滞育越冬,因而可以长期储存,低温条件下柞蚕蛹最长可储存1年之久。以柞蚕蛹进行柞蚕微孢子虫的培养及保存,显著降低科研工作者劳动量,节约资源。②较其他生物材料而言,柞蚕蛹期体积较大且不能运动,易于操作,便于宿主大规模增殖、保存微孢子虫。③柞蚕蛹无需进食,蛹体内部是独立封闭的空间,不易受外界环境干扰,从而保证了体内培养和储存的微孢子虫的纯净度。④相比依赖细胞系培养、保存微孢子虫的现有技术而言,柞蚕蛹作为生物材料,存活时间长,培养、保存的柞蚕微孢子虫活力强,不易退化[15]。
该研究建立的柞蚕微孢子虫体外培养技术体系能逐渐分离得到柞蚕微孢子虫的不同株,并使柞蚕微孢子虫得以扩繁和长期保存,这将加速柞蚕微孢子虫的侵染机制、功能基因组学、流行病学等相关研究,从而创新柞蚕微粒子病防控技术手段,显著降低柞蚕业经济损失,提升我国柞蚕业产值。

