外源性二磷酸果糖在脑组织损伤中的保护作用
乔瑞峰,汪明慧,解旭东
(1.陆军总医院卫生干部训练中心,北京 102300; 2.北京卫戍区西城第一离职干部休养所门诊部,北京 100055; 3.解放军第二五二医院神经内科,河北 保定 071000)
糖是绝大部分细胞能量的主要来源,其通过有氧和(或)无氧酵解生成ATP,为细胞活动提供最基本的能量[1]。1,6-二磷酸果糖( fructose-1,6-diphosphate,FDP)是细胞内糖酵解过程中产生的重要的中间代谢产物,是高效的糖分解媒介,具有促进糖酵解、提高糖酵解效率,调节细胞内K+、Ca2+等离子流动,维护细胞膜和溶酶体膜稳定性等作用[2-3]。FDP作用广泛,在多种细胞和组织如脑、肾、肠、肝、心脏等中能抵御损伤因素,发挥保护作用,还可降低败血症患者的病死率[4]。早在20世纪80年代就有研究证实,外源性FDP可通过血脑屏障被脑组织利用,并对脑组织功能有保护作用[5]。自此,学术界开始从不同角度、不同个体对外源性FDP进行研究,结果证实,外源性FDP在缺血、缺氧导致的脑损伤、一氧化碳中毒后脑损伤、高热惊厥、癫痫发作等过程中均发挥了确实有效的脑保护作用[6-7]。同时临床研究还发现,在用药过程中外源性FDP具有较低的毒性作用和配伍禁忌,可采用口服或静脉给药,适用人群范围较广[8],具有较高的临床应用价值。现就FDP在脑组织损伤中的保护作用进行综述。
1 缺血、缺氧后脑损伤机制
脑组织是人体代谢最为活跃的器官,正常情况下,脑组织的耗氧量占人体总耗氧量的1/4,且脑组织几乎无能量储备,因而脑细胞对缺血、缺氧的耐受性极低。缺血、缺氧30 s,脑细胞的代谢就发生改变,1 min后神经元活动停止,5 min后脑组织出现坏死[9]。缺血、缺氧导致脑损伤的机制主要有以下几种。
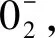
1.2细胞内Ca2+超载 正常情况下,神经系统信号的转导依赖于突触介导的受体活化和释放神经递质的突触后膜细胞内离子的可调控性。离子的跨膜运动受能量依赖性N+,K+-ATP酶的精密调控。脑细胞发生缺血、缺氧损伤后,细胞膜的功能出现一过性受损,细胞内离子的水平和突触递质分布异常,导致细胞膜的电势发生变化,Ca2+大量内流,导致细胞内Ca2+超载。Ca2+超载激活线粒体的Ca2+摄入,引起线粒体功能障碍,促进氧自由基生成,激活Ca2+依赖性降解酶,导致细胞结构损伤和代谢功能障碍[12]。在脑细胞受损的动物模型中,采用同位素标记Ca2+(45Ca2+),在细胞损伤后6 h可检测到细胞内45Ca2+的水平升高,4~7 d后45Ca2+的水平恢复正常[13]。细胞内Ca2+超载被认为是一系列级联事件如糖代谢异常、线粒体功能受损、氧自由基生成增加等的重要诱发因素。此外,Ca2+超载也与脑损伤后的认知障碍有关[13]。
1.3炎症反应加重 炎症反应贯穿于缺血、缺氧导致脑损伤的全过程,在损伤急性期及慢性恢复过程中,损伤区及损伤周围边缘带均检测出显著高表达的炎性细胞[14]。在缺血性卒中死亡者的脑组织病理切片中发现了炎性细胞浸润[15-17]。在脑缺血、缺氧发生的24 h内,脑细胞受损或死亡触发了炎症反应,并导致了继发性二次损伤。脑组织固有炎性细胞——小神经胶质细胞被激活,从而生成更多的促炎性细胞因子,使黏附分子聚集在脑血管内;趋化因子促使炎性细胞进入损伤区及周围边缘带;血管内皮上附着的黏附分子吸附了更多的白细胞,造成微循环堵塞,同时血管通透性增加,促使炎性细胞外渗至脑实质[18]。激活的炎性细胞合成多种细胞毒性因子,如促炎性细胞因子、基质金属蛋白酶、一氧化氮、氧自由基等,破坏了血脑屏障及细胞外基质,导致了脑实质的二次损伤。
1.4高能磷酸化合物(high-energy phosphate,HEP)缺乏 机体内存在一些含有磷酸基团的化合物,如ATP、磷酸肌酸、3-磷酸甘油酸、氨甲酰磷酸、磷酸烯醇式丙酮酸等,磷酸基团水解时可释放出较多的自由能,因此被称为HEP。磷酸肌酸的作用类似于HEP的蓄水池,在肌酸激酶的作用下,ATP转化为磷酸肌酸,当能量需求增加时,磷酸肌酸再转化为ATP,直接参与能量代谢。脑组织发生缺血、缺氧时,导致氧化磷酸化脱偶联和HEP缺乏,同时因自由基生成过多造成线粒体损伤。氧化磷酸化脱偶联导致ATP生成减少,腺苷、肌苷、次黄嘌呤等也相应减少,使得HEP底物减少,这又进一步加重了ATP的减少[19]。参与细胞能量代谢的物质减少,势必影响细胞的能量供给,导致细胞受损或死亡,从而造成脑组织损伤。
2 外源性FDP脑保护作用的机制
外源性FDP的脑保护作用与改善无氧糖酵解效率、稳定细胞膜、调节细胞内Ca2+水平密切相关[20-21]。此外,细胞内信号转导通路也参与了外源性FDP脑保护作用中Ca2+水平的调节过程,但这方面的机制还有待进一步研究[22]。外源性FDP在多种脑损伤模型中均表现出脑保护作用[23-24]。早期研究显示,外源性FDP可抑制兴奋性神经毒素导致的神经元坏死,且这种保护作用呈剂量依赖性,其可能是通过p38丝裂原激活蛋白激酶/胞外信号调节激酶通路减少自由基的生成而发挥作用,但具体的机制尚不清楚[25]。对炎症引起的脑细胞损伤的研究发现,FDP参与了黏附分子在脑内皮细胞的表达,这与FDP调控的脂肪多聚糖诱导的黏附分子和白细胞在脑内皮细胞中的表达以及对核因子κB活性的抑制有关,髓样分化因子88和β干扰素TIR结构域衔接蛋白依赖的信号转导通路也参与了炎症引起的脑细胞损伤过程[6]。在猪获得性脑缺血模型中,静脉注射外源性FDP后,脑组织中乳酸/丙酮酸的比例下降,脑组织中丙酮酸的水平升高;缺血后8 h,乳酸水平开始下降[26]。提示外源性FDP通过参与脑细胞代谢改善脑缺氧。用外源性FDP孵育缺血的突触体发现,外源性FDP可降低细胞内游离Ca2+的水平,降低一氧化氮的水平[12]。
3 外源性FDP脑的保护作用
3.1脑缺血 外源性FDP对缺血、缺氧的脑组织有保护作用,可降低脑损伤的程度和死亡率。人为阻断大鼠大脑中动脉后给予外源性FDP显示出较好的脑保护作用[27]。对低温造成的猪脑损伤模型的研究显示,外源性FDP注射组7 d存活率为83.3%(10/12),而氯化钠注射组为41.7%(5/12);与氯化钠注射组相比,外源性FDP注射组行为障碍较轻,静脉血中肌酸激酶同工酶的水平及颅内压明显低于氯化钠注射组,而脑组织中葡萄糖和丙酮酸的水平显著高于氯化钠注射组[28]。我国早在2001年就对外源性FDP治疗急性脑梗死的有效性和安全性进行了多中心、随机双盲临床试验,入选对象为发病72 h内的急性脑梗死患者,给予患者外源性FDP治疗21 d。该研究认为,外源性FDP是治疗急性脑梗死安全有效的药物,且患者的耐受性良好[29]。研究发现,给予缺氧导致脑损伤的新生儿14 d外源性FDA治疗后,外源性FDP组新生儿行为评分、糖原磷酸化同工酶测定值及头颅磁共振成像等多项检测指标明显优于安慰剂组[30]。
3.2抗惊厥 反复热性惊厥可使大脑处于缺氧状态,致使脑细胞能量代谢障碍,ATP生成不足,最终导致神经元细胞受损。动物实验发现,在惊厥过程中无论是给予静脉剂型还是口服剂型的外源性FDP都具有很好的脑保护作用,且效果呈剂量依赖性[31]。究其原因,一方面可能与药物透过血脑屏障,改善了脑细胞代谢有关;另一方面,脑组织中葡萄糖的磷酸戊糖途径较其他组织更为活跃,这一途径生成了还原性烟酰胺腺嘌呤二核苷酸磷酸,后者可生成谷胱甘肽,而内生型谷胱甘肽具有抗惊厥的作用[32]。
3.3一氧化碳中毒 低水平的一氧化碳作为神经调质发挥第二信使的作用,还具有一定的脑保护作用;而高水平的一氧化碳可对脑组织造成急性及延迟性严重、不可逆性损伤[33]。在大鼠一氧化碳中毒模型中,海马趾神经元细胞线粒体的超微结构被严重破坏,线粒体膜电位降低[34]。炎症反应也参与了一氧化碳导致的急性脑损害,在一氧化碳中毒大鼠的海马趾中检测到高水平表达的炎性细胞因子[34]。一项关于大鼠急性一氧化碳中毒的研究显示,给予不同剂量的外源性FDP能较好地降低急性一氧化碳中毒后的死亡率,减少记忆力减退的发生,同时还可以保护Ca2+-Mg2+-ATP酶的活性,减少海马趾神经坏死[35]。
3.4抗癫痫发作 外源性FDP具有抗癫痫的作用,但具体作用机制尚不完全明确。在诱导的颞叶癫痫发作的动物模型中给予外源性FDP后,诱发癫痫所需的诱发剂量增加,发作后间期延长,这可能是因为外源性FDP调节了神经细胞特异性K+-Cl-协同转运蛋白2与Na+-K+-Cl-协同转运蛋白1之间的平衡,抑制了癫痫诱导的K+-Cl-协同转运蛋白2表达的下降,降低了癫痫发作时Na+-K+-Cl-协同转运蛋白1的表达,从而起到了保护癫痫发作时海马趾神经的作用[36]。最近的研究发现,在离体癫痫模型中,FDP的抗癫痫样作用与非特异性Ca2+通道阻滞有关,在不影响Ca2+通道活性的前提下ICa的活性减少40%[37]。
3.5对未成熟脑的保护作用 与成熟大脑相比,未成熟大脑对缺血、缺氧的耐受性较差,其病理损伤也不同于成熟大脑。国外学者研究发现,给予外源性FDP预处理的未成熟动物大脑可减低高热惊厥造成的脑损伤程度,对有害物质的反应性也降低[38]。国内研究表明,在未成年动物的高热惊厥模型中,诱导惊厥发作前腹膜腔分别注射低剂量和高剂量的外源性FDP,结果显示,高剂量组惊厥发作的程度明显减轻、惊厥持续时间缩短;电镜下显示,高剂量组脑海马趾CA1区细胞线粒体肿胀程度和内质网脱颗粒程度均减轻,突触活动区域长度增加,突触面曲度增加[39]。
4 DP的药动学
外源性FDP通常以钠盐、钙盐或锌盐的形式存在,有稳定的注射剂型,也有口服的片剂、胶囊、冲剂及口服液等。临床常用的外源性FDP有注射用果糖二磷酸钠和口服果糖二磷酸钠两种剂型[40]。
外源性FDP进入体内后广泛分布在机体的多个组织器官中。研究发现,经腹膜给予成年大鼠外源性FDP 0.5 g/kg后,可在大鼠的血、脑、肝、肾、肌肉以及脂肪组织中检测到FDP,且血液和脑组织中的水平相近,说明注射外源性FDP可顺利通过血脑屏障;12 h后肝、肾、肌肉以及脂肪组织中的FDP达到基线水平,而血液和脑组织中FDP的水平虽较峰值下降,但仍高于基线水平[41]。张力等[42]给予大鼠尾静脉注射FDP-Mg2+,采用酶法测定FDP和Mg2+的血药浓度,结果发现,FDP-Mg2+进入生物体后解离为FDP和Mg2+,并按照各自固有的药动学特点在体内消除,FDP进入生物体后,广泛分布于全身体液,呈线性消除,血浆半衰期为8~10 min。国外研究显示,FDP钠盐静脉注射后,10 min后大鼠体内的血药浓度达高峰,20 min后放射活性最高的器官是肾脏,其余依次为肝、小肠、肌肉、肺、脑、心[43]。对口服FDP在活体中的药动学特点进行研究发现,口服低剂量时,血清药物时间曲线显示不出明显的血药浓度峰值,只有口服大剂量时才能检测到明显的血药峰值[8]。考虑口服剂型进入体内后,在吸收过程中存在肠道损耗,提示口服治疗时,需选择大剂量。
5 FDP的不良反应
FDP的不良反应较小。王淑梅和张胜利[44]对256例公开报道的外源性FDP相关性药物不良反应进行总结和分析,结果显示,静脉用药最常见的不良反应是药物对血管的局部刺激和输液部位疼痛,占46.4%;其次是过敏反应如荨麻疹、皮肤瘙痒、药疹、过敏性哮喘等,占23%;其他少见的不良反应包括腹胀、痛风、口周麻木、头痛等;严重不良反应极少发生。有报道输注外源性FDA后可发生变应性休克、呼吸骤停及窦性停搏,但未有致死性病例报道[45]。
临床应用过程中出现的不良反应主要以局部刺激症状和皮肤损害等轻微不适为主,严重致死性不良反应极为少见。药物本身的不良反应还与患者的个体差异、肝肾功能以及滴注速度有关。宋立江等[45]对果糖二磷酸钠做的毒理学评价显示,口服剂型的果糖二磷酸钠在低、中剂量时(1.67 g/kg、3.33 g/kg)对大鼠的生长发育无影响,病理学检查示肝、胃、十二指肠、肾脏等器官无异常;服用大剂量(6.67 g/kg)果糖二磷酸钠后,大鼠生长迟缓,病理切片示肝脏和肾脏均有不同程度损害。
国家第5批化学药品说明书显示,以0.4 g/min和0.6 g/min的速度静脉滴注FDP,实验用大鼠和兔的致死量分别为5.0 g/kg和5.8 g/kg。不同给药途径的致死量差异极大。本品注射速度宜缓慢,目前推荐以不超过0.5 g/(kg·h)为宜。急性毒性反应可能与大剂量FDP水解后大量无机磷进入血液有关。在配伍禁忌方面,注射用果糖二磷酸钠与注射用磷霉素钠、注射用奥美拉唑钠、注射用呋塞米存在配伍禁忌[46]。
6 小 结
FDP是糖无氧代谢过程中的重要中间媒介,是高效的糖分解媒介,具有促进糖酵解、提高糖酵解效率、调节细胞内K+、Ca2+等离子的流动、维护细胞膜和溶酶体膜的稳定性等作用。由此演化而来的外源性FDP通常以钠盐、钙盐或锌盐的形式存在,有稳定的注射剂型,口服的片剂、胶囊、冲剂及口服液等。外源性FDP经不同的给药途径进入体内后,广泛分布在机体的多个组织器官中,且可顺利通过血脑屏障,在神经系统缺血、缺氧、高热惊厥等损伤性疾病中有良好的治疗作用。基础和临床试验从不同角度证实外源性FDP在多种脑损伤中具有积极的保护作用,作用机制包括减少自由基生成,抑制Ca2+超载。炎症反应贯穿了脑损伤的整个过程,外源性FDP可减轻炎症反应造成的二次损害。目前已经明确,多条细胞信号转导通路参与了外源性FDP的保护作用,包括p38丝裂原激活蛋白激酶/胞外信号调节激酶、髓样分化因子88以及β干扰素TIR结构域衔接蛋白介导的转导通路等,但具体的作用机制还有待进一步深入研究。外源性FDP具有不良反应少,给药方便,配伍禁忌少,临床用药灵活等特点。静脉用药后最常见的不良反应是药物对血管的局部刺激和输液部位疼痛,几乎占不良反应的一半,所以静脉应用需注意控制滴速,不宜过快。外源性FDP具有较好的临床应用前景,在脑保护机制上还需深入的研究。

