缺血后处理通过水通道蛋白-4对大鼠缺血再灌注损伤的脑保护作用及其机制
刘佳丽, 王 晔
脑卒中发病率高、复发率高、致死致残率高、疾病负担重,已跃升为我国国民死因首位。脑卒中分为缺血性脑卒中(Ischemic stroke,IS)和出血性脑卒中,其中IS患者占总发病人数的60%~80%[1]许多研究人员认为缺血性脑卒中后的脑水肿和血脑屏障(BBB)的破坏引起脑组织损伤,缺血后处理(Ischemic Postconditioning,IP)具有神经保护作用和减轻脑水肿的作用[2]。IP是指在再灌注的早期,重复予几次短暂的非致死性的血管闭塞与再通的过程,被认为是一种缺血耐受,从而减轻脑缺血再灌注损伤和脑水肿[3]。水通道蛋(AQPs)在脑水肿的发病机制中发挥着重要作用[4]。作为水通道蛋白家族的成员,它们在脑组织中高度表达,其通常定位于星形细胞表面以及毛细血管周围由星形胶质细胞终足包绕而成的胶质界膜。相关的动物实验研究提示,AQP4的高表达可导致神经胶质细胞肿胀破裂,破坏血脑屏障,最终引起缺血再灌注损伤后的脑水肿,进而导致脑损伤[5],它在细胞毒性和血管源性水肿发展过程中起着重要的作用。AQP4的表达增多在神经系统疾病如神经炎症和缺血性卒中的病理生理学中起着重要作用[6]。本研究通过建立脑缺血再灌注损伤大鼠模型,观察其神经行为学改变、脑组织病理形态学变化及海马区AQP4的表达,初步探讨IP在大鼠局灶性脑缺血再灌注损伤中的保护作用及其机制。
1 材料和方法
1.1 材料 健康雄性SD大鼠48只,体质量250~300 g,凋亡检测试剂盒、AQP4免疫组化试剂盒均为武汉博士得公司产品,OLYMPUS BX41显微图像分析系统。
1.2 方法
1.2.1 动物分组 SD大鼠48只,随机分为3组,每组16只。假手术组:仅暴露颈总动脉及分叉处。对照组:行单纯大脑中动脉缺血60 min后再灌注;缺血后处理(IP)组:于大脑中动脉线栓阻闭(middle cerebralartery occlusion,MCAO) 60 min后,拔除线栓后即刻夹闭栓塞侧颈总动脉,阻断血流30 s,恢复血流30 s,如此进行3次缺血/再灌注循环。
1.2.2 模型制作 所有实验动物术前24 h禁食,自由饮水。水合氯醛0.35 g/kg体重,腹腔麻醉,剪去颈正中位皮毛,消毒,铺巾,取颈正中皮肤切口,钝性分离肌肉及皮下组织,暴露颈总动脉(CCA),分离迷走神经,切忌钳夹,钝性分离右侧颈外动脉(ECA)和颈内动脉(ICA),结扎分支,用手术剪剪开ECA一小口将一预先用酒精灯烧成圆头的320尼龙线置入颈内动脉14~15 mm,直到有轻微阻力感为止,对照组阻闭60 min后抽出尼龙线,恢复再灌注,24 h后处死。IP组于MCAO 60 min后,将尼龙线拔出5~8 mm,依据分组,再灌注时间30 s,再将尼龙线放入原位置,缺血时间为30 s,反复3次,恢复再灌注,24 h后处死。
1.2.3 观测指标
1.2.3.1 神经行为学评估 麻醉苏醒后,将动物放回鼠笼,自由饮食。脑缺血再灌注后24 h,各组随机取8只,用双盲法评估记录神经功能障碍评分(NDS):0级:无功能障碍;1级:不能伸展右侧前肢;2级:向右侧旋转;3级:向右侧倾倒;4级:无自主活动伴有意识障碍;5级:死亡。
1.2.3.2 梗死体积率测定 所有大鼠恢复再灌注24 h后,各组随机取4只,用10%水合氯醛(3 ml/kg)经腹腔注射深麻醉后断头处死,迅速取出鼠脑,置于冰盐水中10 min,取冠状面均匀切成2 mm厚脑片,迅速放入20 g/L的TTC溶液(37℃)中染色30 min,每隔7~8 min用眼科镊翻转一次,使染色充分、均匀,然后用40 g/L甲醛固定。24 h后将脑片用数码相机拍照,输入计算机,采用双盲法用图像处理软件(ADOBE PHOTOSHOP 7.0)计算脑梗死体积(粉红色区为正常脑组织,白色区为梗死区)百分比,即梗死灶占对侧正常大脑半球的百分比。采用Swanson法的原理计算脑梗死体积百分比:脑梗死体积百分率=(正常侧大脑半球体积-梗死侧非梗死区脑组织体积)/正常侧大脑半球体积×100%。
1.2.3.3 脑组织含水量测定 大鼠恢复再灌注24 h后,各组随机取4只,用干湿法测脑组织含水。率迅速断头取脑,置于内有生理盐水湿润的定性滤纸的培养皿中,以防水分蒸发,同时快速去掉脑皮质表面的软脑膜和凝血块。用分析天秤准确称取两个半球的重量,然后置于100 ℃烤箱24 h,用同一天平再次称重,以[ (湿重-干重) / 湿重] ×100 %即为相对含水量。
1.2.3.4 免疫组织化学检测 每组剩余的8只大鼠,经10%水合氯醛腹腔麻醉,打开胸腔,先后用生理盐水和4%多聚甲醛行心脏灌流,断头取脑,置于4%多聚甲醛中固定24 h。(1)脱蜡、水化组织切片、预处理组织切片;(2)蒸馏水漂洗,置于PBS中;(3)3%H2O2阻断10 min;(4)蒸馏水漂洗,置于PBS中10 min;(5)一抗孵育过夜;(6)PBS漂洗3次/2 min;(7)IvisionTM二抗试剂Poly‐HRP羊抗鼠兔通用型;(8)PBS 漂洗3/2 min;(9)显色,光镜控制;(10)复染、脱水、透明、封片;(11)AQP4阳性细胞不同组别取3张切片,显微镜下观察细胞浆呈棕黄色为阳性细胞,OLYMPUS BX41显微图像分析系统测定海马CA1区阳性反应物的光密度值(optical density value,OD值),取平均值作为测量值。
1.2.3.5 TUNEL 染色细胞凋亡检测 常规脱蜡,按照试剂说明书操作,DAB显色、乙醇脱水、二甲苯透明、中性树胶封片。显微镜下细胞核中出现棕黄色颗粒者为阳性细胞,即凋亡细胞。OLYMPUS BX41显微图像分析系统测定海马CA1区阳性反应物的光密度值,取平均值作为测量值。
2 结 果
2.1 神经功能障碍评分比较 术后所有动物均存活。假手术组大鼠未见神经功能损害,对照组和IP组大鼠均表现出一定神经功能障碍(见图1),部分大鼠可观察到偏瘫及霍纳征。缺血再灌注24 h后,IP组NDS(1.63±0.74)与对照组(2.63±0.92)比较显著降低,差异有统计学意义(P<0.05)(见表1)。
2.2 大鼠脑梗死体积变化 假手术组无肉眼可见的梗死灶形成,脑组织染成玫瑰红色;缺血再灌注各组大鼠均有不同程度的梗死灶形成,脑梗死组织为白色(见图2)。IP 减小局灶性脑缺血后的梗死体积。IP组脑梗死体积显著低于对照组(P<0.05)。
2.3 脑组织含水量测定 我们测量了大鼠脑组织水分含量评估脑水肿。缺血再灌注后假手术组、对照组、IP组的非缺血半球侧脑组织水含量在各组别中无明显差别,患侧脑组织水含量分别为(76.9±0.91)%、(84.08±2.8)%、(79.77±1.81)%。在患侧组中对照组脑组织水含量明显高于IP组(P<0.05)(见图3),结果有统计学意义。
2.4 凋亡细胞的表达 假手术组海马CA1区偶可见极少数阳性细胞。缺血再灌注各组大鼠海马CA1区可见TUNEL阳性反应细胞即凋亡细胞,胞核固缩黄染,胞体缩小形状不规则。对照组可见较多的阳性细胞,其细胞核中有大量棕黄色颗粒,细胞核周围靠近胞膜处有数个散在深染的圆形颗粒状结构,即凋亡小体(见图4)。IP组较对照组阳性细胞减少,经平均光密度值测定,假手术组平均光密度值最小(0.11400±0.13832),与其它各组比较有统计学意义。对照组的OD值明显高于IP组(P<0.05)(见表2)。
2.5 免疫组织化学结果 AQP4阳性表达主要集中在大鼠脑膜等处的胶质界膜上及毛细血管壁周围的星形胶质细胞的胞膜上和胞浆中,呈现出黄色细颗粒,在对照组大鼠海马区,AQP4阳性表达的黄色细颗粒明显增多,IP组大鼠海马区AQP4阳性表达的黄色细颗粒较对照组减少(见图5)。图像分析结果显示,对照组平均光密度值明显高于假手术组,差异具有统计学意义(P<0.01);IP组大鼠AQP4的平均光密度值低于对照组,差异具有统计学意义(P<0.05)(见表2)。

与对照组相比*P<0.05;与假手术相比#P<0.01

与假手术组相比*P<0.01;与对照组相比#P<0.05

A:假手术组; B:对照组; C:IP组
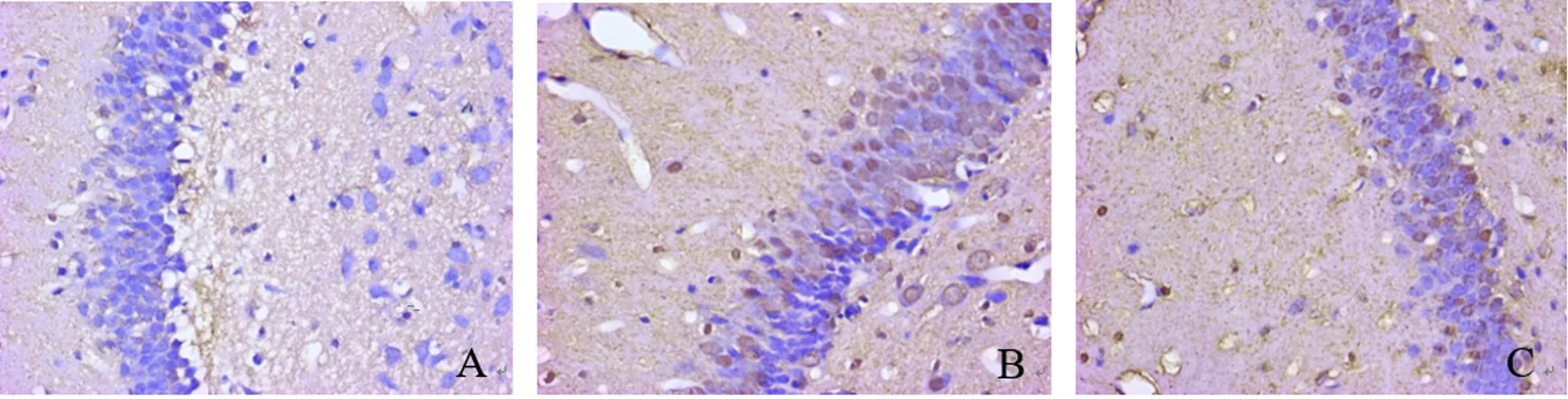
A:假手术组; B:对照组; C:IP组

表1 各组大鼠再灌注24 h后
与假手术组相比较*P<0.01,与对照组比较#P<0.05

表2 各组大鼠海马CA1区平均光密度值
与假手术组相比较*P<0.01,与IP组比较#P<0.05
3 讨 论
本实验采用大鼠MCAO作为有效的实验模型诱发脑水肿和脑损伤,研究了IP对脑缺血再灌注后的脑保护作用。证实了IP可通过降低AQP4的表达减小缺血性卒中后的脑水肿,同时减轻脑损伤后的神经功能缺损。
缺血性脑卒中后患者可有不同程度的神经功能损伤。大鼠神经行为学评估提示了缺血性脑卒中后新出现的神经系统症状。对照组的行为学评分明显高于IP组,可见IP可显著改善缺血性脑卒中后的神经功能缺损。MCAO后可出现大鼠脑缺血缺氧,大量兴奋性谷氨酸积累于细胞外,进一步结合谷氨酸受体后导致大量钙离子内流,同时增强了钙敏感酶的活性,这时大量自由基生成,损伤线粒体,最终导致细胞凋亡。海马CA1区是中枢神经系统中的易损部位,本实验观察到在缺血后海马CA1区可见明显增加的凋亡细胞,提示细胞凋亡参与缺血后细胞死亡的机制。假手术组极少出现凋亡细胞,缺血各组海马区CA1区均出现阳性细胞,IP组较对照组阳性细胞表达明显减弱(P<0.05)。提示IP可通过减少细胞的凋亡,从而发挥脑保护作用。
脑水肿是脑缺血再灌注损伤的重要病理环节之一[7]。细胞毒性脑水肿常常发生在IS发生的最初24 h。而血管源性脑水肿则多见于IS的后期,由BBB结构被破坏而引起,脑水肿确切的发生机制目前尚未完全阐明[8]。本研究显示,IP组与对照组比较明显减少了缺血后大鼠的脑梗死体积及脑组织含水量(P<0.05),表明IP可减轻脑缺血后的脑水肿。在包括卒中,创伤性脑损伤后的脑缺血再灌注所引起的脑水肿均与AQP4的表达有密切关系[9]。AQP4属于水特异性通道蛋白,在脑灰质、白质均有分布,主要集中在侧脑室和导水管的室管膜细胞,下丘脑及海马齿状回,另外在软脑膜、视上核、齿状回的颗粒细胞层和小脑蒲肯野细胞也有明显表达[10]。AQP4体外实验结果发现,AQP4促进水通过BBB进入损伤的星形胶质细胞,其表达水平与细胞毒性脑水肿程度呈同向变化,二者呈正相关[11]。AQP4的过度表达是脑缺血病理过程中脑水肿的主要病理之一[12]。AQP4除了参与脑水肿的病理生理外,还有维持血脑屏障完整性、参与星形胶质细胞迁移和神经细胞信号转导及血管再生等多种功能。许多研究已经证明MCAO诱导血脑屏障破坏,AQP4蛋白和mRNA表达均明显上升,且在缺血中心的梗死灶周边表达最强。之前的研究表明,脑缺血后AQP4基因敲除大鼠的细胞毒性脑水肿减轻,神经功能改善明显[13]。本研究中脑缺血各组(IP组和对照组) 海马CA1区AQP4表达均较假手术组明显上升,而与对照组相比IP组AQP4的表达明显减少(P<0.05),表明IP明显下调MCAO后AQP4的表达,进而减少脑梗死后的脑水肿,起到脑保护作用。
综上所述,IP可有效降低脑缺血再灌注后的脑水肿,减轻脑组织损伤和大鼠MCAO后的神经功能缺损。其机制可能与降低AQP4的表达有关。

