更新教学方法 提高教学效率
张明妹
青海师大附中 青海西宁 810008
一、教师教育理念的更新
(一)教育目的更新
教师应树立学生在接受相应学段的教育过程中,逐步形成的适应个人终身发展和社会发展需要的必备品格和关键能力。它是所有学生应具有的最关键、最必要的基础素养,是知识、能力和态度等的综合表现,可以通过接受教育来形成和发展,具有发展连续性和阶段性,兼具个人价值和社会价值。
(二)教学理念的更新
1.教师角色的更新。在新课程改革的理念的指导下,课堂教学应该是以“平等”的方式进行的。2.提问学生问题方式的更新。教师提问不指向明显的答案,而是指向思维过程,帮助学生理清问题的层次,抓住问题的关键。3.作业布置方式的更新。作业应该是教师自己精心设计的习题或试卷,题量不要太多,题目要精选,兼顾学生差距。
二、如何在新的教育理念下,更新教学方法,提高教学效率
(一)教学应注重知识建立起来的过程
化学知识中的每一个定义结论都是建立在一定前提条件范围中的,离开这些前提条件,这些理论就不一定成立,只有让学生认识到这些理论建立的条件,参与知识建立起来的过程,这样学生才能真正掌握知识运用知识。例如有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol L-1H2SO4溶液中,乙同学将电极放入6mol L-1的NaOH溶液中,如图所示。请回答:
1.写出甲池中正极的电极反应式;
2.写出乙池中负极的电极反应式和总反应的离子方程式;3.由此实验,可得到如下哪些正确结论?
a.利用原电池反应判断金属活动性顺序时应选择合适的介质。b.镁的金属性不一定比铝的金属性强。
c.该实验说明金属活动性顺序已过时,已没有实用价值。
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析。
4.上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”,这种做法。(填“可靠”或“不可靠”)
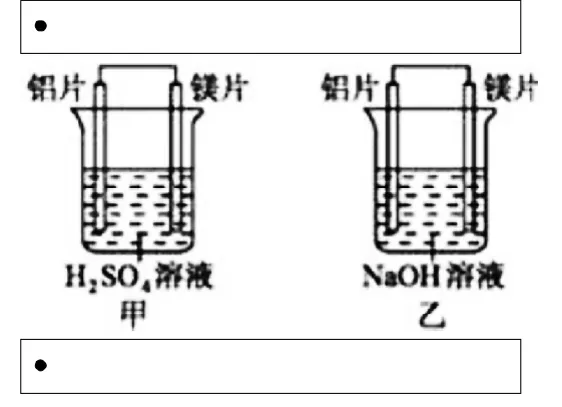
【分析】甲池中,镁铝都与稀硫酸反应,但镁与稀硫酸反应剧烈,镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;乙池中依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑。由于Al显两性,与酸碱都能发生反应,而镁与氢氧化钠溶液不反应,铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;在讲原电池原理时说过,两种金属做电机时,活泼金属做负极,不活泼金属做正极,乙池中的结论与金属活动顺序表正好相反,能否说明镁的金属性不一定比铝的金属性强,金属活动性顺序已过时,已没有实用价值了呢?通过让学生探究判断金属性强弱依据,使学生明白判断金属性强弱依据之一是单质跟水或酸置换出氢气的难易程度——越易置换出氢气,金属性越强。断金属性强弱依据之一是单质跟酸置换出氢气的难易程度,而不是与碱置换出氢气的难易程度,整个问题的探究过程由学生参与,教师只起到引导作用。
(二)重新认识教学内容
教师不应是照本宣科的教书匠,而应当是课程资源的开发者建设者。教科书是教学的基本内容,作为新世纪的化学教师,要有开发教育资源的意识,有整合包括教科书在内的化学教育资源的能力。例如为了测定浓度对反应速率的影响,在人民教育出版社普通高中课程标准实验教科书《化学反应原理》(选修4)第20页实验2-2中;本实验预期的现象是酸性高锰酸钾溶液颜色逐渐变浅直到无色,加0.2mol/L的H2C2O4溶液的先褪色.但许多教师在做此实验时发现酸性高锰酸钾溶液颜色逐渐变成无色的过程中有几种不同颜色的变化,加0.1mol/L的H2C2O4溶液的先褪色,且褪色先缓慢后逐渐加快,实验结果不尽人意.为此不少教师进行了探究:有建议采用更小浓度的酸性高锰酸钾溶液(0.001mol/L)和含少量Mn2+的草酸反应;有人建议变换试剂加入顺序,将量少的高锰酸钾加到量多的草酸中;有教师发现提高硫酸的浓度可缩短褪色的时间;有的教师发现草酸和高锰酸钾在一定浓度范围内,浓度增加,反应速度能加快;有的认为Mn2+在反应过程中的自催化作用导致反应复杂。
今后的教师,不应是照本宣科的教书匠,而应当是课程资源的开发者建设者。

