鲍芹低值部位乙醇提取物的抗氧化活性评价
尤常清 毕玉平 于金慧 马德源 黄超 尤升波

摘要:为探索鲍芹低值部位高值化利用的途径及科学依据,本试验对外围叶柄和根中的物质进行提取,同时测定了该乙醇提取物中总酚和总黄酮含量与抗氧化指标总抗氧化能力、DPPH自由基清除能力、亚铁离子螯合能力、总还原力,并对各测定指标的相关性进行分析。结果表明:叶柄提取物中总酚含量为92.69 mg GAE/g,总黄酮含量为2.60 mg RE/g;根部提取物总酚含量为145.41 mg GAE/g,总黄酮含量为5.91 mg RE/g。在同等质量浓度条件孵育150 min后,鲍芹叶柄和根提取物中总抗氧化能力可达到BHT的65%以上;二者DPPH自由基清除能力可达到BHT的57.1%以上;二者亚铁离子螯合能力可达EDTA的74.3%~84.0%;二者的还原力较小,仅能达到BHT的7%~10%。相关性分析表明抗氧化活性与总酚和总黄酮含量极显著正相关。综合分析可知,鲍芹低值部位具有较好的抗氧化能力。
关键词:鲍芹;抗氧化能力;总酚;总黄酮
中图分类号:S636.301文献标识号:A文章编号:1001-4942(2019)02-0033-07
Assessment on Antioxidant Activity of Alcohol Extract from
Low-Value Parts of Apium graveolens Bao Qin
You Changqing Bi Yuping Yu Jinhui Ma Deyuan Huang Chao You Shengbo2
(1. College of Life Sciences, Shihezi University, Shihezi 832003, China;
2. Biotechnology Research Center, Shandong Academy of Agricultural Sciences, Jinan 250100, China)
AbstractIn order to find the methods and scientific bases for high-value utilization of low-value parts of Apium graveolens cultivar Bao Qin, the outer petiole and root were extracted by alcohol, and then the contents of total polyphenols and total flavonoids in the extract were determined. The total antioxidant activity, DPPH radical scavenging, ferrous ion chelating ability and reducing power were used to evaluate its antioxidant activity, and the correlation between the content of polyphenols and flavonoids and the antioxidant activity was also analyzed. The results showed that the content of total polyphenols and total flavonoids was 92.69 mg GAE/g and 2.60 mg RE/g in the outer petiole respectively and 145.41 mg GAE/g and 5.91 mg RE/g in roots respectively. The extracts of outer petiole and root of Bao Qin had better antioxidant activity. Under the same concentration, the total antioxidant activity of the extract of the two parts was up to 65% of the BHT; the DPPH radical scavenging capacity was up to 57.1% of the BHT; the ferrous ion chelating ability was up to 74.3%~84.0% of the EDTA; and the reduce capacity was weak and only 7%~10% of the BHT. The content of total flavonoids and polyphenols had significant correlations with the indicators of antioxidant activity. In conclusion, the low-value parts of Bao Qin such as the outer petiole and roots had higher antioxidant ability.
KeywordsBao Qin; Antioxidant activity; Total polyphenols; Total flavones
自由基是一種普遍存在于生物体内的游离基,按其化学结构可分为半醌类自由基、氧中心自由基和其它类型自由基。随着对自由基与疾病关系认知的深入,Ahmadinejad等[1]发现自由基与多种疾病的发生发展密切相关,它会造成生物膜的脂质过氧化损伤,引起酶、氨基酸、蛋白质的氧化破坏,对内脏器官、免疫系统的形态功能产生影响,进而引起机体疾病[1]。抗氧化成分能够清除机体过量自由基,因此,从天然生物中寻找植物源抗氧化剂成为现代保健、医药等行业的热点课题之一[2-5]。
目前,科研人员已在蔬果、作物、中草药[3-5]等植物的抗氧化活性成分方面开展大量研究。芹菜作為药食同源的一种蔬菜,具有很好的保健价值。研究表明,芹菜叶内黄酮含量最高,根中最低,各部位均具有较好的抗氧化能力,且与总黄酮含量显著正相关[6,7]。鲍芹因其色泽翠绿、茎柄充实肥嫩、入口香脆微甘、芹芯生食无丝无渣、芹香浓郁等特点倍受消费者青睐,已被列为山东省地理标志产品。但其绝大部分只作为鲜蔬供应,仅心部茎秆市场价值较高,外围茎秆和根部的附加值低,综合利用不够充分,甚至废弃,这不仅影响农民收益,也污染当地环境。因此,本试验以鲍芹外围叶柄和根为研究对象,对其总黄酮、总酚及抗氧化能力进行评价,以期寻找其高值化利用的科学依据,并为提升芹菜相关产业的发展空间和拉长产业链提供思路和借鉴。
1材料与方法
1.1试验材料
供试材料为鲍芹外围叶柄与根(均为废弃部分),于2016年12月份采自山东省章丘市辛寨乡鲍家村。样品经干燥、粉碎、过筛处理后置阴凉干燥处储存备用。2017年5—12月份完成后续试验。
1.2试剂与仪器
主要试剂为乙醇、亚硝酸钠、三氯化铝、氢氧化钠、硫酸、磷酸钠、钼酸铵、氯化亚铁、EDTA、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁,均为分析纯,购自国药集团化学试剂有限公司;福林酚(Folin-Ciocalteu)、没食子酸和芦丁购自上海阿拉丁有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,6-二叔丁基-4-甲基苯酚(BHT)和菲洛嗪购自Sigma-Aldrich。
仪器设备有电子天平(JA5003,上海舜宇恒平科学仪器有限公司)、超声清洗仪(SB25-12 DTD,宁波新芝生物技术有限公司)、水浴锅(DK-S24,上海森信实验仪器有限公司)、纯水仪[FYY(40-120)01/02,青岛富勒姆科技有限公司]、旋转蒸发仪(RE100-Pro,北京大龙)、干燥箱(DHG-9030A,浙江赛德仪器设备有限公司)、紫外分光光度计(756PC,上海舜宇恒平科学仪器有限公司)。
1.3试验方法
1.3.1提取物的制备将鲍芹外围叶柄和根切成碎块并于50℃烘干,用粉碎机打碎,过69 μm筛得叶柄与根粉末样品。分别取粉末25 g各3份,于具塞磨口三角烧瓶中加入70%乙醇250 mL,采用超声辅助提取的方式,浸泡30 min后超声萃取两次,每次15 min。过滤得上清液,固体物料继续按照相同方式提取两次,合并三次上清液。利用旋转蒸发仪于60℃将上清液旋干,并使用干燥箱低温烘至恒重。记录提取物重量,计算提取得率。提取物干燥保存于-20℃备用。使用前提取物用70%乙醇溶液配制成质量浓度为20 mg/mL母液,再稀释到所需质量浓度(0.25、0.50、1.00、2.00、4.00 mg/mL)的样品溶液。
1.3.2总酚与总黄酮含量的测定总酚含量测定采用Folin-Ciocalteu方法[8],并略加改动。取0.5 mL样品溶液,加入0.5 mL蒸馏水和2 mL Folin-Ciocalteu试剂(稀释10倍,现用现配),混匀后反应5 min。加入7.5%的碳酸钠溶液(w/v)2.0 mL,黑暗条件下25℃室温反应30 min。于765 nm测定吸光度值,以没食子酸(galic acid equivalent, GAE)为标准品做标准曲线,提取物总酚含量以mg GAE/g表示。
总黄酮含量测定参考文献[9]的方法。将0.5 mL样品溶液加入到4.5 mL蒸馏水中, 然后加入5%的亚硝酸钠溶液(w/v)1 mL,充分混匀后静置5 min,加入10%的三氯化铝(w/v)1 mL,混匀后25℃水浴6 min,加入1 mol/L氢氧化钠溶液10 mL,最后补足蒸馏水至25 mL,充分混匀放置15 min。于510 nm测定吸光度值,以芦丁(rutin equivalent, RE)为标准品做标准曲线,不同提取物总黄酮含量以mg RE/g表示。
1.3.3抗氧化能力评价采用钼酸铵法[8]对样品的总抗氧化能力进行评价。分别取1.0 mL不同质量浓度梯度(0.25、0.50、1.00、2.00、4.00 mg/mL)的鲍芹根和外围叶柄提取物溶液,置10 mL试管中,加入3.0 mL反应液(由0.6 mol/L硫酸、28 mmol/L磷酸钠和4 mmol/L钼酸铵组成),充分混匀后于95℃水浴锅中分别加热30、60、90、120、150 min,冷却至室温,以蒸馏水为空白,于695 nm处测定其吸光度。分别选择0.25、0.50 mg/mL BHT作为对照。
DPPH自由基清除能力测定参考文献[10] 的方法,并略作改动。取1.0 mL不同质量浓度梯度(0.25、0.50、1.00、2.00、4.00 mg/mL)的鲍芹根和外围叶柄提取物溶液,置5 mL离心管中,加入0.008 mmol/L的DPPH溶液3.0 mL,室温避光反应30 min,以无水乙醇为空白,于517 nm处测定吸光度。分别选择0.25、0.50 mg/mL BHT作为对照。按下列公式计算DPPH自由基清除率:
DPPH自由基清除率(%)=A0-(As-Ac)/A0×100。
式中,A0为1.0 mL蒸馏水+3.0 mL DPPH溶液的吸光度;As为1.0 mL样品溶液+3.0 mL DPPH溶液的吸光度;Ac为1.0 mL样品溶液+3.0 mL无水乙醇的吸光度。
亚铁离子螯合能力测定参考文献[11]的方法。取1.0 mL不同质量浓度梯度(0.25、0.50、1.00、2.00、4.00 mg/mL)的鲍芹根和外围叶柄提取物溶液,加入3.7 mL蒸馏水混匀后,再加入2 mmol/L FeCl2溶液0.1 mL和5 mmol/L的菲洛嗪溶液0.2 mL,于25℃水浴静置10 min,以蒸馏水为空白,于562 nm处测定吸光度。选择0.25、0.50 mg/mL EDTA作为阳性对照。样品对Fe2+的螯合率计算公式如下:
Fe2+螯合率=[1-(A1-A2)/A0]×100%。
式中,A0为1 mL蒸餾水代替反应体系中样品溶液后的吸光度;A1为样品溶液反应后的吸光度;A2为0.2 mL的蒸馏水代替反应体系中菲洛嗪溶液后的吸光度。
总还原力测定参考文献[12]的方法。取1.0 mL不同质量浓度梯度(0.25、0.50、1.00、2.00、4.00 mg/mL)的鲍芹根和外围叶柄提取物溶液,加入0.2 mL/L的磷酸盐缓冲液(pH=6.6)2.5 mL和1%的铁氰化钾溶液(w/v)2.5 mL,混匀后将混合物于50℃水浴保温20 min,然后加入10%三氯乙酸溶液(w/v)2.5 mL,混合溶液于3 000 r/min离心10 min,准确吸取上清液2.5 mL,加入2.5 mL蒸馏水和0.1%三氯化铁溶液(w/v)0.5 mL。以蒸馏水为空白,于700 nm处测定吸光度,以0.25、0.50 mg/mL BHT作为对照。
1.4数据处理
本试验所得数据均以平均值±标准误表示,各处理均进行3次重复。采用SPSS 16.0对所得数据进行one-way ANOVA统计,采用LSD进行多重比较(P<0.05)。采用SPSS 16.0多元线性回归进行总酚、总黄酮与各抗氧化指标的相关性分析,根据Pearsons相关分析结果判断其显著水平(P<0.01或P<0.05)。
2结果与分析
2.1提取得率
采用70%乙醇提取鲍芹叶柄粉和根粉,分别得到28.35%和29.82%的醇提物。用70%乙醇配制成相应质量浓度的样品溶液,用于后续指标的测定。
2.2鲍芹提取物中总酚和总黄酮类化合物含量
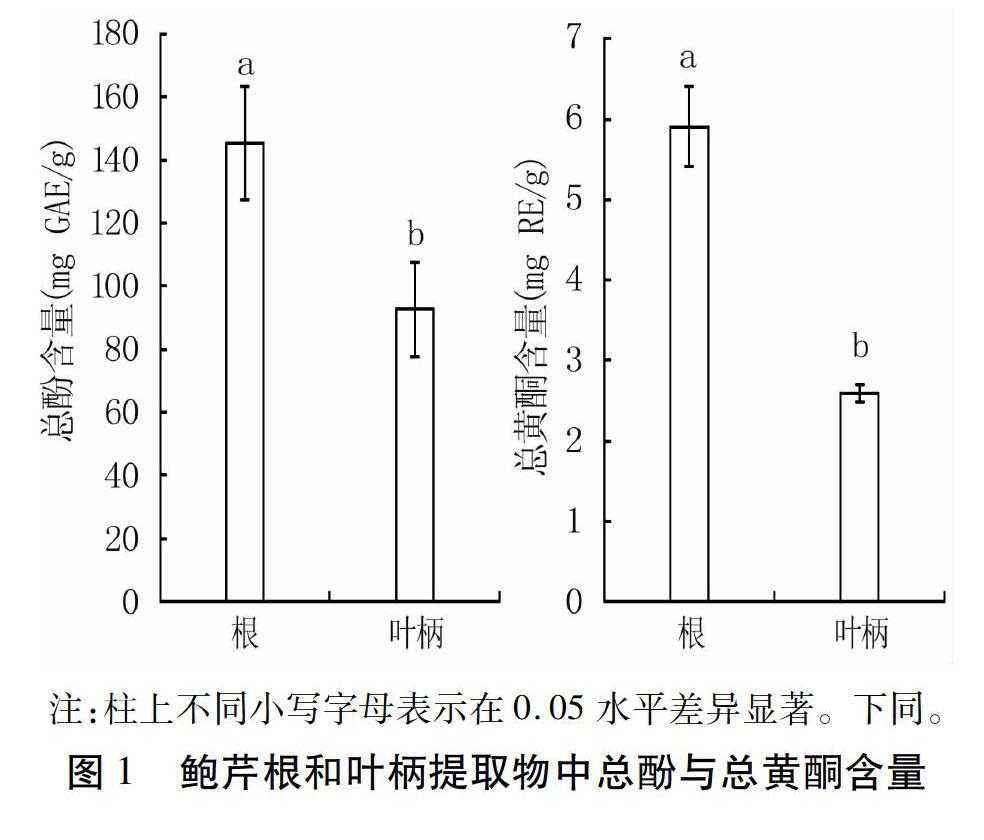
由图1可知,鲍芹根部提取物总酚和总黄酮
含量均显著大于叶柄提取物(P<0.05)。其中,根部提取物的总酚含量为145.41 mg GAE/g,总黄酮含量为5.91 mg RE/g ;叶柄提取物中的总酚含量为92.69 mg GAE/g,总黄酮含量为2.60 mg RE/g。
2.3抗氧化能力评价
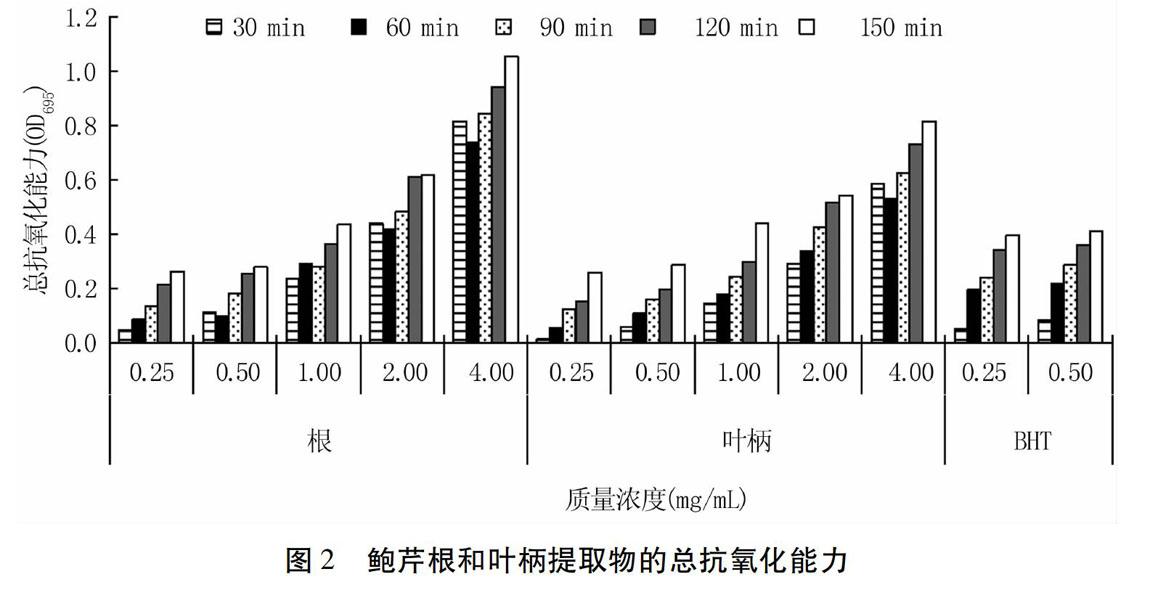
2.3.1总抗氧化能力由图2可以看出,鲍芹根和叶柄提取物均具有较好的总抗氧化能力,其中根提取物的抗氧化效果强于叶柄提取物。随浓度梯度的增加和孵育时间的延长,两种提取物的总抗氧化能力也相应提高。在孵育150 min条件下,同等浓度的根和叶柄提取物溶液的总抗氧化能力达到BHT的65%以上。
2.3.2DPPH自由基清除能力由图3可知,随浓度的增加,鲍芹根和叶柄提取物的DPPH自由基清除能力明显增加。在浓度高于1.00 mg/mL后趋于平稳,此时根提取物的DPPH自由基清除能力达到83%以上,叶柄提取物达到75%以上。根提取物的清除效果在0.50、1.00 mg/mL时强于叶柄提取物,在2.00~4.00 mg/mL时二者的清除能力相当。在0.50 mg/mL浓度条件下,鲍芹根和叶柄提取物的DPPH自由基清除能力达到BHT的67.4%和57.1%,显著低于对照。
2.3.3亚铁离子螯合能力鲍芹根和叶柄提取物的亚铁离子螯合能力如图4所示。二者在0.25 mg/mL浓度下亚铁离子螯合率均在80%以上,并随浓度增加而下降,到1.00 mg/mL时最低(68%以上),之后又有所增加。总体来看二者的亚铁离子螯合能力没有明显的浓度梯度效应。在同等浓度条件下,可达EDTA亚铁离子螯合能力的74.3%~84.0%。
2.3.4总还原力由图5可以看出,鲍芹根提取物和叶柄提取物均具有一定的还原力,且呈明显的浓度梯度效应。总体上,鲍芹根提取物的还原力大于外围叶柄,但二者都显著低于同等浓度条件下BHT的还原力。鲍芹根提取物能达到BHT的9%~10%,叶柄提取物仅能达到BHT的7%~9%。
2.4鲍芹提取物中总酚和总黄酮类化合物含量与抗氧化能力的相关性分析
由表2可知,总酚和总黄酮含量均与DPPH自由基清除能力、总抗氧化能力和总还原力呈极显著正相关。说明鲍芹根和外围叶柄提取物的抗氧化活性可能取决于所含总酚和总黄酮的含量。
3讨论
体外化学评价法评价样品的抗氧化性有多种指标,仅用一种指标难以说明问题,通常是选择多种抗氧化指标进行综合评价[13,14]。总抗氧化能力是通过检测提取物溶液的吸光度值变化进行评价。样品中的抗氧化成分可将六价钼Mo (Ⅵ) 还原为五价钼 Mo(Ⅴ),在酸性条件下形成蓝色的Mo (Ⅴ)与磷酸的复合物,抗氧化能力越强,颜色越深,吸光度值越大。DPPH自由基有单电子,在517 nm处有一强吸收,利用其醇溶液呈紫色的特性,当有自由基清除剂存在时,因与其单电子配对,其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用分光光度计进行快速定量分析,清除率越大表明抗氧化能力越强。还原力的测定实质上是检验物质是否为良好的电子供应者,还原力强的物质供应的电子除可以还原氧化性物质外,也可与自由基反应,使自由基形成稳定的物质[15]。本试验选取总抗氧化能力、DPPH自由基清除能力、亚铁离子螯合能力和还原力等抗氧化指标来进行评价,同等浓度条件下,芹菜根与外围叶柄提取物的大部分指标(总抗氧化能力、DPPH自由基清除活性、亚铁离子螯合能力)可达对照的57%以上,说明鲍芹低值部位提取物具有较好的抗氧化活性,有待于进一步开发利用。
酚类及黄酮类化合物是天然产物中广泛存在的一类对人体健康有益的物质,诸多有关抗氧化相关的研究表明这两种成分是天然抗氧化有效成分[16]。本试验测得鲍芹根部和外围叶柄提取物的总酚和总黄酮含量分别为145.41 mg GAE/g、5.91 mg RE/g和 92.69 mg GAE/g、2.60 mg RE/g,并且根部提取物总黄酮含量显著高于新疆地区不同芹菜品种中含量(最大为0.85 mg RE/g)[17]。进一步分析可知鲍芹根部提取物的总酚和总黄酮含量显著高于外围叶柄提取物,这与张桂等[18]的研究结果基本一致。本试验通过相关性分析表明,不同部位提取物的抗氧化能力与总酚和总黄酮含量显著相关,说明可能是此类成分发挥抗氧化功能。
随着经济的发展和生活水平的提高,人们对于功能性产品的需求也越来越大。当前,我国的功能性食品原辅料主要来源于中草药材(包括药食两用材料和功能性食品中可使用的药材)、食品原料(普通食品原料、新食品原料和食品添加剂)、部分天然产物和动植物提取物[19]。芹菜是大众喜爱的菜品之一,来源充足,价格合理。芹菜中含有芹菜素、苯丙素类化合物、香豆素类化合物和挥发油等成分,具有降血压、抗炎、抗氧化、抗肿瘤等多种生理活性[20-23]。目前国内市场上芹菜产品主要以芹菜粉、芹菜混合发酵汁等初级加工品为主。鲍芹也是以初级加工产品为主,且外围叶柄和根多被废弃。因此,以鲍芹为材料,开展抗氧化活性方面的研究,对于延伸农产品深加工产业链,提高相关产业的附加值,推动农产品精深加工具有重要意义。本研究仅对乙醇粗提物的抗氧化活性进行初步研究,还需明确其发挥作用的主要部位或成分。此外,本试验提取方式剩余残渣量很大,我们正在探索并开展微生物发酵的方式,期待为彻底解决环境污染问题提供合适的方法。
4结论
综合分析可知,鲍芹外围叶柄和根部的乙醇提取物均具有较好的抗氧化活性,黄酮和多酚类化合物可能是其发挥抗氧化效果的主要成分。因此,鲍芹低值或废弃部位含有高附加值成分,可以进一步开发以提高鲍芹产业的经济产值。
参考文献:
[1]Ahmadinejad F, Mller S G, Hashemzadeh-Chaleshtori M, et al. Molecular mechanisms behind free radical scavengers function against oxidative stress[J]. Antioxidants, 2017,6(3):51.
[2]Lamola S M, Dzoyem J P, Botha F, et al. Anti-bacterial, free radical scavenging activity and cytotoxicity of acetone extracts of Grewia flava[J]. Afr. Health Sci., 2017,17(3):790-796.
[3]Beretta H V, Bannoud F, Insani M, et al. Relationships between bioactive compound content and the antiplatelet and antioxidant activities of six Allium vegetable species[J]. Food Technol. Biotechnol., 2017,55(2):266-275.
[4]Aiello F, Armentano B, Polerà N, et al. From vegetable waste to new agents for potential health applications: antioxidant properties and effects of extracts, fractions and pinocembrin from Glycyrrhiza glabra L. a aerial parts on viability of five human cancer cell lines[J]. J. Agric. Food Chem., 2017,65(36):7944-7954.
[5]Ge H, Chen Y, Chen J, et al. Evaluation of antioxidant activities of ethanol extract from Ligusticum subjected to in-vitro gastrointestinal digestion[J]. Food Chem. Toxicol., 2017,119:417-424.
[6]李琨, 張学杰, 张德纯, 等. 不同芹菜品种叶与叶柄黄酮含量及其与抗氧化能力的关系[J]. 园艺学报, 2011,38(1):69-76.
[7]李利华. 芹菜不同部位总黄酮含量测定及其抗氧化活性[J]. 食品研究与开发, 2013,34(7):12-15.
[8]Pan Y, Zhu J, Wang H, et al. Antioxidant activity of ethanolic extract of Cortex fraxini and use in peanut oil[J]. Food Chem., 2007,103(3):913-918.
[9]Gong Y, Hou Z, Gao Y, et al. Optimization of extraction parameters of bioactive components from defatted marigold (Tagetes erecta L.) residue using response surface methodology[J]. Food Bioprod. Process., 201 90 (1):9-16.
[10]Sarker U, Islam M T, Oba S. Salinity stress accelerates nutrients, dietary fiber, minerals, phytochemicals and antioxidant activity in Amaranthus tricolor leaves[J]. PLoS One,2018, 13(11): e206388.
[11]Choochote W, Suklampoo L, Ochaikul D. Evaluation of antioxidant capacities of green microalgae[J]. J. Appl. Phycol., 2014,26(1):43-48.
[12]Venuste M, Zhang X, Shoemaker C F, et al. Influence of enzymatic hydrolysis and enzyme type on the nutritional and antioxidant properties of pumpkin meal hydrolysates[J]. Food Funct., 2013,4(5):811-820.
[13]王曉宇, 杜国荣, 李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报, 2012,31(3):247-252.
[14]王忠雷, 杨丽燕, 张小华, 等. 天然产物抗氧化活性成分研究进展[J]. 药物评价研究, 2012,35(5):386-390.
[15]曾军, 石国荣. 天然产物抗氧化活性的测定方法和原理[J]. 安徽农学通报, 2008,14(22):35-36.
[16]Sarker U, Oba S. Response of nutrients, minerals, antioxidant leaf pigments, vitamins, polyphenol, flavonoid and antioxidant activity in selected vegetable amaranth under four soil water content[J]. Food Chem.,2018, 252:72-83.
[17]李燕, 陈妍, 董二雨. 不同产区芹菜根总黄酮含量测定的实验研究[J]. 新疆中医药, 2012,30(6):41-43.
[18]张桂, 畅天狮, 刘俊果, 等. 从芹菜中提取黄酮类物质的研究[J]. 食品科学, 2002(8):121-125.
[19]惠伯棣, 张旭, 宫平. 食品原料在我国功能性食品中的应用研究进展[J]. 食品科学, 2016,37(17):296-302.
[20]Dianat M, Veisi A, Ahangarpour A, et al. The effect of hydro-alcoholic celery (Apium graveolens) leaf extract on cardiovascular parameters and lipid profile in animal model of hypertension induced by fructose[J]. Avicenna J. Phytomed., 2015,5(3):203-209.
[21]Mencherini T, Cau A, Bianco G, et al. An extract of Apium graveolens var. dulce leaves: structure of the major constituent, apiin, and its anti-inflammatory properties[J]. J. Pharm. Pharmacol., 2007,59(6):891-897.
[22]Kooti W, Daraei N. A review of the antioxidant activity of celery (Apium graveolens L.)[J]. Evidence-Based Complementary and Alternative Medicine,2017,22(4):1029-1034.
[23]Aqil F, Jeyabalan J, Munagala R, et al. Chemoprevention of rat mammary carcinogenesis by Apiaceae spices[J]. Int. J. Mol. Sci., 2017,18(2):425.

