水茄组织培养技术体系的建立
李栋,孙亮亮,罗晓梅,白丽丽,亢秀萍,徐进
(1.山西农业大学 园艺学院,山西 太谷 030801;2.青海师范大学 生命科学学院,青海 西宁 810008;3.普洱学院 农林学院,云南 普洱 665000;4.中国科学院 西双版纳热带植物园, 云南 勐腊 666300)
水茄 (Solanumtorvum)也称野茄子,是茄科、茄属灌木,分布于中国云南、广西、广东、台湾。喜生长于热带地方的路旁,荒地,灌木丛中,沟谷及村庄附近等潮湿地方,果实可食,具明目、治疮毒等功效[1]。水茄淡香微苦,略有回甘,风味独特,且生长期较长,全年均可采收,可增加蔬菜花色品种,丰富老百姓“菜篮子”。云南很多地区都有食用水茄幼果的习惯,还因其味苦称之为小苦子[2]。
茄子是一种重要的蔬菜作物。在其农业栽培中,人们以水茄作为茄子砧木,采用嫁接的方法,提高了茄子的抗虫、抗病性,因而极大提高了茄子产量。现在水茄的繁殖多采用种子和扦插技术,但是由于水茄种子发芽慢,发芽率低,不整齐,初期生长缓慢,苗龄长[3],这些因素限制了茄子嫁接技术的应用推广。为了解决这一问题,一些学者就如何促进水茄种子发芽,以及通过扦插进行无性繁殖进行了研究[4~6],虽然取得了一定的成绩,但并没有从根本上解决问题。对于一些难于繁殖的植物,通过组织培养进行快速繁殖已成为现代生物技术的重要内容[7]。 Takeda等研究发现,水茄还是一个典型的重金属低累积植物。将普通茄子嫁接到茄子砧木水茄上,可以有效减少茄子果实中Cd的含量 (降低了75%),提高了蔬菜和药材的安全性[8];Mori等的研究也证明,在水茄中根到芽的Cd转运水平低于茄子[9]。因此,水茄在茄子栽培上具有重要经济价值。
在植物基因工程技术中, 多数成功的转化体系都是建立在良好的愈伤诱导组织培养系统基础之上的。张红以水茄带芽茎段为外植体,对其组培快繁技术体系进行了研究[10],然而这一体系并不适合于农杆菌遗传转化。因此建立水茄下胚轴或子叶外植体的愈伤诱导植株再生体系,是建立水茄遗传转化体系的基础。方岩岩以水茄子叶为外植体进行了水茄组培快繁再生体系的研究,其愈伤组织诱导率高达100%,不定芽诱导率为85%,平均芽数6个[11],由于水茄发芽率低,生长不整齐等因素,增加了取材难度。选择合适的外植体既是水茄再生体系建立的关键,更是为后期农杆菌遗传转化提供有利平台。以水茄下胚轴段为外植体,与子叶外植体相比,增加了外植体取材的数量,优化外植体分化强度,更适合遗传转化体系的建立。但水茄下胚轴再生体系的研究未见报道。本研究的目的旨在建立高效的水茄下胚轴组织培养愈伤诱导和再生植株体系,为进一步建立农杆菌介导的遗传转化研究奠定基础。
1 材料与方法
1.1 试验材料
以采集于西双版纳当地的野生水茄种子为试验材料。
1.2 试验方法
1.2.1 无菌种子苗的培养
采集当年成熟饱满的水茄果实,将种子取出,去除果肉等杂质,晒干。种子先用75%酒精表面消毒50 s,无菌水冲洗2~3遍,置于0.1%HgCl2中浸泡8 min,再用无菌水冲洗5遍。将种子置于灭菌滤纸上吸干水分后,均匀播种在1/2MS培养基(蔗糖15 mg·L-1)上(图1A),4 ℃冰柜中春化3 d后,放入培养室中萌发。培养条件均为:光照强度3 000~5 000 lx,光照时间16/8 h,温度25 ℃[12]。

图1 水茄再生体系的建立Fig.1 Establishment regeneration system of Solanum torvum注:A: 播种; B:萌发7 d的水茄幼苗;C: 接种外植体; D: 愈伤组织和不定芽分化;E: 不定芽增殖培养; F: 继代培养;G: 再生苗生根; H: 再生苗驯化移栽。[13]Note:A: Sowing;B: 7 d germination Solanum torvum seedlings;C: Inoculation explants;D: Callus and adventitious bud differentiation;E: Culture of adventitious bud proliferation;F: Subculture;G: Rooting of regeneration buds;H: Regenerative seedling domestication and transplantation.[13]
1.2.2 愈伤组织诱导和植株再生
取萌发7~15 d的水茄幼苗为材料(图1B),分别切取长约5 mm下胚轴段做外植体 (不包括生长点部位)(图1C),平铺在25个不同浓度不同的激素配方的培养基上 (表1)进行愈伤组织诱导和不定芽分化培养(图1D)。经过2周不定芽增殖培养(图1E),统计不定芽的增殖数,计算增殖率及增殖系数;同时进行继代培养(图1F)。培养条件同种子萌发。

表1 愈伤组织诱导和芽分化培养基Table 1 Callus induction and shoot regeneration medium
1.2.3 潮霉素筛选压的确定
选择5个不同潮霉素浓度 (0,4,8,10,15 mg·L-1),用无菌苗的茎段在筛选培养基上进行培养,选择能够有效抑制外植体生长的潮霉素浓度。
1.2.4 生根培养
以1/2 MS为基本培养基,培养2周后统计生根率。将试管生根苗(图1G)揭盖炼苗3 d,流水洗净根表面附着的培养基,移栽至1/2营养土+1/2蛭石。覆膜保持湿度,同时注意适当通风。移栽苗(图1H)大约8 d后揭去覆膜。
1.3 统计分析
采用Excel 2007进行数据的统计与计算。
2 结果与分析
2.1 不同培养基激素配比的增殖效应
将外植体培养2周时,由表2和图2可知:
B2培养基中外植体愈伤较少,呈淡黄色,出芽多且正常,长势较好;
B3 培养基中生长的外植体,形态学下端愈伤较多,呈浅黄色,最先出芽,但后期愈伤膨大,生长迟缓,芽不能长大;
B3N0.1培养基中生长的外植体愈伤多,愈伤中间坚实,绿色,周围松软,后期芽虽然能长大,但是诱导出的芽很少;
B2I0.2培养基中生长的外植体,形态学下端愈伤较多,呈白色,后期愈伤膨大,芽能够长大,但形态不正常,玻璃化较为严重;
B2I0.1培养基中生长的外植体,形成的愈伤少,淡黄色,出芽多且形态正常,长势好;
B1K1.5I0.2培养基中生长的外植体,分化出的芽少,愈伤较多且有褐化现象,后期长势慢且分化出根;
B1Z2I0.2培养基中生长的外植体,下胚轴段两端变白,变粗,分化出的愈伤少,也不能够分化出芽;
BKN培养基中生长的外植体,愈伤松软且最多,呈白色至浅黄色团状,分化出大量根,无法分化出芽;
BT培养基中生长的外植体, 形态学下端愈伤较多,呈淡黄色,产生的芽形态不正常;
BKI培养基中生长的外植体, 形成的愈伤较多,绿色坚实块状,长出的小芽生长缓慢;
B1N0.2培养基中生长的外植体, 形成大量的愈伤,呈灰白色,质地松散,芽呈绿色小点,无法长大,后期分化出少量根;
B2I0.3培养基中生长的外植体,形成的愈伤部分松散呈白色,部分玻璃化,能够分化出正常的芽,形成较多的根;
B4N0.1培养基中从外植体两端形成绿色坚实的愈伤,分化出少量的芽和根;
B3I0.1培养基中生长的外植体愈伤多,愈伤中间紧密、浅绿色,周围松软,分化出少量的芽且生长缓慢;
B4I0.1培养基中生长的外植体一端形成的愈伤坚实、浅绿色,一端玻璃化,芽呈绿色小点,生长缓慢;
B3I0.05培养基中生长的外植体形成的愈伤膨大,少量玻璃化,分化出畸形芽且发育缓慢;
B3N0.05培养基中生长的外植体形成中间致密浅绿色愈伤,周围松软半透明愈伤,分化出少量畸形芽且不易长大;
B2N0.1培养基中生长的外植体形成致密白色至浅绿色愈伤,不能分化成芽,有少量根发生;
A0.05T0.005培养基中生长的外植体一端形成少量浅黄色愈伤,一端分化出丛生芽且发育迟缓,有少量根发生;
T0.06培养基中生长的外植体膨大形成愈伤,簇状芽不易长大;
N0.1Z3培养基中生长的外植体变粗,几乎不分化形成愈伤,也不能够分化出芽;
I0.1Z1培养基中生长的外植体一端膨大形成愈伤并伴有芽的发生,另一端的分化几乎滞停;
B2N0.3G0.25培养基中生长的外植体,愈伤松软呈白色至浅黄绿色团状且膨大数倍,分化出大量根,无法分化出芽;
B2Z1I0.2培养基中生长的外植体,形成少量的白色至浅黄色愈伤,下胚轴两端都具有分化出芽的能力,形成的簇状芽能够正常长大;
B1K0.5N1培养基中生长的外植体,愈伤松软呈白色至浅黄色团状且膨大数倍,分化出少量根,无法分化出芽。
表2中的数据表明,B2I0.1培养基中生长的外植体分化芽的增殖率和增殖系数均最高,分别为100%和6.62。综合分化增殖系数和芽生长状态等情况,外植体在B2I0.1培养基中增殖系数最大,分化芽生长健壮,叶片较绿。
2.2 潮霉素筛选压的确定
为了摸索出合适的潮霉素筛选压,为进一步遗传转化奠定基础,本研究还对外植体潮霉素筛选压进行了分析。培养15 d后,由表3可知,添加4 mg·L-1潮霉素仍可分化出少量芽并长大。然而在含有8 mg·L-1潮霉素的培养基中,外植体早期能分化出少量芽,但很快就停止生长并死亡 (图2+hyg)。添加10、15 mg·L-1潮霉素后,外植体无法诱导愈伤并死亡。因此,8 mg·L-1是水茄较为合适的潮霉素筛选压浓度。
表2不同培养基激素配比的增殖效应
Table2 Proliferation effect of hormone ratio in different medium
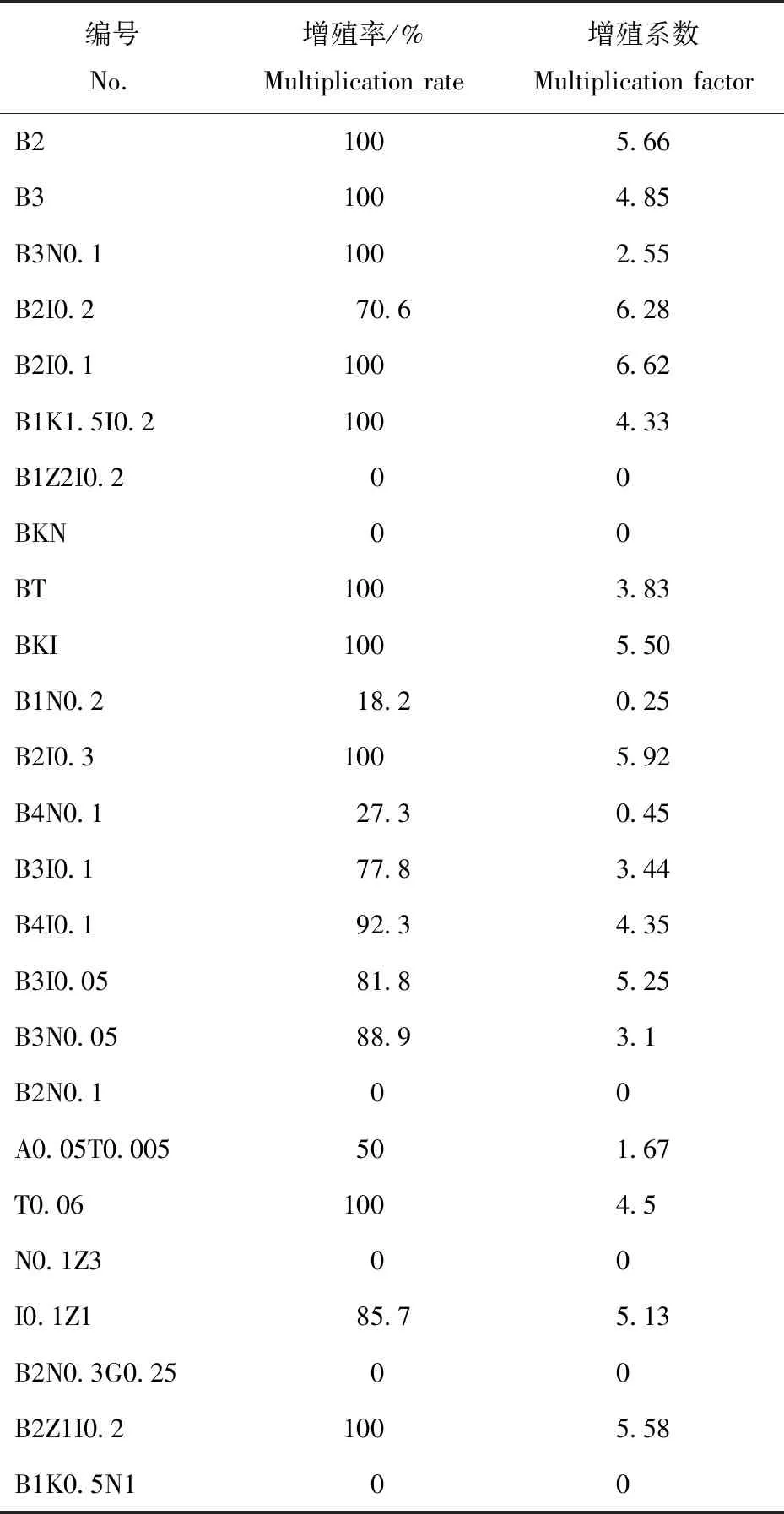
编号No.增殖率/%Multiplication rate增殖系数Multiplication factorB21005.66B31004.85B3N0.11002.55B2I0.270.66.28B2I0.11006.62B1K1.5I0.21004.33B1Z2I0.200BKN00BT1003.83BKI1005.50B1N0.218.20.25B2I0.31005.92B4N0.127.30.45B3I0.177.83.44B4I0.192.34.35B3I0.0581.85.25B3N0.0588.93.1B2N0.100A0.05T0.005501.67T0.061004.5N0.1Z300I0.1Z185.75.13B2N0.3G0.2500B2Z1I0.21005.58B1K0.5N100
2.3 继代与生根培养
经过2周不定芽增殖培养后,将丛生芽切成一个一个独立的芽,培养在MS+6-BA 2 mg·L-1+IAA 0.1 mg·L-1新鲜培养基中,进行继代培养。将生长在B2I0.1培养基上的嫩芽从高度1.5 cm以上的部分切下,转移至不添加任何激素的1/2MS培养基中,培养2周后,由表4可知,平均生根率可达90%以上。将生根苗从培养瓶取出,洗去根系表面的琼脂,转移到营养土中,成活率基本达到100%。
表3不同浓度潮霉素筛选的不定芽分化数量
Table3 The number of adventitious buds differentiation on different congcentrations hygromycin
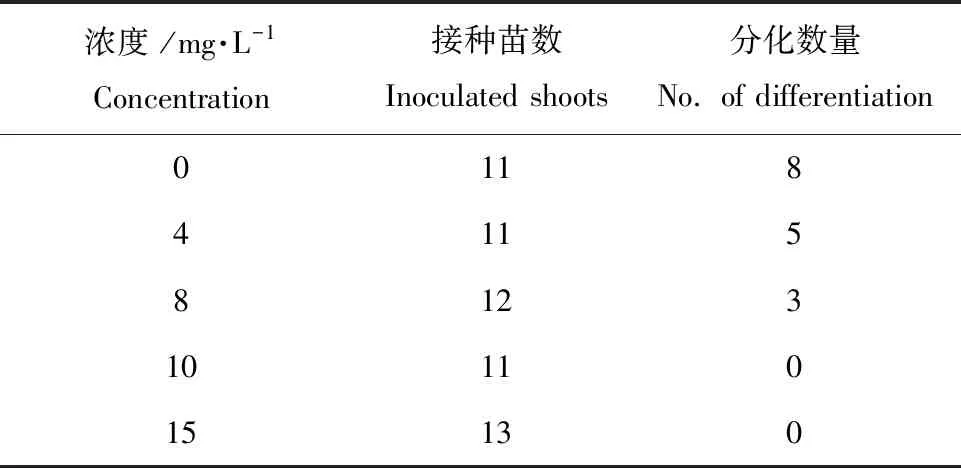
浓度 /mg·L-1Concentration接种苗数Inoculated shoots分化数量No. of differentiation0118411581231011015130
表4芽转移至1/2 MS培养基中的生根率
Table4 The germination rate of shoots was transferred to 1/2MS medium

培养瓶编号No.接种苗数Inoculated shoots生根率/%Rootting rate15100251003580
3 讨论与结论
水茄是优良的茄子砧木,对病虫害抗性较高,也是一种典型的镉低累积植物。水茄对镉累积水平较低,但对于其它微量元素的累积并无明显影响。因此在栽培重金属低累积蔬菜中具有重要的应用前景。随着有关植物镉累积现象数据的不断积累,已有越来越多的研究者将研究重点转移到植物低累积镉所涉及的生物化学、分子生物学和植物生理学等研究领域。这些研究为栽培镉低累积作物和蔬菜奠定了理论基础,并提供了基因资源。拟南芥等是人们研究新基因功能的主要模式植物。然而,现有的模式植物不能满足对重金属累积和耐受这一特殊生理过程的研究需要。所以,运用现代生物学研究技术,发展新的具有重金属低累积的模式植物,并与低累积植物进行比较研究,将使这一领域的研究规范化、深入化,达到事半功倍的效果。水茄蕴藏着丰富的基因资源,利用基因工程技术挖掘和转化其镉低累积相关基因,通过生物技术手段培育出具有产业化潜力的低累积重金属的植物品种,对于降低环境重金属污染以及提高人类食品的矿质营养、增进人类健康方面都具有重要应用价值,并将产生积极的社会效益、生态效益和经济效益。水茄具备较低的镉累积能力,并日益受到国内外研究者的重视。目前,鲜见关于水茄高效的愈伤诱导及组织培养方法的报道。与茄子相比,我国在茄子砧木水茄基因工程的研究相对较少,尤其是转基因技术研究,缺乏合适的遗传转化再生体系。
组织培养诱导分化效果受各种因素影响,外植体的类型及植物生长物质对其的诱导效应;激素的浓度、种类及其本身的双重作用或者极性运输、向性反应等特点;激素之间的促进或抑制作用等,都是再生体系建立的关键。前人研究中以水茄带芽茎段[10]、花药[11]和子叶[12]为外植体,但综合考虑其诱导效率及在遗传转化中的适用性和高效性,可以再作进一步的优化研究。本研究以水茄种子实生苗下胚轴作为外植体,分析了合适的激素配比对下胚轴外植体愈伤组织诱导和植株再生的影响,找到了最优的愈伤诱导、分化培养基和生根培养基,同时摸索了以潮霉素作为筛选压的合适浓度。ZT和6-BA 是植物组织培养中,广泛应用的植物生长调节物质[13]。不同的生长调节物质诱导的愈伤组织类型不一样[14],对芽分化的诱导效果也各不相同。本试验中,当6-BA的浓度大于等于3 mg·L-1和NAA的浓度大于等于0.1 mg·L-1时,两激素搭配的培养基上的外植体形成大量的愈伤,但是分化的芽很少;且NAA的浓度大于等于0.2 mg·L-1时形成的愈伤呈白色至淡黄色松软团状,长根早且根系较发达。6-BA的浓度大于等于3 mg·L-1时,抑制了IAA对芽的诱导分化。ZT的浓度大于等于2 mg·L-1,与其组合的激素配方抑制愈伤组织分化。TDZ诱导分化出丛生芽。B1K1.5I0.2、I0.1Z1等配方中的外植体其中一端分化几乎滞停,可能是激素极性运输的影响。不同外植体再生能力的不同是组织培养中常见现象。理论上讲,每一个植物细胞都有全能性,但并不是所有体细胞都能够再生植株,不同分化程度体细胞脱分化能力相差很大[14]。在本研究中也发现了这一点,在B1Z2I0.2、N0.1Z3、B2N0.3G0.25等配方中,下胚轴的分化能力很弱,甚至很难形成愈伤。
试验结果表明,最佳的愈伤诱导和分化培养基为:MS+6-BA 2 mg·L-1+IAA 0.1 mg·L-1,愈伤诱导率为100%,芽增殖率达100%,芽分化增殖系数为6.62;在继代培养中,使用MS+6-BA 2 mg·L-1+IAA 0.1 mg·L-1即可维持较高的增殖系数 6.62;最佳的生根培养基为1/2MS培养基,生根率可达90%以上,移栽成活率基本达到100%。这些研究,不但有利于今后利用生物技术培育水茄新品种,同时也为深入研究水茄重要功能基因,包括抗虫、抗病、重金属低累积关键基因的功能研究提供了技术保障。

