铝添加量对Cu/ZnO/Al2O3甲醇合成催化剂性能的影响
, , , , , 玉龙,
(北京低碳清洁能源研究院, 北京 102211)
煤炭是中国最为丰富的化石能源,长期以来为中国的经济发展提供了重要的能源保障。随着经济发展从重数量向重质量的转变以及社会对环境保护的日益关注,煤炭的清洁高效利用受到越来越多学者的重视。作为煤炭清洁利用的关键技术之一,煤炭气化及其下游的合成气合成工业吸引了众多学者的探索研究[1,2]。甲醇是一种重要的传统化工原料,可以直接用来生产二甲醚、甲醛、醋酸、甲酸甲酯等化学品;它也是新型煤化工的重要组成部分,可用于生产乙烯、芳烃等石油化工产品。此外,它还是一种清洁的液体燃料,用作汽车燃料可减少尾气中含硫、含氮等污染物的排放。以煤炭为原料生产甲醇,再将甲醇转化为依赖石油化工的化学品,是一条有潜力的煤代替油的技术路线[1]。目前,工业上用合成气生产甲醇主要采用Cu/ZnO/Al2O3催化剂,在5-10 MPa和230-280 ℃的条件下进行,一般认为铜锌结构是催化剂的活性组分,铝元素用作催化剂的结构助剂[3-5]。
甲醇合成催化剂的制备常采用共沉淀法,即用铜、锌、铝三种元素的混合盐溶液与沉淀剂作用发生沉淀反应生产[6],为获得较好的催化性能,三种金属离子的常用物质的量比Cu2+∶Zn2+∶Al3+=60∶30∶10[7,8]。铝元素的适量添加能够提高催化剂的比表面积和铜分散度,改善催化剂的性能[4,9];而在过量添加的情况下会对催化剂性能造成不利影响,一种解释是在增加铝元素比例的同时,催化剂中的活性组分如铜元素比例会相应下降,导致催化剂活性降低;另一种解释是在共沉淀条件下增加铝元素比例会诱发类水滑石的形成,对催化剂性能产生不利影响[10,11]。
有文献报道采用分步沉淀法制备甲醇合成催化剂,认为这种方法可以增加铜元素与锌元素之间的协同作用,有利于提高催化剂的性能[12,13]。而采用分步共沉淀法制备铜基甲醇催化剂时合适的铝元素物质的量比是否在10%左右,文献报道还较少。本工作采用分步沉淀法制备出铝含量不同的甲醇合成催化剂,对铝元素的添加量进行优化,并通过一系列表征和评价结果尝试进一步解释铝元素添加对甲醇合成催化剂的物理化学和催化性能的影响。
1 实验部分
1.1 催化剂的制备
催化剂制备的原料有Cu(NO3)2·3H2O、Zn(NO3)2·6H2O、Al(NO3)3·9H2O和沉淀剂Na2CO3,均为分析纯,由北京国药试剂有限公司提供。在催化剂制备过程中,分别配制1 mol/L的铜锌混合盐溶液、铝元素的盐溶液和沉淀剂Na2CO3溶液。首先用蠕动泵将铝元素的盐溶液与Na2CO3溶液同时滴加到水浴烧瓶中,水浴温度为80 ℃,滴加过程伴随着剧烈搅拌,通过调节沉淀剂的滴加速率控制沉淀母液的pH值在7.0-8.5,之后再滴加铜锌的混合盐溶液。催化剂的组成见表1。
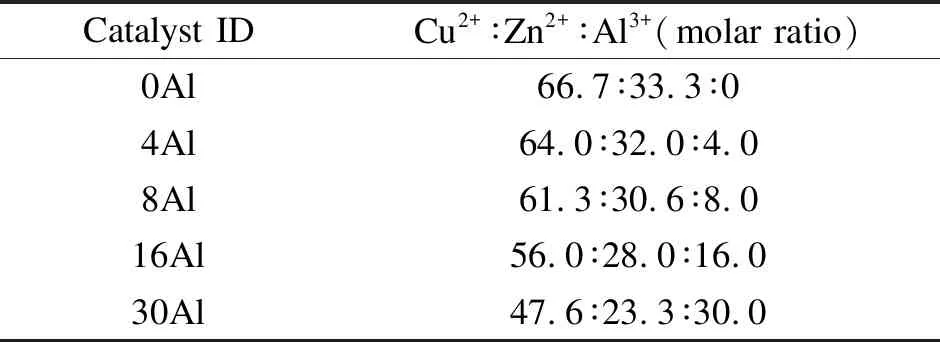
表 1 甲醇合成催化剂样品的设计元素组成
沉淀结束后,获得的沉淀物在母液环境下老化2 h,之后洗涤、过滤除去沉淀物附带的其他盐离子,当滤液电导率低于30 μs/cm时完成洗涤。在110 ℃下干燥12 h获得催化剂前驱物,在350 ℃的条件下焙烧4 h,获得氧化态催化剂粉末,经过压片、破碎、筛分获得60-100目的用于评价的催化剂颗粒。
1.2 催化剂的表征
实验采用Bruker D8X射线衍射系统对催化剂样品进行X射线衍射(XRD)分析,管电压/管电流为40 kV/40 mA,采用CuKα射线(0.15406 nm),扫描速率为2(°)/min;采用Rigaku ZSX Primus IIX-Ray荧光光谱仪(XRF)分析催化剂的实际元素组成;采用Netzsch STA 449F3 Jupiter热重分析仪与MS403C Aeolos质谱联用(TG-MS)分析催化剂前驱物的热解过程,在空气气氛下以10 ℃/min升温至110 ℃,停留30 min,继续升温至750 ℃;采用Micromeritics Tristar 3000分析设备对催化剂样品的比表面积、孔径等参数进行分析。催化剂的H2程序升温还原实验(H2-TPR)在Micromeritics AutochemII 2920自吸附装置上进行,将50.0 mg样品装入U型反应管,首先在Ar气氛下升温至120 ℃处理30 min,随后降至室温,在10% H2/Ar气氛下以10 ℃/min升温至900 ℃,采用TCD检测器分析H2的消耗情况。
1.3 催化剂的评价
实验采用德国HTE公司生产的16通道微型多管组合式反应装置对催化剂进行评价,装置示意图见图1。
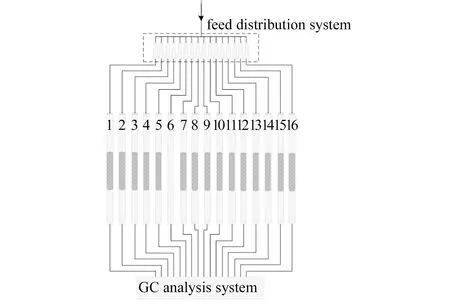
图 1 甲醇合成催化剂高通量评价装置示意图
该装置通过毛细管分流系统,将一路原料气体均匀地分流成16路,分配到16根管式反应器中,各反应管内原料气体流量相同,组分具有很好的一致性。实验压力为4 MPa,反应温度为230 ℃,催化剂装填量为0.8 g,空速为8000 h-1。设计的原料气体积组成为:CO 13%、CO21.2%、H280%、Ar 5.8%,气体由北京氦普北分气体工业有限公司提供。催化剂粒径为60-100目,装填时采用同粒度的石英砂与催化剂相互掺混。其中,6号反应管填充同粒度的石英砂,用于在线检测原料气体组成。
在对催化剂进行还原后,通入的原料气在催化剂作用下发生反应,反应后的气体,包括甲醇,进入到气相色谱仪分析气体组成。通过加热带加热稳定气体产物温度在120 ℃,GC分析系统轮流对每一个反应管出口处的气体样品取样并进行检测。在反应24 h之后,将温度升至320 ℃,恒温24 h对催化剂进行热处理;之后将温度降至230 ℃,对热处理之后的催化剂活性进行评价。
数据处理包括实时原料气体组成的确定和CO转化率的计算。
实时原料气体组成。通过对6#管出口处的气体样品进行检测分析,并对多次取样的结果求平均值,获得实时原料气体组成为:H279.82%、CO 12.68%、CO21.29%以及Ar 6.21%。
CO转化率计算。以Ar为标准气体计算CO的转化率:
(1)
式中,x为CO转化率;yi,0为实时原料气体组成中CO的摩尔分数;yi为出口气体产物中CO的摩尔分数。
2 结果与讨论
2.1 前驱物表征
图2为催化剂前驱物样品的XRD谱图随铝元素的添加量增加所产生的变化。在沉淀法制备甲醇催化剂过程中常见的三种前驱物结构有锌孔雀石((Cu,Zn)2CO3(OH)2)、绿铜锌矿((Cu,Zn)5(CO3)2(OH)6)和类水滑石化合物(如:(Cu,Zn)6Al2(OH)16CO3·4H2O)[11,14]。甲醇合成催化剂的前驱物组成与最终的催化性能密切相关,一般认为锌孔雀石和绿铜锌矿是催化剂活性组分的前驱物[15],而类水滑石的形成对催化剂是不利的[5]。由图2可知,本实验条件下获得的主要前驱物是锌孔雀石,随着铝元素的添加,有少量的类水滑石化合物生成(样品16Al和30Al)。它们的衍射峰信息见表2。与一步共沉淀法获得的样品相比[16],本实验前驱物中类水滑石的衍射峰强度显著降低(如:11.75o),表明类水滑石的生成受到抑制,有利于提高催化剂的性能。
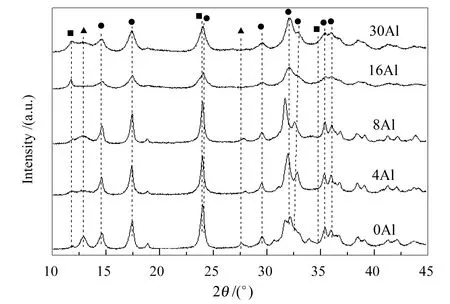
图 2 甲醇合成催化剂前驱物样品的XRD谱图
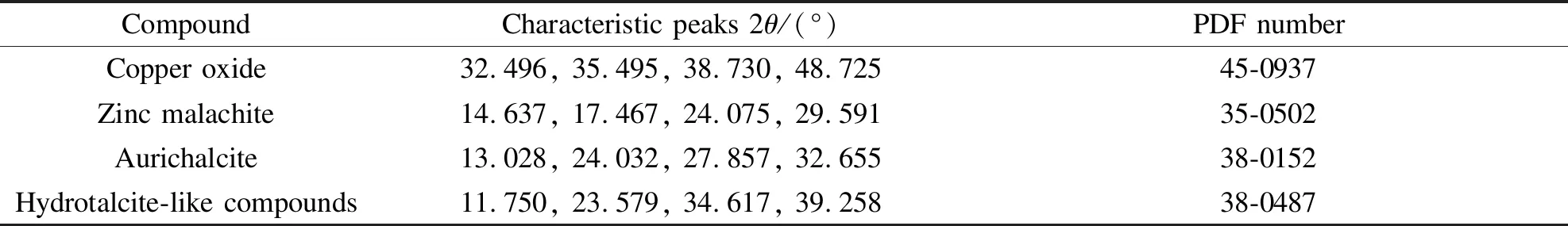
表 2 XRD分析矿物的特征衍射峰和PDF编号
图3为催化剂前驱物的DTG-MS分析结果。由图3可知,前驱物的失重主要是由前期Al(OH)3的脱水和中后期碱式碳酸盐的分解释放CO2和H2O造成的。在热解前期,随着铝含量的增加,脱水产生的失重峰越来越明显,认为是Al(OH)3分解释放H2O产生的,同时这一阶段CO2的释放也随着铝含量的增加变得较为明显;当温度升高至360 ℃左右时,出现一个脱除CO2和H2O的失重峰,如样品0Al和8Al的结果所示,但这一失重峰随铝含量的增加越来越弱;随着温度的进一步升高,在510 ℃左右出现一个因CO2脱除产生的失重峰,如样品16Al和30Al的结果所示,这个失重峰的比例随铝含量增加越来越高。锌孔雀石和绿铜锌矿碱式碳酸盐的分解分为两步:首先是400 ℃之前的初步分解脱除H2O和CO2并形成高温碳酸盐的过程;第二步是500 ℃左右高温碳酸盐的分解过程[15,17,18]。从本实验结果CO2的脱除历程可以看出,铝含量的增加使碱式碳酸盐第一步的分解温度提前,同时促进了高温碳酸盐的形成。Baltes等[8]研究发现,高活性的催化剂样品中常含有焙烧后残留的碳酸盐相,认为这些碳酸盐相有利于小粒径的铜颗粒的形成。Schumann等[15]的研究认为,催化剂样品中高温碳酸盐的存在有利于保留铜颗粒的高分散性,使之免受高温焙烧的不利影响。

图 3 催化剂前驱物的热重质谱联用分析(10 ℃/min, 空气气氛)
2.2 焙烧后样品的表征
图4为焙烧后样品的XRD结果,呈现的主要是CuO的特征衍射峰,ZnO和Al2O3可能以无定形态或微晶的形式存在未被检测到。由图4可知,随着铝含量的增加,CuO的衍射峰强度逐渐减弱,表明铝元素的添加有利于小粒径CuO晶粒的生成,对铜元素在催化剂中的均匀分散有促进作用。表3列出了焙烧后样品的实际元素比例,与催化剂的设计组成基本一致。表3还列出了催化剂样品的比表面积、孔体积和平均孔径的数据。由表3可知,铝元素的添加对催化剂的比表面积有很明显的促进作用,特别是样品30Al。可能原因是添加的铝元素在焙烧后的样品中大量形成γ-Al2O3,增大了催化剂的比表面积。

图 4 焙烧后催化剂样品的XRD谱图Figure 4 XRD patterns of the calcined catalyst samples ◆: CuO
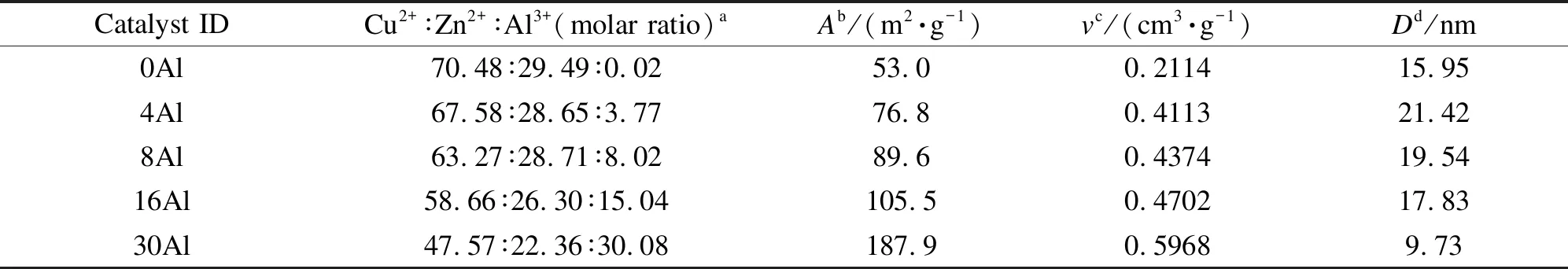
表 3 焙烧后样品的元素组成分析和比表面积
a: normalized results determined by XRF;b: specific surface area determined by N2physisorption;
c: pore volume determined by N2physisorption;d: pore diameter determined by N2physisorption
图5为不同铝含量焙烧后样品的H2-TPR谱图,对于铜锌铝三元素组成的甲醇合成催化剂,H2的消耗主要源自于CuO的还原。由图5可知,样品中CuO的还原均在100-200 ℃完成,在低铝含量的情况下呈现出一个较为尖锐的还原峰伴随着一个肩峰;而随着铝含量的增加,初始的尖锐峰逐渐消失,最终呈现出一个弥散的还原峰,如样品16Al和30Al的结果所示。氧化铜还原峰的解释有各种说法。Gao等[19]认为,低温还原峰是高分散性的CuO还原导致的,而高温还原峰是大的CuO颗粒还原产生的。Bahmani等[12]认为,CuO的还原峰可以分解为三部分,低温峰代表高分散性的CuO颗粒的还原,中温峰代表与ZnO有接触的大颗粒CuO的还原,而高温峰代表单独存在的大颗粒CuO的还原。Kühl等[20]认为,低温还原峰是CuO被还原为Cu2O产生的氢气消耗导致的,高温还原峰是Cu2O的进一步还原造成的。在本实验条件下,结合DTG-MS结果的分析,认为初始的尖锐峰源自于结晶度较好的碱式碳酸盐热解产生的CuO的还原,肩峰来自于高温碳酸盐的进一步分解产生的CuO。结晶度较好的碱式碳酸盐表现在空气中的热解温度在360 ℃左右,如图3所示,而在还原气氛下碱式碳酸盐和高温碳酸盐分解提前[15],高温碳酸盐的分解较为缓慢,使之后的还原峰以肩峰的形式呈现。随着铝含量的增加,部分碱式碳酸盐的结晶度降低,晶粒减小,使之第一步的分解温度提前,在DTG-MS图上表现为热解前期CO2的释放变得明显;结晶度较好的碱式碳酸盐比例下降,表现为360 ℃左右的失重峰随铝含量增加逐渐消失。小粒径的碱式碳酸盐晶体分解有利于促进高温碳酸盐的形成。这可以合理地解释本实验DTG-MS和H2-TPR的实验现象。
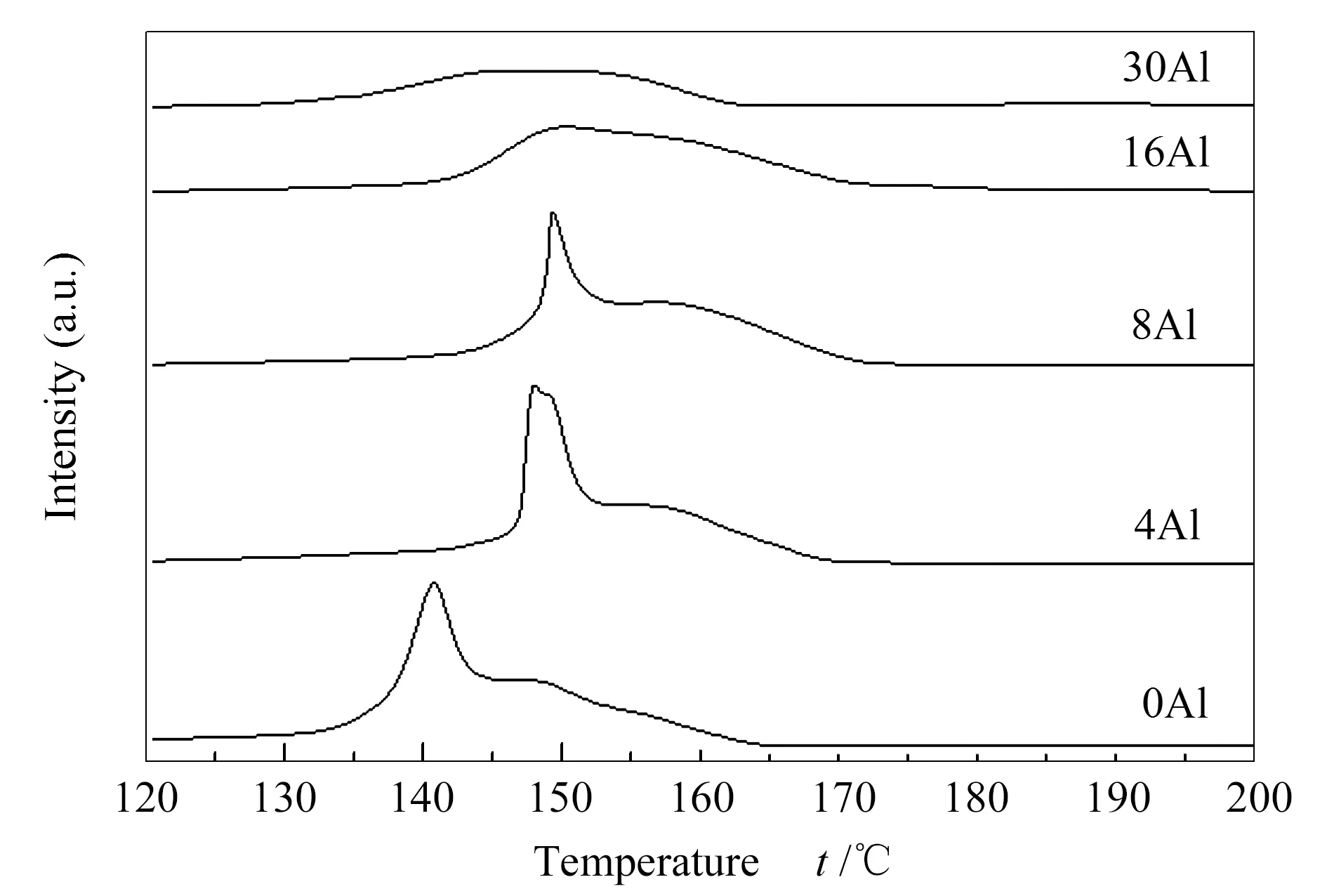
图 5 焙烧后不同铝含量催化剂样品的H2-TPR谱图(2 ℃/min,氢气气氛)
2.3 催化剂评价结果与讨论
合成气合成甲醇主要发生的化学反应有:
CO + 2H2CH3OH
(2)
CO2+ 3H2CH3OH + H2O
(3)
CO + H2OCO2+ H2
(4)
由于本实验评价条件下催化剂的甲醇选择性高,不同催化剂之间的甲醇选择性差别细微[16],这里主要以CO转化率为指标对催化剂的活性和热稳定性进行比较,具体见图6。评价程序为:初始反应24 h后,将反应温度升高至320 ℃,停留24 h,之后再降低至230 ℃测试催化剂活性。由图6可知,随着铝元素的添加,催化剂的CO转化率有明显上升;对铝含量较高的样品16Al和30Al,其CO转化率基本一致,但样品16Al比30Al的铜元素要高出20%。比较热处理之后的催化剂,可以看到,样品0Al的CO转化率下降幅度最大,添加少量铝元素后,催化剂的失活即受到明显抑制。之后随着铝元素的继续增加,催化剂热稳定性的提高不如之前明显。评价结果显示,当铝元素摩尔含量增加到30%时,样品30Al仍具有着较高的活性和热稳定性,不失为一种良好的甲醇合成催化剂。
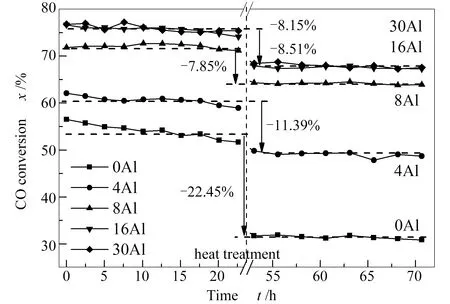
图 6 甲醇合成催化剂样品的活性和热稳定性
结合催化剂的表征结果可以推测,在本实验条件下铝元素的增加可以持续提高铜颗粒的分散性。具体表现为使活性组分前驱物碱式碳酸盐的结晶度下降,增加高温碳酸盐产物的比例,使还原后的催化剂容易形成小粒径的铜颗粒,因而可以不断提高单位质量铜元素的催化活性。有报道称沉淀过程中有约3%的Al3+可以掺杂进入到碱式碳酸盐结构中[9],这可能是少量铝元素显著促进催化剂热稳定性的原因。继续增加铝含量在热稳定性上促进不明显的可能原因是催化剂内Cu晶粒偏小时,ZnO晶粒对Cu晶粒长大的抑制作用有限,反应过程中反而易发生晶粒长大的现象,不利于催化剂的热稳定性。Behrens等[21]研究认为,反应过程中甲醇合成催化剂合适的铜颗粒粒径在10 nm左右。
3 结 论
本研究制备出一系列铝含量不同的甲醇合成催化剂,考察了铝元素的添加对催化剂性能的影响。结果表明,本实验条件下制备的催化剂前驱物中类水滑石组分低,随铝含量升高其形成不明显。铝元素的添加使前驱物中碱式碳酸盐的第一步热解温度降低,并易形成高温碳酸盐相,促进了小粒径铜颗粒的形成。铝含量的增加使焙烧后催化剂的比表面积明显增大。铝元素的加入对催化剂热稳定性有明显促进作用,随铝含量继续增加这种促进作用减弱。铝含量的增加能持续提高催化剂中的铜颗粒的分散度。在本实验条件下铝元素摩尔含量增长至30%时,催化剂仍具有较好的活性和热稳定性。

