丹参水提液对碘乙酸钠所致大鼠骨关节软骨退变的预防作用
闵亚林,姜思羽,吴迪生,陈文双,许碧莲,
(广东医科大学1. 药理学教研室、2. 广东天然药物研究与开发重点实验室,广东 湛江 524023)
骨性关节炎(osteoarthritis, OA)是由创伤、肥胖、衰老、遗传等许多因素引起的关节软骨损伤退化、软骨下骨及关节增生的一种退行性病变[1]。据统计报道,肥胖和人口老龄化常常伴随着OA的产生,男性的患病率往往低于女性,OA影响着越来越多的人[2]。据预测,到2020年,OA将是40岁人群发病和身体局限的主要原因。如何防治OA,是人们亟待解决的难题。丹参是天然的传统中药,具有抗炎、抗菌、抗氧化等药理作用,特别是对心血管系统、神经系统有较强的药理活性,主要含有脂溶性成分丹参酮和水溶性成分丹参酚酸、丹参素等[3]。有研究表明,丹参酮防治OA可能是通过提高软骨细胞的活性,对抗氧自由基来防止软骨的破坏[4]。文献报道[5-6],丹参注射液可以抑制体外兔软骨细胞凋亡,关节腔注射丹参注射液治疗OA,可以缓解膝关节软骨退变。丹参水提液(water extract of Danshen, DWE)是否可防治大鼠OA,尚未见报道。因此,本实验采用关节腔内注射碘乙酸钠(monosodium iodoacetate, MIA)建立大鼠OA模型,通过ELISA法、组织病理学、Micro-CT等技术,探讨DWE对MIA所致大鼠骨关节软骨退变的预防作用,为OA的治疗提供新的思路。
1 材料与方法
1.1实验动物SPF级6月龄SD ♀大鼠27只,体质量(286±19)g,购自广西医科大学实验动物中心,合格证号:SCXK 桂 2014-0002。开始实验前适应性饲养1个月,实验时平均体质量为(295±22)g。每周称量体质量1次,且称量前1 d禁食、不禁水。
1.2药物与试剂MIA(货号:305-53-3,批号:19148),购自美国Sigma公司,避光称量120 mg MIA粉末于5 mL无菌EP管中,加入3 mL生理盐水,配成浓度为60 g·L-1MIA溶液(造模前1 d配制,避光保存于4 ℃备用)。丹参购自黄冈金贵中药产业发展有限公司,批号:D7020305,将一定的丹参药材与单蒸水煎煮,浓缩成一定体积,以丹参素为含量计算,得到的DWE含丹参素浓度为1~1.2 g·L-1。基质金属蛋白酶13(matrix metalloproteinase 13, MMP-13)ELISA试剂盒,武汉伊莱瑞特生物科技股份有限公司;白介素6(interleukin 6, IL-6)ELISA试剂盒、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)ELISA试剂盒,均购自杭州联科生物技术股份有限公司;改良番红O-固绿软骨染色液,索莱宝科技有限公司。
1.3仪器石蜡切片机(德国Leica公司);光学显微镜(日本Nikon公司);viva Micro-CT 40(瑞士SCANCO Medical AG);AE240电子天平(梅特勒·托利多仪器公司上海分公司)。
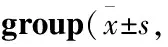
Tab 1 Body weight changes of rats in each experimental n=9)
1.4方法27只♀ SD大鼠随机分为3组,每组9只,分别为:假手术组(Sham)、MIA组、DWE组。Sham组在大鼠左侧膝关节腔内注入生理盐水50 μL,MIA与DWE组在大鼠左侧膝关节腔内注入MIA溶液50 μL[7]。注射MIA后d 2开始灌胃给药,Sham与MIA组给予生理盐水5 mL·kg-1, DWE组给予DWE 5 mL·kg-1。所有大鼠每天灌胃1次,连续给药6周,每周称体质量1次,并按大鼠体质量变化调整给药量。实验结束,麻醉后心脏采血处死,分离血清,-80 ℃保存备用。取左侧胫骨和股骨用10%中性甲醛固定12 h,换70%乙醇保存,备用。
1.5血清相关指标的检测采用ELISA法检测血清中MMP-13、IL-6、TNF-α水平,具体方法按照试剂盒说明书操作。
1.6Micro-CT检测扫描前,取胫骨浸泡于显影液中,水浴锅恒温(37 ℃)浸泡20 min进行扫描。扫描参数为:图像矩阵为2 048×2 048×223,整合时间为200 ms,能量/强度为45 kVp、177 μA、8 W,以1 200 mg HA/cm校正CT值,0角度旋转,进行扫描。扫描完成后,用Micro-CT自带软件对骨组织重组图像进行三维旋转,以确保横向轴与垂直轴对齐,进行定量分析内侧关节面软骨厚度时,选取以正中心前后各2.0 mm,共层厚4.0 mm的关节组织为测量区域(regional of interest, ROI)进行三维图像重组,以最低阈值为170提取图像信息。在对应的关节面ROI下对软骨以及软骨下骨小梁进行三维图像重组。可得到以下参数:软骨体积(cartilage volume)、软骨厚度(cartilage thickness)[8]。分析重建后的软骨体积和软骨厚度,可以反映软骨的破坏程度。软骨体积越小、厚度越薄,则表示软骨退化、结构破坏越严重。
1.7番红O-固绿软骨染色检查将股骨脱钙、脱水、透明、石蜡包埋,4 μm厚度的组织切片备用。将股骨石蜡切片经过烤片、脱蜡、染色、封片,得到番红O-固绿染色组织片[9]。做OARSI(Osteoarthritis Research Society International, OARSI)病理学评分[10]。
2 结果
2.1各组大鼠一般状态和体质量变化在进行OA造模时,关节腔注射MIA的大鼠膝关节从进针处开始出现红斑,肿胀现象随时间逐渐蔓延到整个膝关节,关节出现红肿热痛,大鼠行动减少,左后肢屈缩、跛行,进食量下降,精神萎靡,体质量下降。注射生理盐水的大鼠起初会出现红斑,但数小时后红斑消退。1周后,大鼠精神状态和进食慢慢恢复,随着给药的进行,DWE组的肿胀程度较MIA组轻,活动较MIA组灵敏,Sham组大鼠膝关节无肿胀且活动灵敏。整个实验过程中,除了造模后的1周体质量有所下降,各组大鼠的体质量都有所增加,但是体质量差异无统计学意义(Tab 1)。
2.2各组大鼠血清生化指标的变化由Fig 1可见,与Sham组相比,MIA组血清MMP-13水平明显升高(P<0.01),IL-6和TNF-α有上升的趋势,但无统计学意义(P>0.05)。与MIA组相比,DWE组的MMP-13水平明显降低(P<0.05),IL-6和TNF-α有降低的趋势,但无统计学意义(P>0.05)。
2.3各组大鼠胫骨关节面内侧软骨Micro-CT的变化
2.3.1各组大鼠胫骨关节面内侧软骨Micro-CT定量参数的变化 由Fig 2可见,与Sham组相比,MIA组的软骨厚度和软骨体积均明显减小(P<0.01);与MIA组相比,DWE组的软骨厚度和软骨体积均明显增加(P<0.01,P<0.05)。
2.3.2各组大鼠胫骨关节面内侧软骨Micro-CT的二维、三维图结构变化 由胫骨内侧软骨Micro-CT的二维图与三维图可见(Fig 3),与Sham组相比,MIA组软骨厚度明显变薄;与MIA组相比,DWE组的软骨厚度有所增厚。
2.4各组大鼠股骨内侧关节软骨番红O-固绿染色变化番红O-固绿染色结果显示(Fig 4),Sham组关节软骨无骨关节炎表现,表面完整、平滑,软骨细胞排列正常,数量正常,核染正常,软骨基质着色鲜红;MIA组关节面糜烂、缺损、变形,损伤占比超过50%,软骨结构消失,软骨层进行性丧失或者损坏,软骨细胞数量减少,排列紊乱,有簇集现象,软骨基质着色变浅;DWE组损伤占比在10%~25%之间,软骨表面稍不平整,局部出现软骨细胞簇集,细胞数量减少,基质着色变浅。将染色的组织片经过OARSI病理学评分,结果如Fig 5所示,与Sham组比较,MIA组大鼠股骨关节面软骨OARSI病理学评分明显提高(P<0.01);与MIA组比较,DWE组大鼠关节面软骨OARSI病理学评分明显降低(P<0.01)。
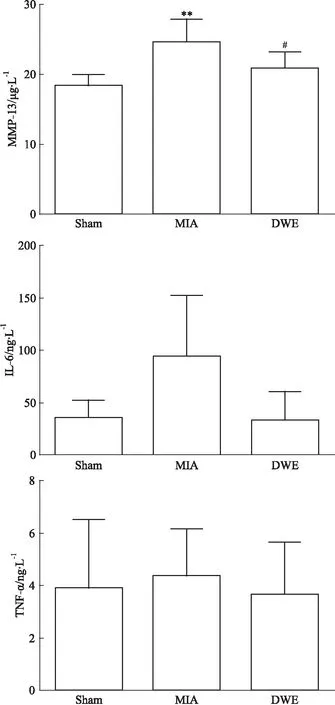
Fig 1 Changes in serum biochemical parameters of rats in each n=8)
**P<0.01vssham group;#P<0.05vsMIA group
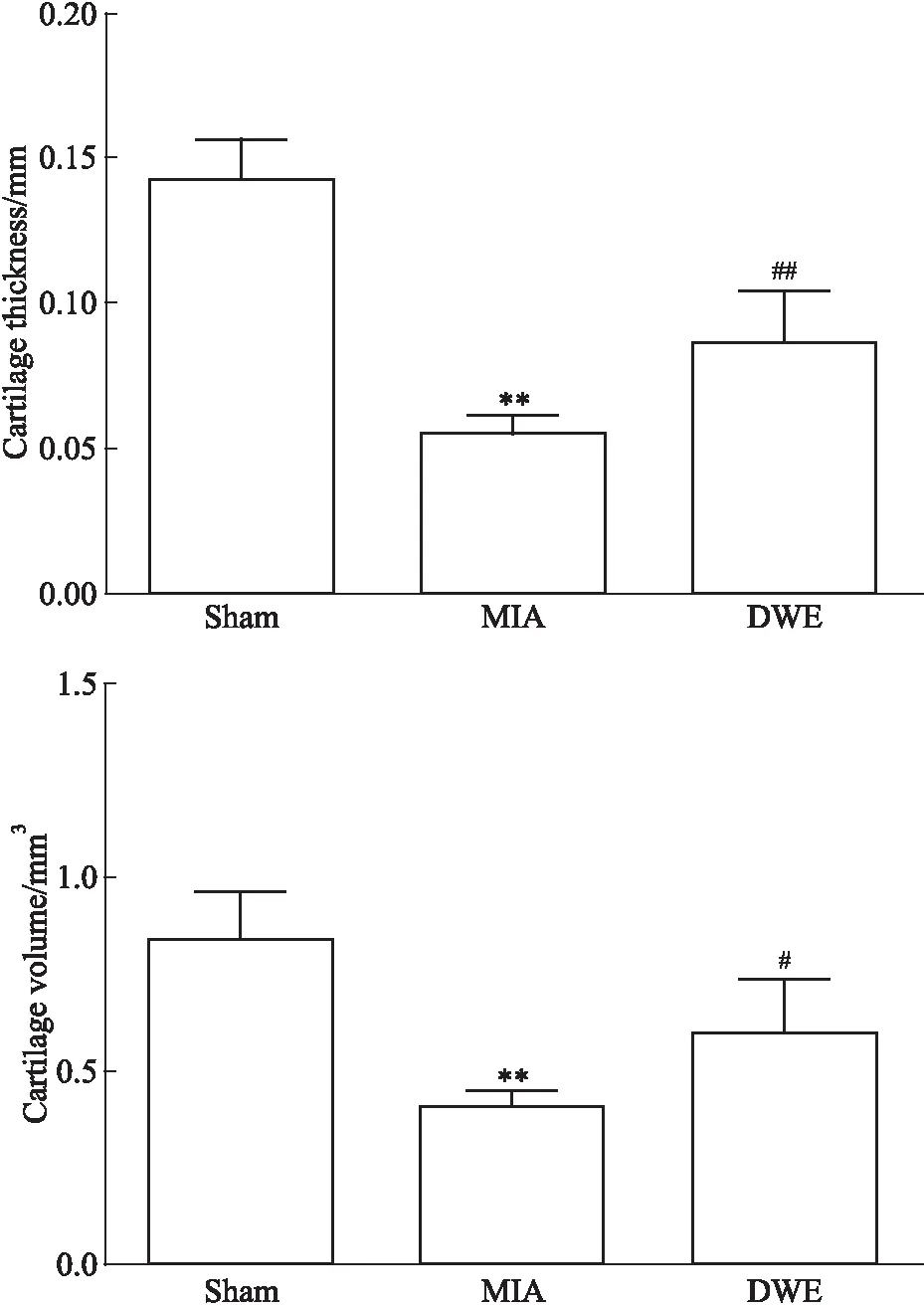
Fig 2 Changes of medial cartilage thickness in tibia and articular surface of rats in each
**P<0.01vssham group;#P<0.05,##P<0.01vsMIA group
3 讨论
随着人口老龄化问题的突出,OA已成为提高中老年人生活质量的一大障碍,因此,建立合适的动物模型来研究OA非常重要。本实验通过关节腔内注射MIA诱发OA模型,手术简单方便、造模时间短、造模稳定、受其他因素干扰少,且造成关节渐进性退变[11]。从大鼠胫骨关节面内侧软骨的Micro-CT结果可以看出,与Sham组相比,MIA组的软骨厚度明显变薄,软骨体积减少,提示关节腔内注射MIA可导致大鼠胫骨关节面软骨退化和结构破坏。从大鼠股骨关节面内侧软骨番红O-固绿染色的组织切片及病理学评分结果可以看出,MIA组关节面糜烂、缺损、变形,损伤占比超过50%,软骨结构消失,软骨层变薄,软骨细胞数量变少,排列紊乱,有簇集现象,软骨基质着色变浅。与Sham组相比,MIA组的OARSI病理学评分明显提高,提示关节腔内注射MIA可导致大鼠股骨关节面软骨退化和结构破坏。结果进一步说明,大鼠关节腔内注射MIA可以诱发OA。MIA能使软骨细胞凋亡、软骨基质降解,是一种甘油醛-3磷酸脱氢酶抑制剂[12]。在大鼠关节腔注射MIA后,会导致关节软骨出现损伤,出现软骨蛋白多糖基质的丢失和关节功能障碍等类似于人类OA发病时的症状[13]。MIA可能活化caspase-3来诱导大鼠软骨细胞凋亡[14],但是其确切的机制尚未明确。
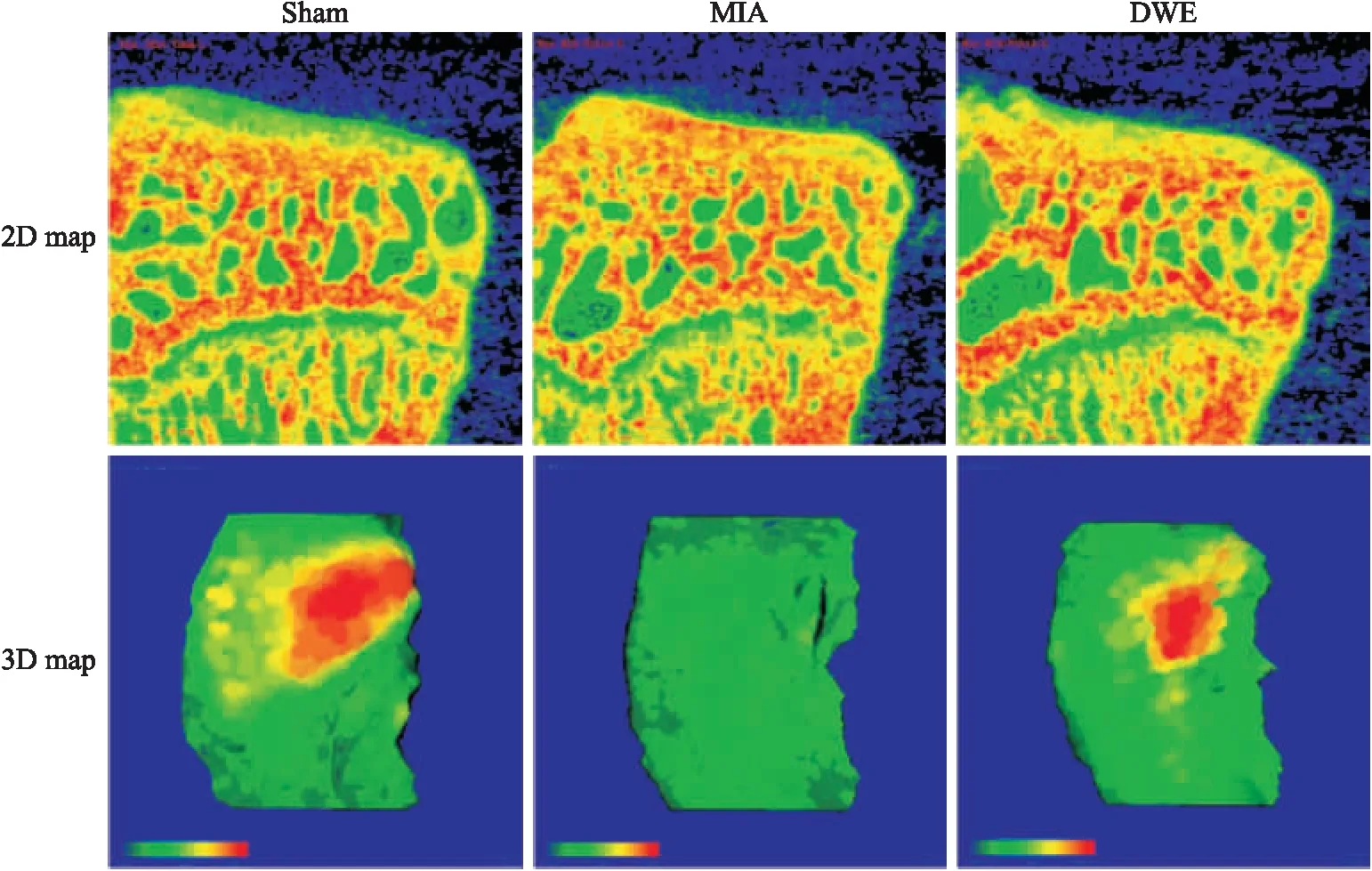
Fig 3 Micro-CT 2D map and 3D map of medial cartilage thickness of each group
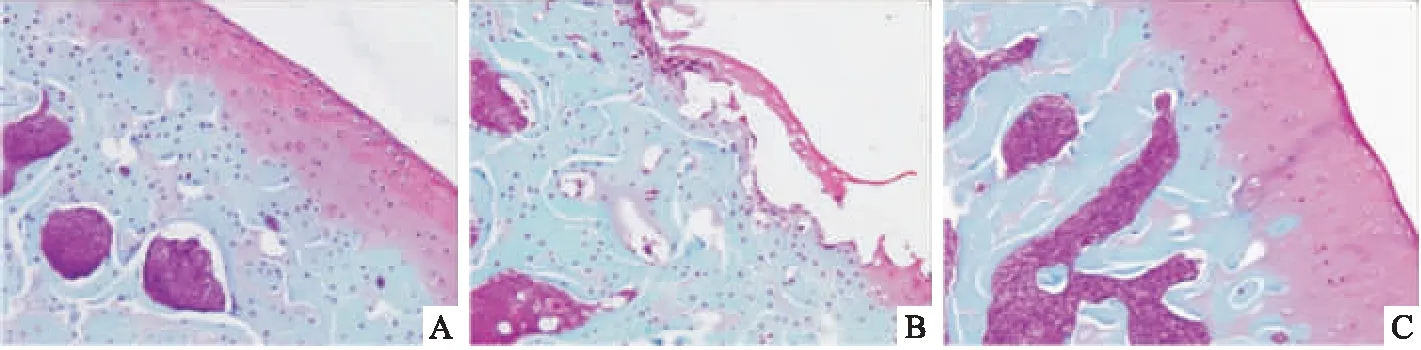
Fig 4 Histopathological observation of femoral medial articular cartilage in each group(Safranine O-fixed green staining,×200)
A: Sham; B: MIA; C: DWE.
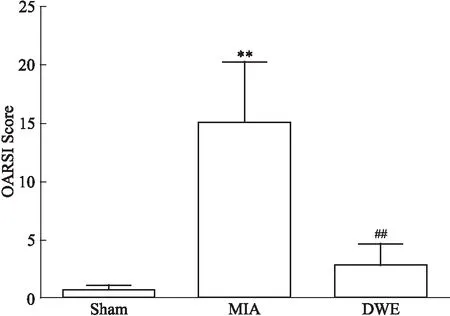
Fig 5 OARSI score of femoral medial
**P<0.01vssham group;##P<0.01vsMIA group
由大鼠胫骨关节面内侧软骨的Micro-CT结果可以看出,DWE组的软骨厚度和软骨体积均比MIA组明显增加,提示DWE可延缓MIA所致大鼠胫骨关节面的软骨退化和结构破坏。从大鼠股骨关节面内侧软骨番红O-固绿染色的组织切片及病理学评分结果可以看出,DWE组损伤占比在10%~25%之间,软骨表面稍不平整,局部出现软骨细胞簇集,细胞数量变少,基质着色变浅。此外,DWE组OARSI病理学评分明显比MIA组低,提示DWE可延缓MIA所致大鼠股骨关节面的软骨退化和结构破坏。结果进一步说明,DWE对MIA所致大鼠骨关节软骨退变有一定的保护作用。
由血清检测结果可见,DWE组的MMP-13水平比MIA组低,提示丹DWE延缓MIA所致大鼠骨关节软骨退化的作用可能与抑制MMP-13有关。文献报道,丹参注射液减轻软骨损伤可能是通过修正在OA软骨组织中MMP-9和TIMP-1的异常表达[5],也可能是通过抑制软骨细胞线粒体调亡通路信号转导,进而抑制其凋亡[6]。但是DWE的确切作用机制,还有待于深入研究。丹参分为脂溶性和水溶性两大类成分,水溶性成分主要为酚酸类化合物,具有改善微循环、增强耐缺氧能力、保护脑组织缺血/再灌注损伤、抗炎、抗氧化等药理活性。此外,丹参水溶性成分还可通过抗氧化应激作用而调节骨代谢[15]。文献报道,氧化应激在MIA诱导大鼠软骨细胞凋亡过程中起着重要的上调作用[14]。DWE防治大鼠OA的作用是否与其抗氧化应激作用有关,还有待于深入研究。

