恒温发酵温度对发酵牦牛肉灌肠理化性质的影响
,,, ,
(西南民族大学生命科学与技术学院,四川成都 610041)
发酵肉灌肠是将动物肌肉组织和动物脂肪组织按一定比例混合通过人工或机械加工成泥状,加入调味料、发酵剂以及其他辅料,然后灌入肠衣,经过环境的作用和微生物发酵而制成的发酵肉制品。发酵肉灌肠风味独特,而且易于被人体消化吸收,符合人群对肉制品营养、质量、口味、安全等多方面的要求,是未来肉制品行业的发展趋势[1-2]。
牦牛是青藏高原及其周边区域耐高寒、耐粗饲的特有牛种,生长在海拔3000 m以上的高寒草地。牦牛肉富含蛋白质、氨基酸、矿物质(Zn、Fe、Ca等)、VA、VB和VE等营养成分,安全无污染[3],是优质的动物性食品原材料。中国现有牦牛1400多万头,占世界牦牛总数的92%以上[4]。目前市面上牦牛肉制品中风干牦牛肉所占比重较大,但是,风干牦牛肉制品质构较硬,不适合儿童和老年人群食用,而且制作过程漫长,手法粗糙,成品卫生多不达标,腐败变质现象严重。利用牦牛肉制作发酵肉灌肠,不仅可以延长保藏时间,提高牦牛肉制品的营养价值,还可以丰富牦牛肉制品市场产品种类,增加牦牛肉制品消费者人群。
目前,国内有关普通肉类发酵灌肠的研究有较多报道。何凡等人[2]研究了猪肉发酵香肠在不同贮藏温度下的理化特性的变化情况;王俊等人[5]研究了自然发酵和用干酪乳杆菌作为发酵剂发酵的猪肉灌肠在成熟过程中理化性质的变化;孙来华[6]研究了羊肉发酵香肠的微生物特性和理化特性。但是,利用牦牛肉作为原料并加入发酵剂,在不同发酵温度下研究不同恒温发酵温度对牦牛肉灌肠发酵后理化性质的影响尚未见报道。
本试验通过保持主发酵过程中牦牛肉灌肠的原料肉、发酵剂和配料等因素不变,综合传统发酵肉灌肠加工工艺参数、所选取的乳酸菌菌种特性等因素并进一步优化后,分别设置了25、30、35、40 ℃四个不同温度梯度进行恒温发酵,研究发酵温度对牦牛肉灌肠发酵后的pH、Aw、游离氨基酸、脂肪氧化产物,亚硝酸盐含量、色泽、质构等主要理化性质变化的影响,探讨适合制作发酵牦牛肉灌肠的主发酵温度,为牦牛肉灌肠的生产加工提供一些基础数据和理论依据。
1 材料与方法
1.1 材料与仪器
牦牛肉、猪肥膘、食盐、葡萄糖、海藻糖、亚硝酸钠(食品用)、猪肠衣 均购于成都市场;植物乳杆菌(Lactobacillusplantarum,L. p)和戊糖片球菌(Pediococcuspentosaceus,P. p) 均购于中国工业微生物菌种保藏中心;MRS增菌培养基和MRS琼脂培养基 均购于杭州微生物试剂有限公司;三氯乙酸、硫代巴比妥酸(TBA)、1,1,3,3-四乙氧基丙烷、柠檬酸钠、亚硝酸钠、硼砂、亚铁氰化钾、乙酸锌、对氨基苯磺酸、盐酸萘乙二胺、NaCl、HCl 均为分析纯;丙二醛标准储备液 准确称取1,1,3,3-四乙氧基冰烷0.0315 g,加纯水搅拌溶解,用100 mL容量瓶定容后,置于冰箱内保存备用。
HD-3A型智能水分活度测量仪 无锡市华科仪器仪表有限公司;MP511型实验室pH计 上海三信仪表厂;AD300S-H实验室数显分散均质机 上海昂尼仪器仪表有限公司;HH-6数显恒温水浴锅 常州国华电器有限公司;UV-1000型紫外可见分光光度计 翱艺仪器(上海)有限公司;TA.TX Plus质构仪 英国Stable Micro Systems公司;CR-400色彩色差仪 日本KONICA MINOLTA公司;S-433D型氨基酸分析仪 德国SYKAM公司;JYL-C022E料理机 九阳股份有限公司;绞肉灌肠一体机 永康市卓越塑胶有限公司;BCD-221TMBA 冷冻冰箱 青岛海尔股份有限公司;PL303电子天平 瑞士Mettler Toledo公司;DHP-9052电热恒温培养箱 上海齐欣科学仪器有限公司;SW-CJ-1F超净工作台 苏净集团安泰公司。
1.2 实验方法
1.2.1 发酵剂的制备 参考蒋云升等[7]和王永霞等[8]的方法并依据试验要求做一定修改。将植物乳杆菌和戊糖片球菌分别按V(菌液)∶V(培养基)=1∶18的比例接种于MRS增菌培养基中,然后在32 ℃的恒温培养箱内培养24 h,重复上述活化操作两次。当培养基内出现明显浑浊,表明活化完成,放入4 ℃冰箱内保存备用。利用稀释平板计数法,在MRS琼脂培养基上对活化后的菌种进行平板计数。
1.2.2 牦牛肉灌肠的制作
1.2.2.1 工艺配方 原料:牦牛肉80%、猪肥膘20%。辅料:以原料100%计,食盐3.5%、葡萄糖∶海藻糖=1∶1(5.6%)、亚硝酸钠(食品级)0.05%。
1.2.2.2 工艺流程 称肉→切块→混匀→腌制→绞肉→接种→灌肠→包扎→排气→主发酵。
操作细节:原料肉的处理:将称量所得到的原料肉,剔除筋膜、筋腱,用清水清洗后切成小块,沥干水分;混匀和腌制:将切好的原料肉混匀,加入辅料(按照1.2.2.1中的配方),搅拌均匀后,放入4 ℃冰箱腌制24 h;绞肉:用料理机将腌制好的原料肉绞成均匀的肉馅;接种:将植物乳杆菌和戊糖片球菌按1∶1的比例,以106CFU/g的接种量分别接种于绞碎好的肉馅中;灌肠:将猪肠衣用清水泡软,洗净沥去水分,灌入馅料。灌肠时注意肠体的饱满程度;包扎、排气:将灌好的肠体用棉线包扎起来,手握使其紧实,然后用针在肠体表面扎孔、排气;主发酵:用清水清洗肉灌肠表面,放入恒温培养箱一定的温度下发酵48 h。
1.2.3 试验设计 本试验分四组进行,分别设置25、30、35、40 ℃四个温度梯度,将制作好的牦牛肉灌肠样品放入不同温度的恒温培养箱中进行发酵。发酵完成后,取样进行理化性质指标的测定,每组样品的一个指标重复测定三次,记录数据。
1.2.4 理化性质指标检测
1.2.4.1 pH的测定 参考李平兰等人[9]的方法并做修改。将样品绞碎后,准确称取10 g样品放入烧杯中,加入90 mL纯水,用玻璃棒搅拌30 min使其混合均匀,过滤,用pH计测定pH。pH计使用前应先用缓冲溶液进行标定。
1.2.4.2 Aw的测定 将肉灌肠去除肠衣后,准确称取5 g样品,均匀平铺在塑料装样皿中,用智能水分活度仪进行测定。水分活度仪在使用前先用KCl饱和溶液校准。
1.2.4.3 亚硝酸盐含量的测定 参照GB/T 5009.33-2016《食品中亚硝酸盐与硝酸盐的测定》测定方法中的分光光度法进行测定[10]。
1.2.4.4 TBARs的测定 参照Salih等人[11]的方法,并做一定修改。
标准曲线的绘制:准确称取 1,1,3,3-四乙氧基丙烷0.0315 g溶于100 mL纯水中制成丙二醛标准储备液,然后移取1 mL丙二醛标准储备液到100 mL容量瓶中,并定容制成丙二醛工作液。取0.5、1、2、4、10 mL丙二醛工作液到10 mL容量瓶中,定容。从5个10 mL容量瓶中各取3 mL溶液加入10 mL离心管,再加入3 mL 0.02%硫代巴比妥酸(TBA)溶液在沸水浴中反应20 min,冷却。用紫外分光光度计测定吸光值,并绘制标准曲线。标准曲线方程为:y=0.3249x+0.0121,R2=0.999。
样品处理与测定:称取5 g样品于50 mL离心管中,加入10 mL 20%三氯乙酸(TCA)和7 mL去离子水,在冰水浴中用高速匀浆机以3000 r/min的转速匀浆60 s,静置1 h。用超纯水定容到50 mL,双层滤纸过滤,取3 mL滤液加入3 mL 0.02%硫代巴比妥酸(TBA)溶液在沸水浴中反应20 min取出,用流动水冷却。最后用紫外分光光度计测定吸光值。空白样是将10 mL 20% TCA溶液用去离子水定容到50 mL,然后取3 mL加入到3 mL 0.02% TBA溶液中。
肉灌肠的TBARs含量通过1,1,3,3-四乙氧基丙烷标准曲线计算,结果表示为mg/100 g。
1.2.4.5 游离氨基酸含量的测定 参照GB/T 18246-2000《饲料中氨基酸的测定》中酸水解法进行测定。分析柱型号为LCA K60/Na,洗脱速度 0.45 mL/min,衍生速度 0.25 mL/min。
1.2.4.6 色泽的测定 参照开晗等人[10]的方法并做一定修改。将牦牛肉灌肠剥去肠衣后,用菜刀将肠切成肉糜,再用色彩色差仪测定肉样的亮度值(L*)和红度值(a*)。仪器经过自检、调零以及白板矫正后,将试样铺满样品池底部置于载物台上进行测量,避免肉样和样品池底部含有空隙,每测定一次数据旋转90°,共测定三次。
1.2.4.7 剪切力的测定 采用质构分析仪,应用质构剖面分析法(Texture Profile Analysis,TPA)测定样品的剪切力。用刀将肉灌肠切成厚度约为3 mm的薄片,探头型号为HDP/BSW刀片型探头,探头运动速度2 mm/s,测定时环境温度20 ℃,每组样品重复三次。
1.3 数据处理与统计分析
采用Microsoft Excel软件进行数据的统计分析及图像绘制,数据分析采用IBM SPSS Statistics 25软件进行单因素之间的方差分析和显著性检验。
2 结果与分析
2.1 不同发酵温度对牦牛肉灌肠发酵前后pH的影响
不同发酵温度对牦牛肉灌肠发酵后pH的影响如图1所示。发酵后牦牛肉灌肠的pH较发酵前显著降低(p<0.05),而且不同发酵温度下pH降低的程度不同。发酵温度越高,发酵后肉灌肠pH越低,而在40 ℃时较前几个发酵温度又有所上升,且各组数值间的差异显著(p<0.05),在35 ℃时发酵后pH最低至5.1。这一结果与史崇颖等人[12]的报道略有差异。
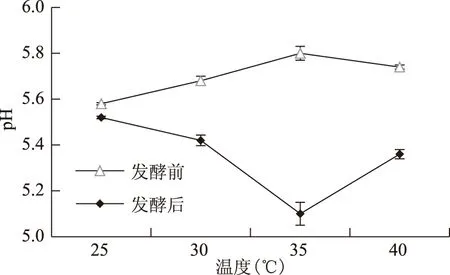
图1 不同发酵温度发酵前后牦牛肉灌肠pH的变化Fig.1 Changes of yak meat sausage’s pH value at different fermentation temperatures before and after the fermentation
引起牦牛肉灌肠发酵后pH变化的主要原因是发酵用乳酸菌以肉中和配料中的碳水化合物作为碳源,进行发酵产生乳酸导致肉灌肠pH降低。观察25、30、35 ℃的pH变化情况,可以看出发酵温度越高,发酵后pH越低;而在40 ℃时又有所升高,引起这一现象的原因可能是发酵用乳酸菌适宜发酵温度在35 ℃附近,40 ℃时温度过高,乳酸菌的发酵作用受到抑制,产生乳酸相对35 ℃较少,pH较高。
2.2 不同发酵温度对牦牛肉灌肠发酵前后Aw的影响
不同发酵温度对牦牛肉灌肠发酵前后Aw的影响如图2所示。各试验组牦牛肉灌肠的Aw经过发酵过程后均显著(p<0.05)下降,且发酵后各组Aw大小差异显著(p<0.05)。温度越高,发酵前后Aw降低幅度越大,发酵完成后Aw越低,温度为40 ℃时,降低至0.683,何凡等人[2]也报道了类似结果。主要原因可能是发酵时温度越高,牦牛肉灌肠肉馅中的自由水蒸发越快,从而导致发酵完成后产品的Aw越低。

图2 不同发酵温度发酵前后牦牛肉灌肠Aw的变化Fig.2 Changes of yak meat sausage’s Aw at different fermentation temperatures before and after the fermentation
水分活度的降低对肉灌肠制品的保藏有利,大部分腐败菌在Aw 0.9以下时就不能生长,且Aw<0.9,pH<5.2时,香肠可在非制冷条件下贮藏[13]。因此提高发酵温度,对肉灌肠的安全性、储藏性以及风味物质的形成均存在有利影响,而从结果中可看出温度太高会使发酵后Aw过低,对牦牛肉灌肠的口感、外形等产品性质造成不利的影响,适当控制发酵温度才能获得良好的发酵效果。
2.3 不同发酵温度对牦牛肉灌肠发酵前后亚硝酸盐的影响
由图3可得,经过发酵的各组牦牛肉灌肠中亚硝酸盐含量均降低,且前后差异显著(p<0.05)。通过对不同温度下牦牛肉灌肠发酵前后亚硝酸盐降低值的进一步计算分析得知,随着发酵温度的增大,亚硝酸盐含量降低值先增大后减小,且各组亚硝酸盐含量降低值的大小差异显著(p<0.05),在35 ℃发酵时,亚硝酸盐降低值达到最大的153.36 mg/100 g,较发酵前降低了74.9%,与陈婉珠等人[14]利用猪肉制作成腊肠,并进行影响亚硝酸盐浓度因素的研究结果相类似。
亚硝酸盐是发酵香肠生产中的必要腌制剂,其抗菌、发色和质地的改善作用,以及作为一种有效地抗氧化剂,被广泛应用于肉制品加工中[15-16]。同时,亚硝酸盐在人体内容易与肌肉中的氨类物质作用生成亚硝胺[17],对人体存在着潜在的致癌作用,因此亚硝酸盐含量也是发酵肉灌肠的安全卫生指标之一。发酵过程中亚硝酸盐降低是由于乳酸菌发酵产生乳酸,亚硝酸盐在乳酸存在的条件下生成游离亚硝酸,后续分解生成-NO,-NO与肌红蛋白结合,形成对热稳定的亚硝基肌红蛋白[18],同这也是亚硝酸盐发色机理所在。结合上述牦牛肉灌肠发酵前后pH的变化情况,发现pH同亚硝酸盐的降低值具有相关性,pH越小,发酵后亚硝酸盐降低值越大。
2.4 不同发酵温度对牦牛肉灌肠发酵前后TBARs含量的影响
如图4所示,每个发酵组牦牛肉灌肠发酵前与发酵后相比,TBARs含量都有显著增加(p<0.05)。发酵前,4个组之间TBARs含量无显著差异(p>0.05),而发酵完成后差异显著(p<0.05)。发酵温度越高,发酵完成后牦牛肉灌肠TBARs含量越大,发酵温度为40 ℃达到0.2088 mg/100 g。

图4 不同发酵温度发酵前后牦牛肉灌肠的TBARs的变化Fig.4 Changes of yak meat sausage’s TBARs at different fermentation temperatures before and after the fermentation
脂肪氧化是发酵肉制品加工过程中不可避免的一种现象,适度的脂肪氧化可以产生很多有利于形成肉制品风味的烃、醛、酮、酸等挥发性小分子物质,但是如果过度氧化,产生的小分子物质会使火腿发生酸败而失去原本风味[19-20]。观察图5发现,发酵温度越高,发酵后牦牛肉灌肠的TBARs含量越高,变化规律十分明显。这种现象产生的原因可能是温度上升促进了牦牛肉灌肠中脂肪氧化反应的进行,温度越高,脂肪氧化反应越活跃,丙二醛作为脂肪氧化的中间产物积累越多,从而导致TBARs含量越高。
2.5 不同发酵温度对牦牛肉灌肠发酵后游离氨基酸含量的影响
不同发酵温度对牦牛肉灌肠发酵后各游离氨基酸含量和总量的影响如表1所示。随着发酵温度的增大,各个温度下各种游离氨基酸的含量发生了改变,而游离氨基酸的总量变化出现了先降低后升高的趋势。在较低发酵温度25 ℃和较高发酵温度40 ℃条件下发酵后游离氨酸总量大于中间发酵温度30和35 ℃,且40 ℃时发酵后游离氨基酸含量最多,达到1.071 g/100 g。这说明在30和35 ℃恒温发酵,有利于蛋白质合成,使大部分游离氨基酸的含量减少。据报道:不同种类的氨基酸呈味性质不同,其中谷氨酸(Glu)具有鲜味,甘氨酸(Gly)、丙氨酸(Ala)具有甜味,蛋氨酸(Met)、亮氨酸(Leu)、脯氨酸(Pro)具有苦味,个别氨基酸还具有酸味和咸味[21],这些游离氨基酸含量的增加对肉灌肠整体风味的形成具有重要的作用,使产品风味得到显著提升。

表1 不同发酵温度发酵后牦牛肉灌肠中各游离氨基酸的含量(g/100 g)Table 1 Contents of yak meat sausage’s FAA at different fermentation temperatures after fermentation(g/100 g)
Verplaetse[22]和Toldra[23]的研究表明,发酵香肠的蛋白质降解主要是由于内源酶的作用,特别是组织蛋白酶B和D。组织蛋白酶的活性常常受到温度、pH、盐含量等因素的影响[24]。因此,不同发酵温度下发酵后游离氨基酸含量有很大差异,可能是肉灌肠的发酵温度、湿度、pH、肠体内盐含量等多种因素综合作用的结果,同时发酵用乳酸菌的品种也可能对发酵后游离氨基酸含量有影响。多种因素的作用使牦牛肉灌肠发酵后游离氨基酸含量的变化规律复杂,具体规律有待进一步试验探讨。
2.6 不同发酵温度对牦牛肉灌肠发酵前后色泽的影响
不同发酵温度对牦牛肉灌肠发酵前后的明度值L*和红度值a*的影响如表2所示。根据表2标注,各试验组肉灌肠的亮度值L*在发酵完成后均有一定程度的降低,而各组间发酵前后亮度值L*变化量Δ大小差异并不完全显著(p>0.05),而40 ℃时发酵完成后亮度值L*变化量Δ最大,与其他几个发酵温度相比具有显著(p<0.05)差异。发酵温度越高,发酵完成后牦牛肉灌肠红度值a*越大,各组发酵完成后红度值a*差异也不完全显著(p>0.05),且35 ℃和40 ℃发酵后牦牛肉灌肠的红度值a*分别为20.33±0.24和21.73±1.72,差异不显著(p>0.05),具有近似相同的发酵效果。

表2 不同发酵温度发酵前后牦牛肉灌肠L*和a*的变化Table 2 Changes of yak meat sausage’s L* and a* at different fermentation temperatures before and after the fermentation
色泽是发酵牦牛肉灌肠的重要感官性质,也是产品质量的直观体现。良好的产品色泽能勾起消费者的购买欲望,影响消费者的选择倾向。肉色的变化与肉中的肌红蛋白被氧化成高铁肌红蛋白有关,而这一变化过程又与肉中脂肪氧化、氧化还原酶系、氧化还原电位、氧分等因素有关[25],同时肉色在发酵储存期间由于水分的流失会逐渐变暗。分析发酵前后pH和TBARs含量的变化得知,40 ℃发酵后,水分活度最低,脂肪氧化中间产物TBARs含量最多,且与其他发酵组存在显著差异(p<0.05),这可能是40 ℃发酵后亮度值L*和红度值a*变化最大的原因。
2.7 不同发酵温度对牦牛肉灌肠发酵后剪切力的影响
不同发酵温度对剪切力的影响见图5。从图5可见,40 ℃发酵后牦牛肉灌肠的剪切力最大。经过统计处理发现,在发酵温度为25、30、35 ℃时,发酵完成后牦牛肉灌肠的剪切力大小差别不大,分别为(10.09±1.47)、(10.24±0.34)、(10.24±1.06) N/mm,三组数据之间的差异不显著(p>0.05);在发酵温度为40 ℃时,发酵后剪切力大小增加至(18.73±2.98) N/mm,与前三组相比差异显著(p<0.05)。

图5 不同发酵温度发酵后牦牛肉灌肠剪切力的大小Fig.5 Magnitudes of yak meat sausage’s share force at different fermentation temperatures after the fermentation
肉灌肠在发酵和成熟过程中,由于pH和含水量的变化,其力学性质也会产生一定的改变。乳酸菌发酵产生乳酸使肉灌肠的pH降低,过低的pH使肉品蛋白质发生变性和凝固,同时蛋白质的变性和凝固降低了肉灌肠的持水力,导致水分损失[26]。随着发酵温度的上升,肉馅水分蒸发损失严重,pH也发生变化,使发酵后肉灌肠质构紧密,剪切力变大。
3 结论
研究说明不同的发酵温度对牦牛肉灌肠发酵前后理化性质的变化存在显著影响:发酵温度越高,发酵完成后牦牛肉灌肠的Aw、亮度值L*越低,而红度值a*和肉灌肠剪切力越大;并且TBARs含量在发酵温度高的试验组中较高。不同发酵温度下pH和亚硝酸盐含量在发酵前后的变化存在显著差异(p<0.05)。pH在发酵温度为35 ℃时发酵完成后降至最低为5.1,发酵前后亚硝酸盐的含量也在35 ℃时变化最大,而发酵后牦牛肉灌肠中游离氨基酸含量在30~35 ℃最低。综合上述各方面理化指标变化考虑,本实验中35 ℃温度发酵的产品感官品质优秀,营养物质丰富,风味独特,贮藏性良好。
本文试验中发现随着发酵温度的增大,发酵完成后牦牛肉灌肠中游离氨基酸含量先降低后升高这一现象未能作出充分的解释,有待后续针对发酵菌种、pH和肉灌肠盐含量等因素对发酵过程游离氨基酸含量的影响进行深一步的研究探讨。

