组蛋白去乙酰化酶抑制剂JNJ-26481585抗食管癌活性及其作用机制研究
钟 磊,师健友,白 兰
(1. 四川省医学科学院·四川省人民医院药学部;2. 电子科技大学附属医院·四川省人民医院个体化药物治疗四川省重点实验室,四川 成都 610072)
食管癌是最常见的恶性肿瘤之一,在中国人群中的致死率位居所有肿瘤的第5位[1]。大部分食管癌患者在发现时已处于中晚期,化疗是这类病人的主要治疗手段。近年来,有关食管癌治疗靶点和药物的研究已取得了不少进展,然而,食管癌患者预后仍然较差,发现有效的治疗靶点和药物仍是食管癌治疗亟待解决的问题。
组蛋白去乙酰化酶(histone deacetylases,HDACs)在多种类型的肿瘤中过表达,其表达量与肿瘤预后密切相关,被认为是多种肿瘤的治疗靶点[2-4]。Nakagawa等[5]研究发现,HDAC1/2/3/8在食管癌组织中的表达量要明显高于正常组织;一项系统性评价和Meta分析的研究也显示,胃肠道肿瘤的病人,包括食管癌患者,HDAC1表达水平与病人预后密切相关,较低的HDAC1表达量意味着较好的存活率[6]。由此可见,HDACs也是治疗食管癌的潜在靶点。本研究探讨了一种高活性的pan-HDAC抑制剂JNJ-26481585的抗食管癌作用及其部分作用机制。
1 材料与方法
1.1材料
1.1.1细胞株 食管癌细胞株TE-1,购自中国科学院典型培养物保藏委员会细胞库。
1.1.2药物与试剂 JNJ-26481585、顺铂(cis-dichlorodiammineplatinum,DDP)、5-氟尿嘧啶(5-fluorouracil,5-FU),购自美国Selleck公司;RPMI 1640培养基、胰酶、MTT、结晶紫、DMSO,购自Sigma公司;胎牛血清,购自Corning公司;EdU增殖检测试剂盒Cell-LightTMEdu Apollo 567 In Vitro Kit,购自广州锐博生物科技有限公司;Annexin V/PI凋亡检测试剂盒,购自江苏凯基生物技术有限公司;Ac-H3K9、P21抗体,购自英国Abcam公司;p-Akt、Akt、p-ERK、ERK抗体,购自美国Cell Signaling Technology公司;β-actin抗体、辣根过氧化物酶标记的二抗,购自北京中杉金桥生物技术有限公司。
1.1.3仪器 Heraeus BB15型细胞培养箱、Multiscan MK3酶标仪(美国ThermoFisher公司);BHC-1000IIA/B3型生物安全柜(苏净安泰生物技术有限公司);IX50型倒置显微镜(日本Olympus公司);FACSCalibur流式细胞仪(美国Becton Dicknson公司);JY300C型电泳仪(北京君意东方电泳仪器有限公司)。
1.2方法
1.2.1MTT检测细胞活力 在96孔板接种TE-1细胞,次日加入浓度为10、3、1、0.3、0.1、0.03、0.01、0.003 μmol·L-1的JNJ-26481585、DDP和5-FU处理细胞72 h,每个浓度设3个复孔。随后加入20 μL浓度5 g·L-1的MTT溶液,37 ℃孵育4 h,再加入50 μL浓度为200 g·L-1的酸性SDS溶液溶解甲臜过夜,最后采用酶标仪于570 nm波长检测吸光度值。根据公式(X/C)×100%计算经药物处理后肿瘤细胞的存活率,其中,C和X分别代表溶剂对照组和药物处理组的平均吸光度值,使用Graphpad Prism软件做细胞存活率-药物浓度曲线图。
1.2.2克隆形成实验 在12孔板接种TE-1细胞,每孔5000个。次日加入JNJ-26481585(1、0.1、0.01 μmol·L-1)处理细胞,2~3 d换液1次。作用10 d后弃上清,用甲醇固定细胞15 min,再用0.25%的结晶紫染液染色。
1.2.3EdU检测细胞增殖 96孔板接种细胞,每孔8 000个。次日加入JNJ-26481585(1、0.3、0.1 μmol·L-1)处理细胞24 h,并设置溶剂对照组。后续EdU标记增殖细胞,按照试剂盒说明书进行。
1.2.4细胞周期检测 6孔板接种细胞,次日加入JNJ-26481585(1、0.3、0.1 μmol·L-1)处理细胞24 h。收集细胞,并采用70%乙醇固定过夜,加入50 mg·L-1碘化丙啶(PI)、100 mg·L-1RNase和0.1% Triton X-100在暗处作用30 min,随后上流式细胞仪检测。
1.2.5Annexin V/PI染色检测细胞凋亡 按“1.2.4”项方法接种和处理细胞,随后按照试剂盒操作说明,向每管加入500 μL Binding buffer重悬细胞,再依次分别加入5 μL Annexin V-FITC和PI,混匀,室温避光反应5~15 min,及时上流式细胞仪检测。
1.2.6划痕实验 24孔板接种细胞,待细胞融合度达80%左右时,用灭菌黄枪尖在每孔均匀划痕,并加入JNJ-26481585(1、0.3、0.1 μmol·L-1)处理细胞。对照组细胞愈合时结束实验,在倒置显微镜下拍照。
1.2.7Transwell细胞侵袭检测 将Transwell小室插入24孔板,并铺上一层按1 ∶6比例稀释的基质胶。待基质胶凝固后,在小室内接种细胞,并加入无血清培养基稀释的JNJ-26481585或溶剂对照共同孵育,小室外孔内加入含血清的完全培养基。24 h后用甲醇固定小室底部侵袭的细胞,再用0.05%结晶紫染色。
1.2.8Western blot实验 收集经JNJ-26481585处理18 h 后的TE-1细胞,RIPA裂解,超声,提取总蛋白。采用SDS-PAGE分离蛋白,并转至PVDF膜,脱脂奶粉封闭2 h,加入1 ∶1 000稀释的一抗4 ℃孵育过夜。次日,再加入辣根过氧化物酶标记的二抗,37 ℃孵育1 h,随后洗去过量抗体,加入显影液曝光。
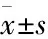
2 结果
2.1JNJ-26481585抑制TE-1细胞活力JNJ-26481585的结构见Fig 1A,采用MTT法检测其对食管癌细胞TE-1活力的影响。如Fig 1B所示,JNJ-26481585可有效抑制TE-1细胞活力,且抑制作用具有浓度依赖性,IC50值为0.073 μmol·L-1。DDP和5-FU作为临床食管癌化疗一线用药,对TE-1细胞的IC50均大于10 μmol·L-1,活性弱于JNJ-26481585。进一步采用克隆形成实验检测JNJ-26481585对TE-1细胞生长的影响,Fig 1C结果显示,在0.1 μmol·L-1及以上浓度时,JNJ-26481585可明显抑制TE-1细胞生长,无明显细胞克隆产生。
2.2JNJ-26481585抑制TE-1细胞增殖进一步采用EdU染色检测JNJ-26481585对TE-1细胞增殖的影响,EdU(红色荧光)标记增殖活力强的细胞。如Fig 1D所示,药物处理组EdU标记的细胞明显少于溶剂对照组,表明JNJ-26481585具有较强的抗细胞增殖活性。
2.3JNJ-26481585诱导G2/M期细胞周期阻滞Fig 2A的流式细胞术检测结果显示,经JNJ-26481585处理的食管癌细胞,处于G2/M期的细胞数量随着药物浓度的增加而逐渐增多,在较低浓度(0.1 μmol·L-1)时即可明显诱导TE-1细胞G2/M期阻滞。
2.4JNJ-26481585诱导TE-1细胞凋亡如Fig 2B所示,与溶剂对照组相比,药物处理组均可明显增加Annexin V阳性的凋亡细胞数,表明JNJ-26481585还可通过促进细胞凋亡来抑制食管癌细胞的生长。
2.5JNJ-26481585抑制TE-1细胞迁移和侵袭HDAC的异常表达与肿瘤转移密切相关,为进一步评估JNJ-26481585对食管癌细胞转移的影响,对药物处理前后,TE-1细胞的迁移和侵袭(肿瘤转移中的两个关键环节)能力进行了检测。如Fig 3所示,JNJ-26481585可剂量依赖性地抑制划痕的愈合和TE-1细胞侵袭穿过基质胶,表明JNJ-26481585还具有较强的抗转移活性。
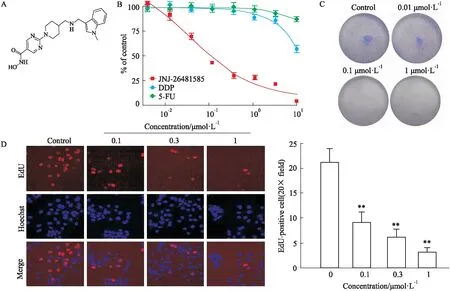
Fig 1 JNJ-26481585 inhibited growth of TE-1 cells in n=3)
A: Structure of JNJ-26481585; B: Anti-viability assay of JNJ-26481585, DDP and 5-FU against TE-1 cells. The ordinate represents the survival rate of tumor cells; C: Long-term colony formation assay of JNJ-26481585-treated TE-1 cells; D:Edu cell proliferation assay on TE-1 cells after treatment with 1 μmol·L-1JNJ-26481585 for 24 h.**P<0.01vscontrol.
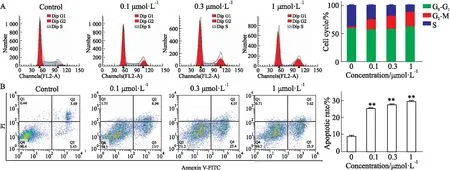
Fig 2 JNJ-26481585 induced G2/M phase arrest and apoptosis in TE-1 n=3)
A: Influence of JNJ-26481585 on cell cycle progression in TE-1 cells. The statistical analysis of cell cycle is presented on the right; B: Apoptosis detection was performed using Annexin V/PI co-staining, and the percentage of Annexin V-positive cells is quantified for apoptotic rate statistics.**P<0.01vscontrol.
2.6JNJ-26481585的抗食管癌分子机制Fig 4的Western blot结果显示,JNJ-26481585可明显增加HDAC底物H3K9的乙酰化水平。作为细胞周期抑制剂,p21表达量在肿瘤细胞中受到表观调控而降低[7],而经JNJ-26481585处理的TE-1细胞,p21表达水平明显提高。此外,JNJ-26481585还可明显抑制Akt和ERK的磷酸化,这两个蛋白分别是PI3K/mTOR和MAPK信号通路中的关键蛋白,与肿瘤细胞的凋亡和增殖密切相关。
Fig 3 JNJ-26481585 inhibited migration and invasion of TE-1 cells in n=3)
A: The representative images (×20) from vehicle and 1 μmol·L-1JNJ-26481585 treated groups in wound healing assay. The number of migrated cells is used for statistics and quantified by manual counting; B: The representative images (×20) from vehicle and 1 μmol·L-1JNJ-26481585 treated groups in Transwell invasion assay. The number of invaded cells is counted for statistics.*P<0.05,**P<0.01vscontrol.
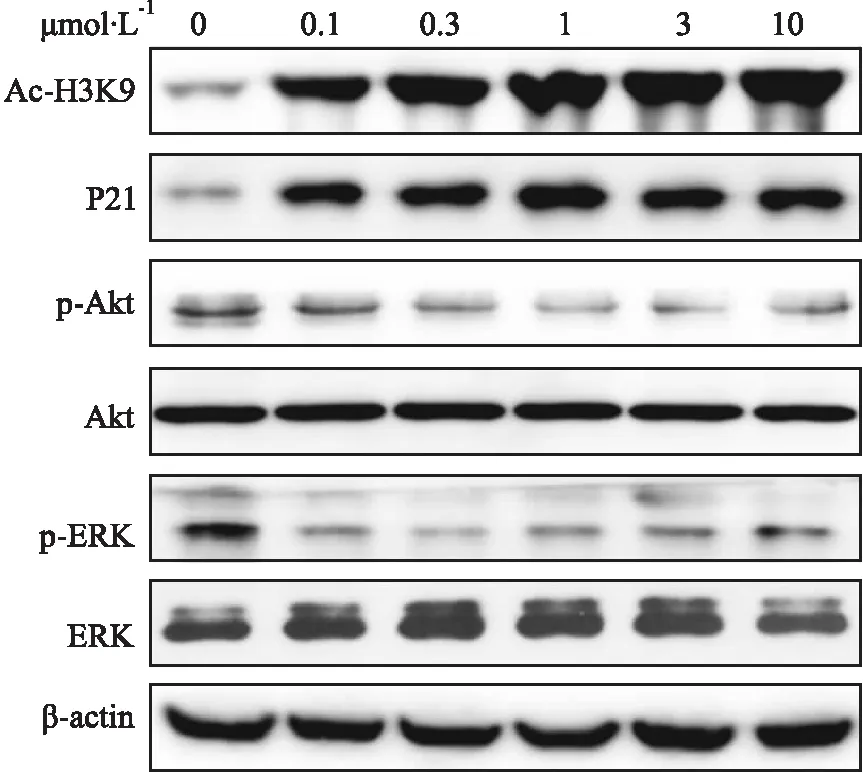
Fig 4 The anti-esophageal cancer molecular mechanisms of JNJ-26481585
TE-1 cells were treated with JNJ-26481585 or vehicle control for 18 h, then cells were lysed and the proteins were analyzed by immunoblot.
3 讨论
越来越多的证据显示,除了基因突变外,表观遗传调控也参与了肿瘤的发生和进展[8-9]。HDACs作为一类重要的表观遗传修饰酶,参与了多种组蛋白和非组蛋白底物的去乙酰化修饰,其异常激活与多种肿瘤的进展和预后密切相关,被认为是治疗肿瘤的潜在靶点。目前,已有多种HDACs抑制剂被批准上市,用于T细胞淋巴瘤和多发性骨髓瘤的治疗,包括伏立诺他、罗米地辛、贝林司他、西达本胺、帕比司他等[10-11]。然而,由于药物本身的活性和药代动力学性质等原因,大部分HDACs抑制剂在实体瘤治疗中的疗效并不令人满意。本研究所使用的JNJ-26481585是一种高活性的pan-HDAC抑制剂,对I型HDAC酶均有较高的抑制活性,且具有较好的药代动力学性质,在实体瘤治疗中具有一定优势[12]。本文的研究结果也显示,JNJ-26481585在较低浓度时即可明显抑制食管癌细胞的活力和增殖,诱导细胞G2/M期阻滞和细胞凋亡,此外,还具有抑制细胞迁移和侵袭的作用,显示了较强的抗食管癌活性。
HDACs可调控组蛋白和多种非组蛋白底物的去乙酰化,故HDACs抑制剂的抗肿瘤分子机制较复杂,不同的HDACs抑制剂在不同的肿瘤类型中抗肿瘤作用机制也有差异。大量研究显示,HDAC1可特异性沉默细胞周期抑制剂p21[7,12],抑制HDACs可以阻断多种肿瘤生长相关信号通路,如Akt/mTOR、MAPK/ERK等[13-14]。因此,本研究主要检测了JNJ-26481585对p21表达和这两条肿瘤细胞生长依赖的信号通路的影响。结果显示,JNJ-26481585在较低浓度即可明显上调p21表达水平,并抑制PI3K/mTOR和MAPK通路中的关键蛋白Akt和ERK的磷酸化。这一结果表明JNJ-26481585的抗食管癌作用涉及到多种分子机制,上调p21,以及抑制Akt/mTOR、ERK信号在其中发挥重要作用。
综上所述,本研究报道了一种高活性的pan-HDAC抑制剂JNJ-26481585的抗食管癌作用及其作用机制,JNJ-26481585可通过上调细胞周期抑制剂p21表达,以及抑制Akt/mTOR、ERK信号通路,进而抑制食管癌细胞的生长。

