佐太、β-HgS、HgCl2对PC12细胞活性和凋亡相关基因表达影响的比较
耿卢婧, 李 岑, 夏政华, 杜玉枝, 魏立新∗
(1.中国科学院西北高原生物研究所,藏药研究重点实验室,青海 西宁810008;2.中国科学院大学,北京100049;3.青海省藏药药理学和安全性评价重点实验室,青海西宁810008)
藏医药是藏族人民在上千年生活实践中逐步形成并不断发展的传统医药学,是我国特有的重要医药资源[1],藏药中大量使用矿物药,是我国医药体系中使用最多的[2]。佐太是藏语 “仁青欧曲佐珠钦木”的简称,藏医认为它是珍宝类藏药的核心配伍成分,配合其他药物使用具有减毒增效作用,其炮制过程严格且复杂,主要原料为水银、硫磺、八金灰、八矿灰等[3],被认为是藏药中重金属的主要来源,其安全性一直是人们关注的焦点。
Zhao等[4]对4份不同产地佐太进行X射线光电子能谱分析 (XPS)和X射线衍射 (XRD)研究,发现其中汞均以硫化汞 (HgS)形式存在;李岑等[5]对不同产地9批佐太中汞的赋存形态进行分析,验证了上述结论,并通过XRD指纹谱图发现样品之间的相似性均大于99.58%;夏振江等[6]用硫氰酸盐容量法测定青海、四川、甘肃、西藏产13批佐太中HgS含有量,测得其在52.84%~56.23%范围内,平均54.5%。由此可知,不同产地、批次佐太中成分组成和HgS含有量稳定性较高。
佐太主要成分为立方晶系硫化汞 (β-HgS)[7-8], 这与朱砂 (α-HgS 含有量≥98%) 相似,具有镇定安神、抗惊厥、抗抑郁等作用[9-10],推测β-HgS可能是其活性成分,但由于人们在生活中往往是 “谈汞色变”,故其药用安全性备受质疑。HgS是目前传统药物中唯一仍然可以口服的汞化合物形式,其毒性远小于常见的汞化合物氯化汞(HgCl2) 和甲基汞 (MeHg), 涉及急性毒性[11]、慢性毒性[12]、 肝毒性[13]、 肾 毒性[14]、 神经毒性[15]等各方面。汞的化学存在形式是 HgS或含HgS的传统药物与HgCl2、MeHg存在差别的决定性因素[16-17],但不同化学形态的汞在毒理、药理活性方面差异的分子机制仍不清楚。
根据目前报道可知,佐太可能靶器官为神经系统,故本实验选择类神经细胞——大鼠肾上腺嗜铬细胞瘤细胞PC12,对佐太可能的神经细胞毒性进行探索。同时,在前期研究基础上采用噻唑蓝(MTT)法检测大剂量佐太、β-HgS、HgCl2对PC12细胞活性的影响,并通过实时荧光定量PCR对凋亡相关基因 (Bcl-2、 Bax、 Bak、 Fas、 FasL)表达进行分析,讨论三者作用差异。
1 材料
1.1 仪器 HF-90二氧化碳 (CO2)培养箱 (力康生物医疗科技控股有限公司);BCM-1300生物洁净工作台 (苏州苏洁净化设备有限公司);多功能酶标仪 (珀金埃尔默企业管理上海有限公司);ETC811基因扩增仪 (苏州东胜兴业科学仪器有限公司);3K15离心机 (Sigma中国有限公司);ViiATM7实时荧光定量 PCR仪 [赛默飞世尔科技(中国)有限公司]。
1.2 试药 佐太购自西藏自治区藏药公司。β-HgS购自美国 Alfa Aesar公司,含有量不低于98%;HgCl2(分析纯)购自贵州省铜仁化学试剂厂,含有量不低于98%。
1.3 细胞与主要试剂 PC12细胞由武汉普诺赛生命科技有限公司提供。RPMI 1640培养基、胎牛血清、 Penicillin-Streptomycin-Glutamine(100×), (美国Gibco公司);苏木素-伊红 (HE)染色试剂盒(上海碧云天生物技术有限公司);MTT(美国Sigma公司);TRIzol(美国 Ambion公司);逆转录、荧光定量试剂盒 (大连Takara公司)。其余试剂均为分析纯。
2 方法
2.1 细胞培养 取对数生长期PC12细胞,胰酶消化后收集细胞,用含10%胎牛血清和1%Penicillin-Streptomycin-Glutamine(100×) 的 RPMI1640培养液调整细胞密度为5×104/mL,接种于96孔板 (接种量0.1 mL/孔) 或6孔板 (接种量3 mL/孔)。 在37℃ CO2培养箱中培养至细胞铺满板底的70%~80%时给药。
2.2 分组及给药 细胞随机分为对照组、佐太组(0.250 g/L,含汞 0.116 g/L)、 β-HgS 组 (0.135 g/L,含汞 0.116 g/L)、 HgCl2组 (0.015 7 g/L, 含汞0.011 6 g/L),为了排除细胞增殖的影响,药物孵育时间为2 h。其中,佐太组中药物颗粒的尺度大多在100~600 nm之间,甚至还有部分颗粒小于100 nm[8,18], 参考其他金属纳米药物的毒理学研究方法,采用悬浮液给药[19-20];β-HgS组剂量为佐太组等汞量,同样采用悬浮液给药;由于HgCl2细胞毒性较大,为了保证足够细胞数量进行后续实验,该组含汞量为佐太组的1/10。
2.3 细胞活性检测[21]将接种于96孔板中的细胞随机分组,每组10个复孔,按上述条件进行药物孵育。孵育结束后,每孔加入 5 mg/mL MTT(0.1 mol/L磷酸盐缓冲液 (PBS) 配制,pH 7.2~7.4)10 μL,继续培养4 h,每孔加入三联液 (含10%SDS、 5% 异丁醇、 10 mmol/L 盐酸) 150 μL,在37℃CO2培养箱中静置过夜,于570 nm波长处测定光密度 (OD)值。计算细胞增殖率 (给药组OD值/对照组OD值×100%)。
2.4 HE染色 在6孔板中制备细胞爬片,按上述条件接种细胞并给药孵育,孵育结束后,取出细胞爬片, PBS (0.1 mol/L, pH 7.2~7.4) 漂洗 3 次,95%乙醇固定20 min,苏木素染色10 min,自来水冲洗分色10 min,伊红染色30 s,乙醇梯度脱水后中性树脂封片,光学显微镜进行细胞形态观察。
2.5 实时荧光定量PCR检测 按上述条件将6孔板中的细胞随机分组,并进行给药处理。药物孵育结束后,弃去培养液,每孔加入1 mL TRIzol,按照说明书操作提取细胞总 RNA,测定它在260、280 nm波长处的吸光度及总RNA浓度,根据2个波长处吸光度的比值 (1.9<OD260/OD280<2.0) 和琼脂糖凝胶电泳结果评价总RNA质量,调整符合要求的总RNA样品质量浓度至500 ng/μL,应用逆转录试剂盒中的随机引物,按操作指南反转录合成cDNA,体系见表1,条件为37℃反应15 min,85℃灭活5 s。利用内参引物β-actin及凋亡相关基因Bax、Bak、Bcl-2、Fas、FasL的引物对cDNA进行扩增,检测药物作用后基因的表达情况,引物序列见表2,实验体系见表3,PCR实验条件见表4。重复2次,每次3批,将2次结果合并后进行分析。

表1 逆转录反应体系Tab.1 Reverse transcription reaction systems
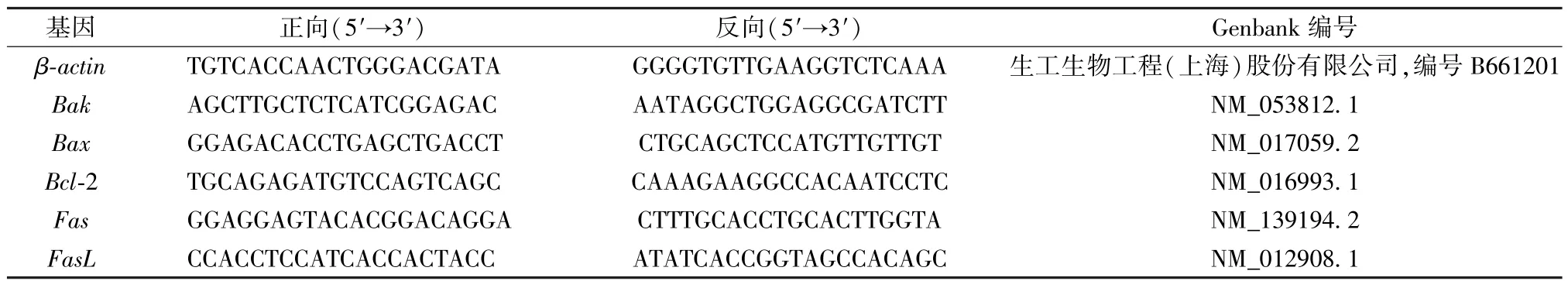
表2 实时荧光定量PCR引物序列Tab.2 qRT-PCR primer sequences

表3 实时荧光定量PCR反应体系Tab.3 qRT-PCR systems
2.6 统计学分析 通过SPSS 21.0软件进行处理,置信区间95%,采用Kolmogorov-Smirnov test检验数据分布情况,对于呈正态分布且n≥10的数据进行方差分析,并采用Tukey test或Dunnett’s T3 test进行成对比较;对于非正态分布或n<10的数据采用非参数检验Kruskal-Wallis H test进行分析,并采用Mann Whitney U test进行成对分析。以P<0.05表示差异有统计学意义。
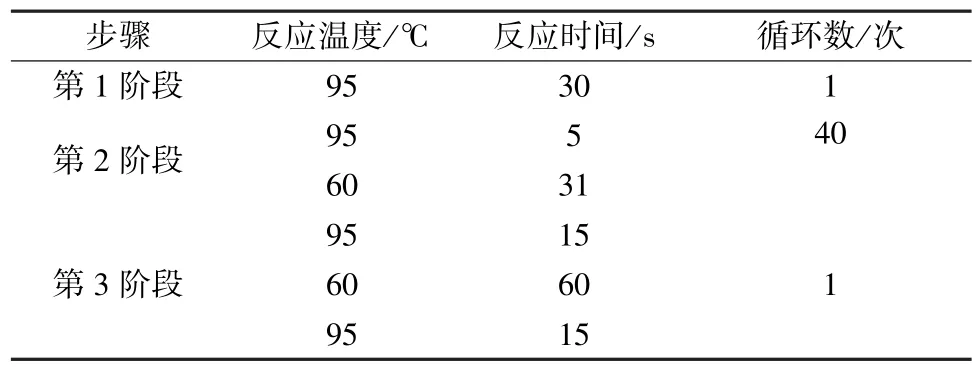
表4 实时荧光定量PCR反应条件Tab.4 qRT-PCR reaction conditions
3 结果
3.1 细胞活性 图1显示,佐太组、β-HgS组、HgCl2组 (每组3次实验)细胞活性趋势一致,重复性较好,均显著低于对照组 (P<0.05)。另外,佐太、β-HgS细胞毒性远小于HgCl2,两者作用2 h后细胞活性下降10%左右,而HgCl2的含汞量只有两者1/10,却导致其下降70%,表明佐太、HgCl2在细胞毒性方面的差异与其在肝毒性、肾毒性、发育毒性方面一致[13,22-23]。

注:与对照组比较,∗P<0.05
3.2 细胞形态 图2显示,对照组细胞呈不规则多边形或梭型;佐太组细胞膜边缘粗糙,出现絮状物质,表明佐太对细胞膜的完整性产生一定破坏;β-HgS组细胞质部分体积变大,但细胞结构仍保持完整,推测 β-HgS可能引起细胞渗透压失衡;HgCl2组细胞膜几乎完全被裂解,细胞核凝集,与HgCl2引起Kidney OK细胞凋亡时的形态特征一致[24]。由此可知,HgCl2对细胞形态的影响远高于佐太和β-HgS,与 “3.1”项下结果一致。
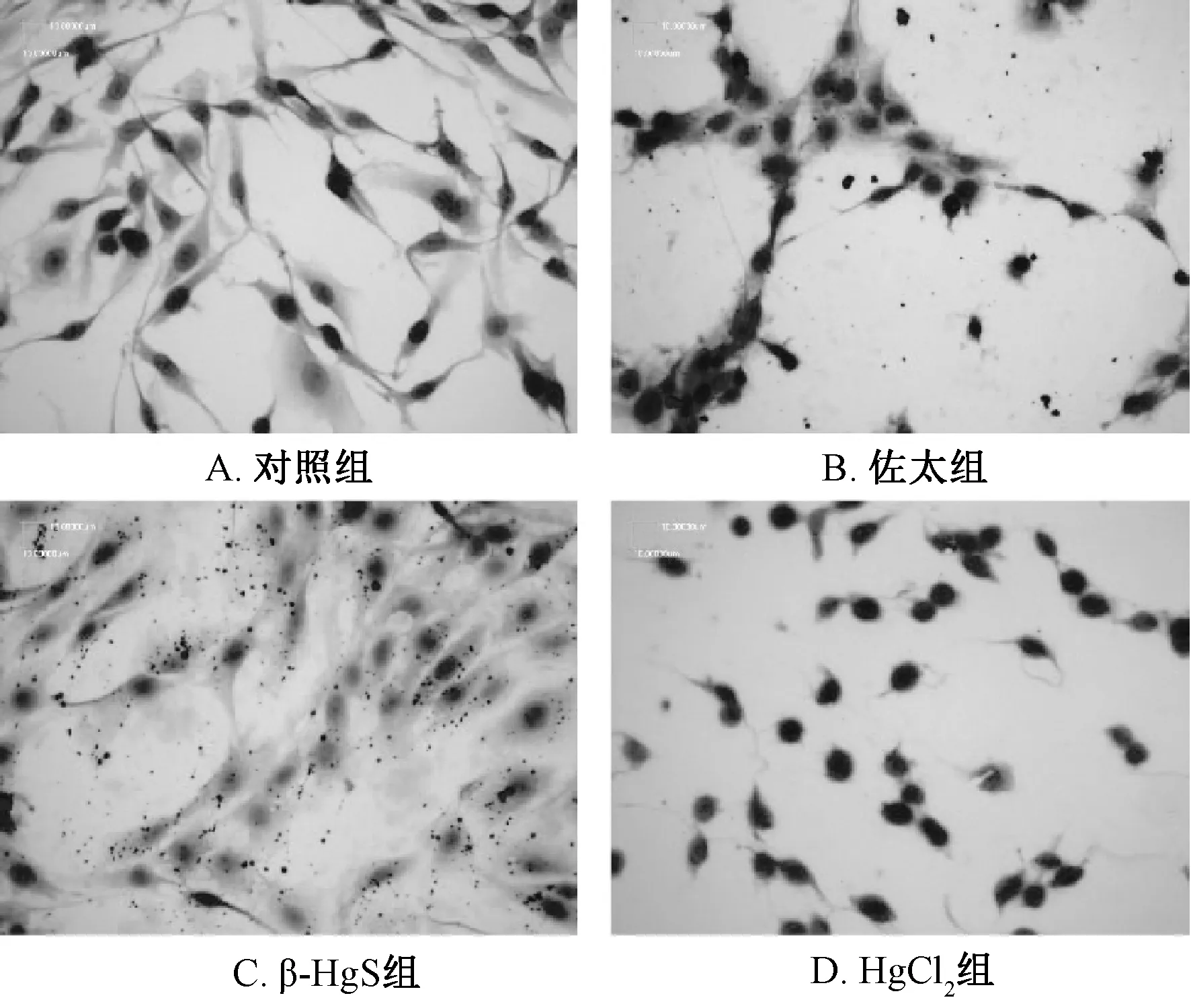
图2 各组细胞HE染色 (×400)Fig.2 HE staining of cells in various groups(×400)
3.3 线粒体相关凋亡基因 本实验选择Bcl-2、Bax、Bak检测药物对线粒体凋亡通路的影响。Bcl-2家族的蛋白通过控制线粒体膜透性调节细胞凋亡[25],其中Bcl-2是第一个被确认具有抑制作用的基因,其高表达能阻止多种凋亡诱导因素 (如电离辐射、化学药物等)所引发的细胞凋亡;Bax、Bcl-2具有大约1/5的同源性,但两者相互拮抗,具有促进细胞凋亡的作用[26];Bak与Bcl-2的同源性为25%,但与Bax一样也具有促细胞凋亡的作用[27]。
图3显示,与对照组比较,佐太组Bax、Bak、Bcl-2表达显著下降 (P<0.05), β-HgS组 Bax、Bak表达显著下降 (P<0.05),HgCl2组仅Bcl-2表达显著下降 (P<0.05)。由此可知,佐太和β-HgS可能对促凋亡基因Bax、Bak引起的细胞凋亡有抑制作用,而HgCl2可抑制抗凋亡基因Bcl-2表达。

图3 佐太、β-HgS、HgCl2对 Bax、Bak、Bcl-2 mRNA表达的影响Fig.3 Effects of Zuotai, β-HgS and HgCl2on Bax, Bak,Bcl-2 mRNA expressions
3.4 死亡受体相关凋亡基因 细胞膜表面死亡受体及其配体 (Fas/FasL)是细胞凋亡主要途径之一,也是近年来认识较为深入的与细胞凋亡信号传递有关的分子系统[28-29]。细胞膜表面死亡受体Fas基因又称Apo-1或CD95,属于肿瘤坏死因子受体/神经生长因子受体超家族 (TNFR/NGFR);FasL又称CD95L,是Fas天然配体,属于肿瘤坏死因子(TNF)家族的细胞因子,两者可反映药物对死亡受体凋亡通路的影响。
图4显示,与对照组比较,佐太组FasL表达显著降低 (P<0.05), β-HgS组Fas、FasL表达显著降低 (P<0.05),HgCl2组两者表达显著升高(P<0.05)。 由此可知, HgCl2可能通过 Fas/FasL途径诱导细胞凋亡,而佐太和β-HgS对Fas/FasL通路有一定抑制作用。
4 讨论
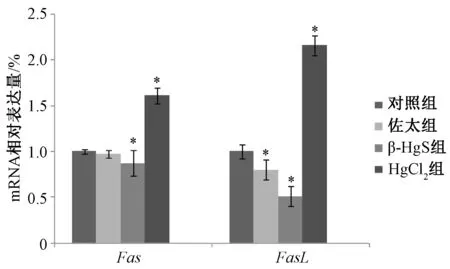
图4 佐太、β-HgS、HgCl2对Fas、FasL mRNA表达的影响Fig.4 Effects of Zuotai, β-HgS and HgCl2on Fas, FasL mRNA expressions
本实验发现,佐太、β-HgS对PC12细胞的毒性远小于HgCl2,并可抑制促凋亡基因Bax、Bak信号传导和Fas/FasL凋亡通路激活;HgCl2可抑制抗凋亡基因Bcl-2表达,并激活Fas/FasL通路,由此揭示了佐太、β-HgS与HgCl2在细胞毒性分子机制方面差异,也表明其激活的信号通路有根本差别。同时,佐太、β-HgS对PC12细胞活性的影响程度很接近,但实时荧光定量PCR的结果并不完全相同,前者对线粒体凋亡相关基因 (Bcl-2、Bax、Bak)的影响高于后者,但对死亡受体基因(Fas、FasL)表达的影响又弱于后者,推测β-HgS可能不是佐太中的唯一活性成分。
然而,细胞活性实验结果和实时荧光定量PCR结果并不一致。佐太、β-HgS并未表现出明显的对细胞不利的调节作用,但两者确实对细胞活性造成一定损伤,这是因为本实验只检测5个基因(Bcl-2、 Bax、 Bak、 Fas、 FasL) 表达差异, 不能代表药物对机体的全部影响,故对佐太、β-HgS、HgCl2产生细胞毒性的信号通路还需要进一步深入探索。
综上所述,佐太、β-HgS对PC12细胞的毒性远小于HgCl2,两者可能会引起促凋亡基因Bax、Bak和死亡受体 Fas/FasL通路的信号传导阻滞,而HgCl2可能通过抑制抗凋亡基因Bcl-2表达、激活Fas/FasL通路来引起细胞凋亡,这可为研究佐太等含汞药物的药理活性、毒理作用提供新思路。

