Ace-AMP1过表达毕赤酵母工程菌株的构建及其对梨青霉病的抑制作用
林明,姜路花,余挺,*
(1.浙江大学生物系统工程与食品科学学院,杭州 310058;2.淳安县农业技术推广中心,杭州 311700)
果实在存贮及转运过程中由采后病害造成的损失巨大[1],其中扩展青霉(Penicillium expansum)被普遍认为是梨病害的主要病原菌[2-3]。现阶段,主要采用化学杀菌剂来防治该病害,然而过度使用化学杀菌剂会危害人体健康,造成环境污染及产生抗药性等问题[4]。当前,欧盟已禁止化学杀菌剂在核果类果实中的应用[5],因此,寻找安全无毒、环境友好和高效抑菌的化学杀菌剂替代品已成为现阶段的迫切需求[6]。将拮抗微生物用于果实采后病害的生物防治被视为最有可能替代化学杀菌剂的方法之一[1]。拮抗酵母具有安全无毒、使用方便及遗传稳定等优点,使其商品化运用成为可能。目前,国际上已有多种拮抗酵母的生物防治微生物制品获准注册生产,包括 Nexy、AQ10、Shemer及 Sporodex等[7-9]。为进一步提高拮抗酵母的生物防治效果,研究人员进行了多种尝试,包括逆境胁迫处理、培养条件优化、分离逆境条件拮抗菌种及表达外源基因等[3,10-12]。其中,随着分子技术的高速发展,将表达产物具有直接抑菌效力及能提高拮抗微生物抗逆性等外源基因定向转化拮抗酵母,逐渐成为生物防治领域的研究热点。毕赤酵母具有遗传操作简单、外源基因表达水平高且稳定、表达产物可加工及修饰等特点受到研究者青睐,目前已有多种抗菌肽在毕赤酵母中成功表达。BANANI等[13]将碱性丝氨酸蛋白酶基因转化到毕赤酵母表达系统中,诱导表达后能有效抑制苹果4种采后病原真菌的致病性。KUDDUS等[14]报道,将抗菌肽基因snakin-1转化毕赤酵母能有效抑制革兰氏阳性菌、革兰氏阴性菌及假丝酵母等的生长。
抗菌肽是生物体特定基因编码产生的一类具有抑菌作用的小分子多肽,对细菌具有高效光谱的杀灭能力,同时对真菌、病毒、原虫等也具有较强抑制作用[15-16]。抗菌肽在果蔬病害防治方面的应用前景广阔,微摩尔级即可有效地抑制病原菌,同时不易产生耐药性等特性使得抗菌肽的作用日益突出。如:ZHANG等[17]发现,从枯草芽孢杆菌(Bacillus subtilis)培养基中提取胰蛋白酶水解产物的多肽能有效抑制葡萄的腐败;LIU等[18]经体内和体外研究发现,CgPep33抗菌肽能有效地抑制草莓中灰葡萄孢的孢子萌发。然而受限于现阶段技术水平的落后,直接提取抗菌肽存在难度大、成本高、提取率低等劣势,以及许多天然抗菌肽会存在轻微的细胞毒性和溶血活性等安全问题,从而限制了抗菌肽的大规模使用。
本研究所选择的抗菌肽Ace-AMP1具有优异的热稳定性,沸水浴10 min后仍具有活性;Ace-AMP1对多种采后病原微生物具有高效的抑制作用。研究发现,Ace-AMP1对12种测试的真菌均具有抑制效果,其中对链格孢菌(Alternaria brassicola)的半抑制质量浓度(50%inhibiting concentration,IC50)低至 2.5 μg/mL,对灰葡萄孢(Botrytis cinerea)的半抑制质量浓度(IC50)低至3 μg/mL,同时,人体细胞溶血活性测定结果证实Ace-AMP1对人体细胞不具有毒性[19-20]。本研究根据毕赤酵母密码子的偏好性对Ace-AMP1抗菌肽目的基因进行优化,并将其构建到pPICZα A表达载体中,转化毕赤酵母GS115高效表达,以期能够得到高效表达Ace-AMP1的重组菌株及提高重组酵母在采后病害防治上的效果,为抗菌肽在抑制果实采后病害的开发利用方面奠定理论基础。
1 材料与方法
1.1 材料
实验用水果为成熟度相近、大小相等、无明显受损和无病害的,采摘于商业成熟期的水晶梨(Pyrus pyrifolia)。在实验开始前,水晶梨先用体积分数为0.1%的次氯酸钠溶液漂洗1 min,然后再用自来水冲洗干净,自然晾干后置于相同处理过的塑料筐中,备用。
表达载体pPICZα A及GS115酵母菌株购买于美国Invitrogen公司;大肠埃希菌菌株DH5α购买于南京诺唯赞(Vazyme)生物科技有限公司;青霉病病原菌(Penicillium expansum)为本实验室保存菌种。
限制性内切酶XhoⅠ、NotⅠ、SacⅠ及T4连接酶购买于英潍捷基(上海)贸易有限公司;PCR试剂2×Phanta Max Master Mix购买于南京诺唯赞(Vazyme)生物科技有限公司;质粒DNA小量提取试剂盒及DNA凝胶回收试剂盒均购买于美国Axygen公司;博来霉素购买于上海翊圣生物科技有限公司;一抗c-Myc Tag单克隆抗体购买于美国Invitrogen公司;二抗以辣根过氧化物酶(HRP)标记的山羊抗鼠IgG(H+L)购买于上海碧云天公司。胰蛋白胨、酵母提取物等其他试剂均为分析纯产品。
1.2 方法
1.2.1 目的基因的合成
为保证目的基因N端的天然活性,并根据表达载体序列信息,在目的基因前端序列添加Kex2酶切位点;同时根据毕赤酵母GS115密码子偏好性,对Ace-AMP1序列进行改造,在改造后的序列Kex2酶切位点前端添加XhoⅠ和NotⅠ作为限制性内切酶位点,优化后的目的基因序列委托生工生物工程(上海)股份有限公司合成,并将合成序列连接至pUC-SP载体上。
1.2.2 重组表达载体的构建
将含有优化目的基因的pUC-SP载体和表达载体pPICZα A分别用XhoⅠ和NotⅠ进行双酶切,所得产物用1%琼脂糖凝胶电泳检测并用DNA凝胶回收试剂盒回收优化后的目的片段和表达载体。将回收后的目的片段通过T4连接酶构建到pPICZα A质粒上,并将构建好的载体导入DH5α大肠埃希菌感受态细胞中,37℃培养45 min,然后涂布于低盐的LB+博来霉素平板(博来霉素质量浓度为25 μg/mL)上,37℃过夜培养至形成单菌落,最后分别挑取单菌落进行聚合酶链式反应(polymerase chain reaction,PCR)检测及后续测序鉴定。PCR反应条件为:95℃预变性30 s;95℃变性15 s,60 ℃退火15 s,72 ℃延伸30 s,循环35次;最后,72℃延伸5 min。5´AOX1特异性引物为:5´-GACTGGTTCCAATTGACAAGC-3´。3´AOX1特异性引物为:5´-GCAAATGGCATTCTGACATCC-3´。构建成功的重组表达载体命名为pPICZα A/Ace-AMP1,并用于下一步转化实验。
1.2.3 重组GS115/Ace-AMP1酵母的转化与鉴定
将构建好的重组表达载体pPICZα A/Ace-AMP1和未导入抗菌肽的空载体pPICZα A用SacⅠ酶切处理后,取10 μL线性化的载体与80 μL制备好的GS115感受态细胞混匀并转移至电转杯中,根据Bio-Rad电转仪设置的程序电击转化至感受态酵母细胞内,迅速添加1 mol/L山梨醇1 mL,28℃静置1 h,取200 μL电击转化液均匀涂布于YPD+博来霉素抗性平板(博来霉素质量浓度为100 μg/mL)上,并于28℃恒温条件下培养至形成单菌落。分别挑取单菌落进行酵母基因组的提取,并将其作为反应模板,引物、PCR反应体系与条件同1.2.2。将目的基因已正确整合到酵母基因组的重组转化菌株命名为GS115/Ace-AMP1,空载体转化菌株命名为GS115/pPICZαA。
1.2.4Ace-AMP1在酵母中的表达与鉴定
挑取经过验证的目的基因已整合到酵母基因组的重组菌株GS115/Ace-AMP1和空质粒对照菌株GS115/pPICZα A单菌落,于25 mL BMGY液体培养基中以30℃、250 r/min振荡过夜培养;离心收集菌体沉淀,用BMMY液体培养基重悬菌液至D(600 nm)=1.0,进行诱导表达。每隔24 h添加甲醇至终体积分数为1%,持续诱导120 h;每隔12 h取1 mL样品测定抗菌肽表达水平。
将样品以8 000g离心10 min,分别收集上清液和沉淀,每个取样时间点取50 μL上清液,用Braford法检测样品中的抗菌肽浓度。同时,将得到的上清液按照9∶1的比例加入100%三氯乙酸,混匀后置于冰上沉淀过夜,离心后加入预冷的丙酮振荡重悬,再次离心后加入十二烷基磺酸钠样品缓冲液重悬,沸水浴处理10 min,取10 μL样品进行Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodiumdodecylsulfatepolyacrylamide gel electrophoresis,SDS-PAGE),电泳后的凝胶进行转膜处理,然后加入Western封闭液缓慢摇动,室温封闭1 h后进行一抗和二抗孵育,最后进行蛋白检测。
将沉淀用无菌水清洗2遍,加入Yeast RNAprep Buffer试剂去除酵母细胞壁,然后在RNAiso试剂(RNAiso Plus)的作用下裂解细胞,释放核酸,再分别加入三氯甲烷和异丙醇提取酵母RNA,最后用75%乙醇对RNA进行清洗。得到的RNA用PrimeScriptTM反转录成cDNA,并将其作为实时荧光定量聚合酶链式反应(real-timequantitativepolymerase chain reaction,RT-qPCR)模板,采用2-ΔΔCT方法定量检测Ace-AMP1抗菌肽基因表达量。定量用特异性引物为内参基因引物GS115Actin(F:5´-GGTTCCCACTTATTTCCCAG-3´;R:5´-GCTCCTTCAGTTTTTCCGTCT-3´),抗菌肽基因引物为Ace-AMP1(F:5´-CCTGTAGATGTTTGG TAGGGG-3´;R:5´-GCATTGAATACGGGGACG-3´)。
1.2.5 重组GS115/Ace-AMP1酵母生物防治效果检测
重组转化株GS115/Ace-AMP1、对照菌株GS115/pPICZα A及毕赤酵母GS115在酵母膏胨葡萄糖琼脂培养基(yeast extract peptone dextrose medium,YPD)上活化2代,然后按照上述方法诱导培养后,离心收集菌体沉淀,用无菌水充分重悬洗涤菌体2次,最后用血球计数板计数,调整菌悬液至1×107mL-1。
将本实验室低温保存的扩展青霉病原菌活化2代,然后转接到马铃薯葡萄糖琼脂固体培养基(potato dextrose agar medium,PDA)上,28℃恒温培养至形成孢子,用经过无菌处理的接种环刮取适量分生孢子于无菌水中,最后用血球计数板计数,调整分生孢子悬液至1×104mL-1。
实验用水晶梨先经0.1%次氯酸钠溶液漂洗,再用自来水冲洗干净,自然晾干,备用。每个果实用无菌处理的打孔器在赤道部位制造4个伤口,每个伤口尽量保持宽5 mm、深5 mm。分别往伤口中添加50 μL无菌水(CK)、1×107mL-1的GS115菌悬浮液、1×107mL-1的 GS115/pPICZα A 菌悬浮液、1×107mL-1的GS115/Ace-AMP1菌悬浮液。自然晾干2 h后,每个伤口接种30 μL 1×104mL-1的青霉病原孢子悬浮液。选取9个梨果实作为一个处理置于饲料框中,用保鲜膜封口,保持90%的湿度环境,25℃恒温贮藏48 h后观察并记录果实的发病率及病斑直径。每个实验设置3个平行。
2 结果
2.1 Ace-AMP1目的基因优化及合成
以在APD(Antimicrobial Peptide Database)数据库中得到的Ace-AMP1抗菌肽作为母体肽,根据毕赤酵母GS115密码子偏好性对Ace-AMP1进行优化并合成,合成产物连接到pUC-SP载体上,测序验证后表明,XhoⅠ、NotⅠ、Kex2酶切位点及Ace-AMP1目的基因已正确连接。
2.2 pPICZα A/Ace-AMP1重组表达载体的构建
双酶切后的线性化载体和Ace-AMP1经切胶回收,并用T4连接酶过夜连接。构建好的表达载体转化大肠埃希菌,挑取单菌落经PCR扩增,结果如图1所示:有4个单菌落出现与理论值一致的单一条带,2个单菌落pPICZα A载体没有被完全切开。将与理论值一致的4个单菌落的PCR结果进一步测序验证,结果表明,Ace-AMP1已正确构建到pPICZαA表达载体上。

图1 重组质粒pPICZαA/Ace-AMP1的PCR鉴定结果Fig.1 Identification result of pPICZα A/Ace-AMP1 recombinant plasmid by PCR
2.3 重组载体的转化和鉴定结果
重组表达载体pPICZα A/Ace-AMP1和未导入抗菌肽的空载体pPICZα A电转化毕赤酵母GS115感受态细胞后,均匀涂布于含有博来霉素的抗性平板上,分别挑取单菌落连同毕赤酵母GS115一起进行PCR扩增,结果如图2所示:毕赤酵母GS115、导入空质粒后的GS115及导入重组表达载体后的GS115均能在2 000 bp处检测到条带,说明所用的通用引物5´AOX1和3´AOX1能识别GS115基因组其他位点,但是只在导入空质粒和导入抗菌肽重组质粒的GS115毕赤酵母中出现大小不同、与预期相符的2条条带,说明空载体pPICZα A和重组表达载体pPICZα A/Ace-AMP1已连接到GS115基因组中,进一步经测序验证表明结果正确。
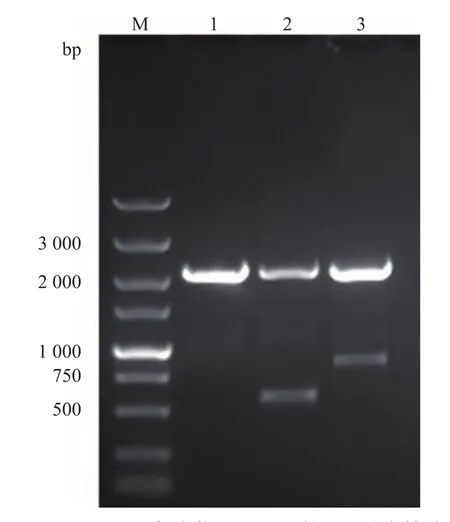
图2 重组菌株GS115/Ace-AMP1的PCR鉴定结果Fig.2 Identification result of GS115/Ace-AMP1 recombinant strain by PCR
2.4 Ace-AMP1在酵母中的表达与鉴定结果
挑取诱导表达后的含抗菌肽重组基因的GS115和诱导表达后的仅含空质粒的GS115测定抗菌肽表达水平,结果如图3所示:诱导84 h后,导入Ace-AMP1组的蛋白质量达到最大值,为109 μg/mL,而对照组则一直处于较低水平。

图3 重组酵母GS115/Ace-AMP1的蛋白质含量Fig.3 ProteincontentofGS115/Ace-AMP1recombinantstrain
每隔12 h取样,经RT-qPCR定量检测诱导表达后的重组GS115/Ace-AMP1酵母中Ace-AMP1抗菌肽基因的表达量,结果如图4所示:从12 h到108 h,抗菌肽Ace-AMP1基因均能上调表达,说明甲醇能显著诱导目的基因表达;在72 h时,Ace-AMP1基因表达量达到最大值,为诱导前的5.4倍。
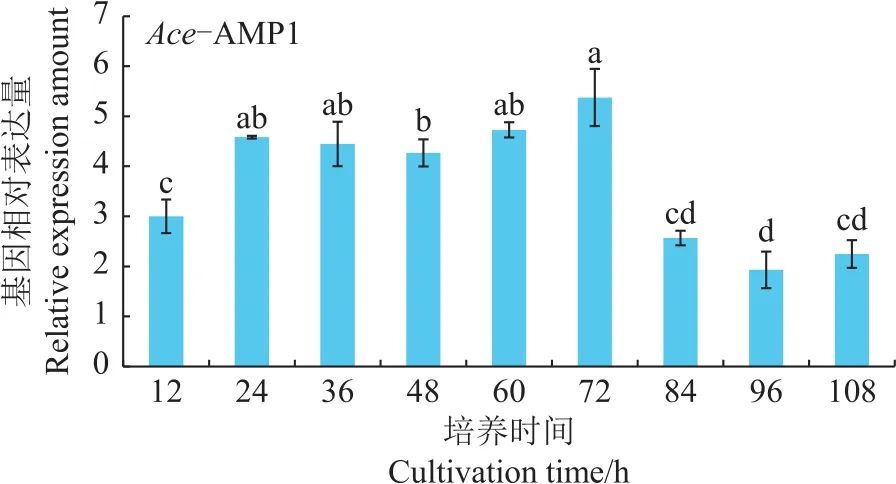
图4 重组酵母GS115/Ace-AMP1的Ace-AMP1基因相对表达量Fig.4 Relative expression amount of Ace-AMP1 for the recombinant strain GS115/Ace-AMP1
将取样得到的上清液经蛋白质印迹法(Western-blotting)检测,结果如图5所示:GS115毕赤酵母和导入空质粒的GS115/pPICZα A毕赤酵母在胶体中不存在条带,而导入抗菌肽后的重组GS115/Ace-AMP1毕赤酵母则存在一条分子质量约为12.5 kDa的条带,与预期结果相符。该实验结果进一步证明抗菌肽已成功导入毕赤酵母GS115中,并能够成功表达。

图5 重组菌株GS115/Ace-AMP1的蛋白质印迹法鉴定结果Fig.5 Identification result of GS115/Ace-AMP1 recombinant strain by Western-blotting
2.5 重组GS115/Ace-AMP1酵母对梨青霉病的防治效果
将重组转化株GS115/Ace-AMP1、对照菌株GS115/pPICZα A及毕赤酵母GS115诱导培养后,用调整到1×107mL-1的酵母菌悬液处理梨果实伤口,观察其对青霉病的影响。结果(图6A)表明,GS115/Ace-AMP1重组毕赤酵母能够有效地抑制青霉病的发生,经重组酵母GS115/Ace-AMP1悬浮液处理后的梨实验组,青霉病的发病率降低至41%,显著低于对照组,而用无菌水、GS115及含空质粒的GS115/pPICZα A酵母菌悬浮液处理后无显著变化,发病率分别为75%、71%、71%。梨果实病斑直径也具有相同的变化趋势,重组酵母GS115/Ace-AMP1处理的实验组病斑直径最小,仅为3.2 mm,相较于无菌水、GS115和导入空质粒GS115/pPICZα A处理的对照组,病斑直径分别下降65%、54%和61%(三者病斑直径分别为9.4、7.0和8.2 mm)(图6B)。青霉病发病率和病斑直径的结果说明,导入抗菌肽Ace-AMP1后能显著提高GS115的抑菌效果。
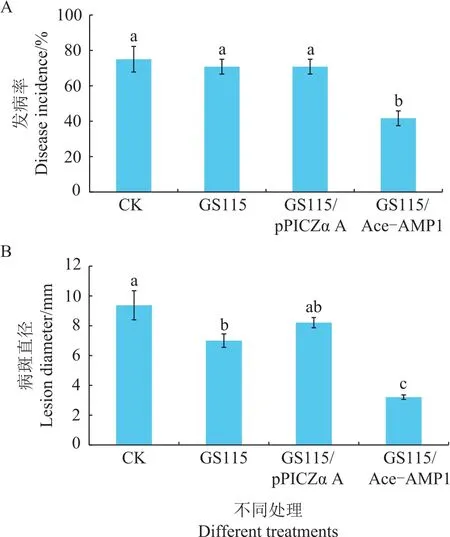
图6 重组酵母GS115/Ace-AMP1对梨青霉病的防治效果Fig.6 Control efficiency of recombinant strain GS115/Ace-AMP1 on Penicillium expansum in pear fruit
3 讨论
生物防治技术以其安全无毒、对环境友好、不易产生耐药性等特点逐渐受到人们的重视。作为一种新型采后保鲜技术,其作用模式主要是利用微生物之间的营养与空间竞争,分泌水解酶、杀菌物质和诱导果实产生抗性等来抑制病原微生物的生长,从而减小果蔬采后腐烂发生的概率[5,21-22]。毕赤酵母表达系统以其遗传稳定、不产生毒素、自身分泌蛋白较少及能对异源基因进行正确的翻译、加工和修饰等优点[13],成为应用最为广泛的真核表达系统之一。抗菌肽Ace-AMP1来自于可食性洋葱种子,且已有研究证实对人体细胞无毒害作用,因而其安全性得到保障;同时,其对病原真菌的抑制效果达到微摩尔级,展现出在生物防治领域的巨大潜力。然而,天然抗菌肽生产成本高、提取工艺烦琐等劣势限制了其应用与推广,同时拮抗菌的生物防治效力与化学杀菌剂相比仍存在较大差距,因此,通过基因工程方法将抗菌肽导入拮抗菌中表达,以提高抗菌肽的产率,以及利用其高效抑菌能力,提高重组菌株的生物防治效力。本研究首次将Ace-AMP1转化到毕赤酵母GS115中,获得了高效表达抗菌肽Ace-AMP1且具有优异抑菌效果的GS115/Ace-AMP1菌株,为该抗菌肽的大规模生产及抗菌肽在抑制果实采后病害的开发利用方面奠定了基础。
将重组酵母GS115/Ace-AMP1诱导培养后,在84 h时取样检测发现,其蛋白质质量浓度能达到109 μg/mL。而KUDDUS等[14]报道,将抗菌肽基因snakin-1转化毕赤酵母后其提取量为40 μg/mL;任雪艳[23]将Cecropin A转化毕赤酵母后其蛋白质质量浓度为14.247 μg/mL。本实验结果表明,重组酵母GS115/Ace-AMP1能高效表达抗菌肽Ace-AMP1,为抗菌肽的大规模生产提供了物质基础。
将重组酵母GS115/Ace-AMP1用于梨采后的病害防治实验可以发现:GS115毕赤酵母和转化空质粒后GS115/pPICZα A毕赤酵母的发病率与无菌水处理的对照组相比没有明显的差异,而导入抗菌肽之后的重组GS115/Ace-AMP1毕赤酵母能显著抑制梨青霉病的发生,发病率较无菌水处理组下降了34%;病斑直径变化规律与发病率基本一致;然而,由于毕赤酵母与病原真菌之间存在拮抗作用,自身也具有一定的生物防治效力,因而GS115与对照组之间存在着明显差异,但导入空质粒之后,其病斑直径与GS115无差异。抗菌肽Ace-AMP1作为能直接抑菌的物质导入GS115后,使得重组酵母病斑直径显著减小65%。综合发病率与平均病斑直径的结果表明,导入抗菌肽Ace-AMP1后,重组GS115/Ace-AMP1毕赤酵母的生物防治效力得到提升。
目前,抗菌肽主要用于医药、食品和饲料添加剂等领域。SHAYKHIEV等[24]发现,LL-37能通过刺激呼吸道上皮细胞的增殖来加速伤口的愈合。FERREIRA等[25]发现,乳酸链球菌肽(nisin)能显著降低干酪中产单核细胞李斯特菌(Listeria monocytogenes)的数目,延长干酪的保质期。但抗菌肽在果蔬采后病害防治领域的研究鲜有报道。本研究通过将抗菌肽导入拮抗酵母进一步提高其生物防治效力的方法,能为果蔬采后病害新型生物防治技术的研究提供新思路和奠定理论基础。
本研究仍存在一些不足:一是虽然所选的Ace-AMP1基因来源于可食性的洋葱种子组织,且已被证实对人体细胞无毒害作用,同时毕赤酵母表达系统已被批准作为一种动物饲料添加剂[26],但表达后的Ace-AMP1的安全性仍需进一步探究;二是现阶段抗菌肽的作用机制仍没有得到统一,普遍认为其依赖于与靶细胞膜的相互作用,使得膜通透性改变,打破酸碱平衡、渗透压平衡等,而除了作用于细胞膜外,认为其还能作用于胞内靶标,从而干扰细胞代谢[27],因此,今后需进一步探讨导入抗菌肽后的重组酵母的相关抑菌机制。
参考文献(References):
[1]SHARMA R R,SINGH D,SINGH R.Biological control of postharvest diseases of fruits and vegetables by microbial antagonists:a review.Biological Control,2009,50(3):205-221.
[2]SÁNCHEZ C V,SERRANO C,CONCEIÇÃO OLIVEIRA M,et al.Differential susceptibility of Morettini pears to blue mold caused byPenicillium expansum.Emirates Journal of Food and Agriculture,2016,28(6):374-380.
[3]ZENG L Z,YU C,FU D A,et al.Improvement in the effectiveness ofCryptococcus laurentiito control postharvest blue mold of pear by its culture in beta-glucan amended nutrient broth.Postharvest Biology and Technology,2015,104:26-32.
[4]REN X Y,KONG Q J,WANG H L,et al.Biocontrol of fungal decay of citrus fruit byPichia pastorisrecombinant strains expressing cecropin A.Food Chemistry,2012,131(3):796-801.
[5]BANANI H,SPADARO D,ZHANG D P,et al.Postharvest application of a novel chitinase cloned fromMetschnikowia fructicolaand overexpressed inPichia pastoristo control brown rot of peaches.International Journal of Food Microbiology,2015,199:54-61.
[6]NUNES C A.Biological control of postharvest diseases of fruit.European Journal of Plant Pathology,2012,133(1):181-196.
[7]SUNDH I,MELIN P.Safety and regulation of yeasts used for biocontrol or biopreservation in the food or feed chain.Antonie Van Leeuwenhoek,2011,99(1):113-119.
[8]BALLETN,SOUCHEJL,VANDEKERCKOVEP.Efficacy ofCandida oleophila,strain O,in preventing postharvest diseases of fruits.Acta Horticulturae,2016,1144:105-112.
[9]LEGLER S E,PINTYE A,CAFFI T,et al.Sporulation rate in culture and mycoparasitic activity,but not mycohost specificity,are the key factors for selectingAmpelomycesstrains forbiocontrolofgrapevine powdery mildew(Erysiphe necator).European Journal of Plant Pathology,2016,144(4):723-736.
[10]HU H,YAN F J,WILSON C,et al.The ability of a coldadaptedRhodotorula mucilaginosastrain from Tibet to control blue mold in pear fruit.Antonie Van Leeuwenhoek,2015,108(6):1391-1404.
[11]QIN X J,XIAO H M,XUE C H,et al.Biocontrol of gray mold in grapes with the yeastHanseniaspora uvarumalone and in combination with salicylic acid or sodium bicarbonate.Postharvest Biology and Technology,2015,100:160-167.
[12]LIU J,WISNIEWSKI M,ARTLIP T,et al.The potential role ofPR-8gene of apple fruit in the mode of action of the yeast antagonist,Candida oleophila,in postharvest biocontrol ofBotrytis cinerea.Postharvest Biology and Technology,2013,85:203-209.
[13]BANANI H,SPADARO D,ZHANG D P,et al.Biocontrol activity of an alkaline serine protease fromAureobasidium pullulansexpressed inPichiapastorisagainst four postharvest pathogens on apple.International Journal of Food Microbiology,2014,182/183:1-8.
[14]KUDDUS M R,RUMI F,TSUTSUMI M,et al.Expression,purification and characterization of the recombinant cysteine-rich antimicrobialpeptidesnakin-1 inPichia pastoris.Protein Expression and Purification,2016,122:15-22.
[15]MENSA B,KIM Y H,CHOI S,et al.Antibacterial mechanism of action of arylamide foldamers.Antimicrobial Agents and Chemotherapy,2011,55(11):5043-5053.
[16]ZHANG J,WU X,ZHANG S Q.Antifungal mechanism of antibacterial peptide,ABP-CM4,fromBombyx moriagainstAspergillus niger.Biotechnology Letters,2008,30(12):2157-2163.
[17]ZHANG B,WANG J N,NING S Q,et al.Peptides derived from tryptic hydrolysate ofBacillus subtilisculture suppress fungal spoilage of table grapes.Food Chemistry,2018,239:520-528.
[18]LIU Z Y,ZENG M Y,DONG S Y,et al.Effect of an antifungal peptide from oyster enzymatic hydrolysates for control of gray mold(Botrytis cinerea)on harvested strawberries.Postharvest Biology and Technology,2007,46(1):95-98.
[19]CAMMUE B P,THEVISSEN K,HENDRIKS M,et al.A potent antimicrobial protein from onion seeds showing sequence homology to plant lipid transfer proteins.Plant Physiology,1995,109(2):445-455.
[20]TASSIN S,BROEKAERT W F,MARION D,et al.Solution structure ofAce-AMP1,a potent antimicrobial protein extracted from onion seeds.Structural analogies with plant nonspecific lipid transfer proteins.Biochemistry,1998,37(11):3623-3637.
[21]YU S M,LEE Y H.Genes involved in nutrient competition byPseudomonas putidaJBC17 to suppress green mold in postharvest satsuma mandarin.JournalofBasic Microbiology,2015,55(7):898-906.
[22]LU L F,YE C Z,GUO S H,et al.Preharvest application of antagonistic yeastRhodosporidium paludigenuminduced resistance against postharvest diseases in mandarin orange.Biological Control,2013,67(2):130-136.
[23]任雪艳.重组酵母GS115/PSD、GS115/CEC的构建及其对水果采后病害抑制效果的研究.杭州:浙江大学,2012.REN X Y.Construction of recombinant yeast GS115/PSD,GS115/CEC and study on their inhibition effect on fruit postharvest decay.Hangzhou:Zhejiang University,2012.(in Chinese with English abstract)
[24]SHAYKHIEV R,BEISSWENGER C,KANDLER K,et al.Human endogenous antibiotic LL-37 stimulates airway epithelial cell proliferation and wound closure.American JournalofPhysiology:LungCellularandMolecular Physiology,2005,289(5):L842-L848.
[25]FERREIRAMA,LUND B M.The effect of nisin onListeriamonocytogenes in culture medium and long-life cottage cheese.Letters in Applied Microbiology,1996,22(6):433-438.
[26]任雪艳,郑晓冬.表达豌豆防御素基因的重组酵母对采后柑橘酸腐病的生物防治.中国食品学报,2011,11(6):102-107.REN X Y,ZHENG X D.Biological control of postharvest citrus sour rot byPichia pastorisrecombinant strains expressing pea defensin gene.Journal of Chinese Institute of Food Science and Technology,2011,11(6):102-107.(in Chinese with English abstract)
[27]李冠楠,夏雪娟,隆耀航,等.抗菌肽的研究进展及其应用.动物营养学报,2014,26(1):17-25.LI G N,XIA X J,LONG Y H,et al.Research progresses and applications of antimicrobial peptides.Chinese Journal of Animal Nutrition,2014,26(1):17-25.(in Chinese with English abstract)

