桂花扩展蛋白基因OfEXPA2、OfEXPA4和OfEXLA1启动子克隆及活性分析
高晓月,董彬,张超,付建新,胡绍庆,赵宏波*,梁立军
(1.浙江农林大学风景园林与建筑学院,杭州 311300;2.浙江理工大学建筑工程学院,杭州 310018)
桂花(Osmanthus fragrans)是中国十大传统名花之一,是集绿化、美化和香化为一体的园林树种,在中国有悠久的栽培历史,深受人们喜爱。桂花(本文指的是秋桂)的花在开放前需要一段时间的相对低温,并且持续一段时间才能发挥作用[1]。为了解桂花的开花机制,研究花开放过程中的控制基因就显得尤为重要。
扩展蛋白作为细胞壁松弛因子,在花开放过程中调节细胞扩展,影响花开放进程[2],其作用机制一般认为是扩展蛋白通过打断细胞壁纤维素与半纤维素之间的非共价键,促使它们之间相互位移,从而引起细胞壁伸展[3]。植物扩展蛋白家族由4个亚家族组成,分别命名为EXPA(α-expansin)、EXPB(β-expansin)、EXLA(expansin-like A)和EXLB(expansin-like B)[4]。研究表明,扩展蛋白影响了种子的萌发[5]、根毛的起始和延长[6]、茎和叶的生长发育[7-8]、花粉管的延长[9]、果实的成熟[10]等,几乎参与了植物的整个生长发育进程。唐菖蒲(Gladiolus gandavensis)中的扩展蛋白基因GgEXPA1[11]参与了花开放进程,在香石竹(Dianthus caryophyllus)和蜡梅(Chimonanthus praecox)中也发现了这种影响花开放的基因[12-13]。扩展蛋白家族的大多数基因受外界环境的调控,启动子中包含了相应的响应元件,因此,研究扩展蛋白基因的启动子对于了解该基因的调控机制有重要意义。
本文选择前期筛选获得的3个与桂花花开放紧密相关的扩展蛋白基因OfEXPA2、OfEXPA4和OfEXLA1[14],利用染色体步移法克隆启动子序列,分析启动子中包含的顺式作用元件;同时,构建启动子融合β-葡萄糖苷酸酶(β-glucuronidase,GUS)报告基因的表达载体,通过农杆菌介导的叶盘法转化烟草,利用组织化学染色观察报告基因的表达,从而检测该启动子的活性。
1 材料与方法
1.1 材料
1.1.1 植物材料
以浙江农林大学桂花资源圃栽种的桂花丹桂品种‘堰虹桂’(Osmanthus fragrans‘Yanhong Gui’)为实验材料,树龄6—8年。
1.1.2 菌株、质粒及试剂
实验中所用的限制性内切酶、T4DNA连接酶、PremixTaq酶、琼脂糖凝胶DNA回收试剂盒、DNA纯化试剂盒、DL2000标志物、克隆载体pMD18-T、大肠埃希菌(Escherichia coli)DH5α、In-Fusion®HD克隆试剂盒、质粒提取试剂盒等均购自TaKaRa公司(大连),X-gluc购自生工生物工程(上海)有限公司,pBI121菌液由浙江农林大学观赏植物遗传育种实验室保存。
1.2 方法
1.2.1OfEXPA2、OfEXPA4和OfEXLA1启动子的克隆与调控元件分析
于2016年9月采集生长健壮的桂花树幼嫩叶片,采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法提取基因组DNA。分别用平末端限制性内切酶DraⅠ、EcoRⅤ、PvuⅡ和StuⅠ对基因组DNA进行酶切,构建基因组酶切文库。按照DNA纯化试剂盒说明书纯化酶切产物,并用T4DNA连接酶将接头序列添加至基因组DNA酶切片段的5´末端。接头序列按照Genome Walker说明书合成。分别以本课题组已获得的OfEXPA2、OfEXPA4和OfEXLA1基因序列为基础,设计3对特异性引物OfEXPA2-GSP1/2、OfEXPA4-GSP1/2和OfEXLA1-GSP1/2,并结合2条简并引物AP1、AP2(表1)进行2轮聚合酶链式反应(polymerase chain reaction,PCR)扩增。
以添加过接头的基因组酶切文库为预扩增模板,使用接头引物AP1与基因特异性引物GSP1进行第1轮PCR。反应体系:模板1 μL,简并引物AP1(10 μmol/L)1 μL,GSP1(10 μmol/L)1 μL,PremixTaq酶10 μL,ddH2O 7 μL。反应程序:94 ℃预变性5 min;94 ℃变性 25 s,72 ℃退火30 s,7个循环;94 ℃变性25 s,67 ℃退火3 min,35个循环;67℃延伸7 min。将第1轮PCR产物稀释50倍作为模板,使用简并引物AP2与GSP2配对进行第2轮PCR。反应体系:模板 1 μL,接头引物 AP2(10 μmol/L)1 μL,基因特异性引物 GSP2(10 μmol/L)1 μL,PremixTaq酶10 μL,ddH2O 7 μL。反应程序:94 ℃预变性5 min;94 ℃变性25 s,72 ℃退火3 min,5个循环;94℃变性25 s,67℃退火3 min,20个循环;72℃延伸10 min。
PCR产物经过1.2%琼脂糖凝胶电泳检测,目的条带按TaKaRa公司琼脂糖凝胶DNA回收试剂盒说明书进行PCR产物回收;连接反应按照TaKaRa公司pMD18-T载体说明书进行;将连接后的重组质粒导入大肠埃希菌DH5α,并用氨苄霉素筛选,挑取白色单菌落进行菌液PCR扩增并送出测序。测序结果用DNAman软件进行比对,比对正确的启动子序列采用植物顺式作用元件数据库Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)在线预测分析可能存在的顺式作用元件。
1.2.2 植物表达载体的构建
植物表达载体pBI121是一个双元载体,含有GUS基因系统和CaMV35S启动子。为了研究OfEXPA2、OfEXPA4和OfEXLA1启动子的功能,用其替换植物表达载体pBI121中的35S启动子,与GUS报告基因融合,构建植物表达载体。用HindⅢ和XbaⅠ双酶切pBI121载体,纯化产物。按照In-Fusion®HD克隆试剂盒说明书分别设计3对上下游引物OfEXPA2-F/R、OfEXPA4-F/R及OfEXLA1-F/R(表1),以桂花基因组DNA为模板进行PCR扩增,PCR产物纯化后分别与pBI121酶切后的纯化产物进行连接反应,将连接产物转入大肠埃希菌DH5α,经PCR鉴定后送至生工生物工程(上海)有限公司测序。

表1 引物序列及用途Table 1 Primer sequences and their function
1.2.3 农杆菌介导的叶盘法转化烟草及GUS瞬时表达鉴定
将构建好的各个重组质粒分别转入农杆菌GV3101,以GV3101空菌株为阴性对照,含pBI121载体的菌株为阳性对照,对携带有重组载体的菌株进行瞬时表达分析。将烟草叶片切成0.5 cm×0.5 cm的小块后放入吸光度值为0.6的农杆菌菌液中侵染10 min,用无菌滤纸将叶片表面的菌液吸干,将经侵染的外植体置于被无菌水浸润的滤纸上,暗培养24 h后进行GUS组织化学染色,用V(醋酸)∶V(乙醇)为3∶1的脱色液浸泡至阴性对照为白色时,用体视显微镜(ZEISS CL-6000)进行观察并拍照。
2 结果与分析
2.1 启动子克隆
根据设计的引物进行2轮PCR扩增后,分别从EcoRⅤ酶切体系中得到3条较长的片段(图1),将PCR产物测序结果与基因序列拼接后,得到了OfEXPA2、OfEXPA4和OfEXLA1的启动子片段,长度分别为1 108、808、945 bp。
2.2 启动子序列分析
采用Plantcare在线预测网站对所得到的启动子序列进行分析发现,OfEXPA2启动子序列中含有大多数高等植物启动子具有的保守元件TATA盒(起始密码子上游-94 bp)和CAAT盒(起始密码子上游-179 bp),同时含有脱落酸响应元件、MYB结合位点、多个光调控作用元件和参与昼夜节律调控的元件(图2)。
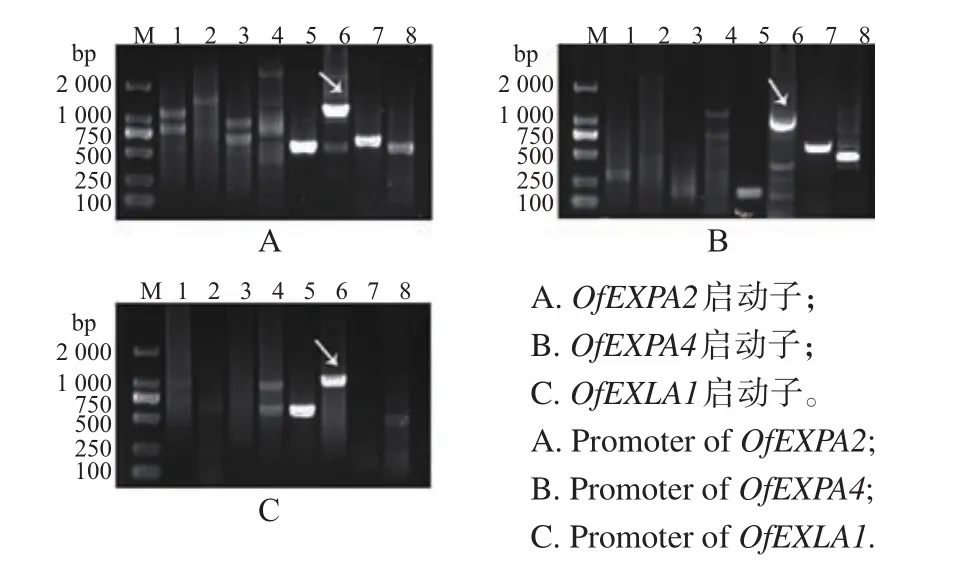
图1 桂花OfEXPA2、OfEXPA4和OfEXLA1启动子扩增Fig.1 Amplification of OfEXPA2,OfEXPA4 and OfEXLA1 promoters from O.fragrans
对克隆的OfEXPA4启动子片段分析发现,该序列含有大多数高等植物启动子的基本元件TATA盒(起始密码子上游-80 bp)和CAAT盒(起始密码子上游-397 bp),在3´端还存在一个参与基因转录水平调控的5´-UTR Py-rich元件,除此之外,OfEXPA4启动子序列还含有多个光响应顺式作用元件、MYB结合位点、创伤诱导元件(图3)。
利用启动子顺式作用元件预测网站Plantcare上相关软件对所得的OfEXLA1启动子序列进行分析发现:该序列含有大多数高等植物启动子的基本元件TATA盒(起始密码子上游-61bp)和CAAT盒(起始密码子上游-27bp)。除了这些基础元件外,在OfEXLA1启动子区域中,还发现了与激素调控有关的反应元件:生长素响应元件、水杨酸响应元件。另外,在OfEXLA1启动子序列中还发现了热激响应元件HSE、MYB结合位点MBSⅡ和4个光响应元件(图4)。

图2 OfEXPA2启动子序列及顺式作用元件Fig.2 Sequences and cis-elements of OfEXPA2 promoter
2.3 转基因烟草叶片GUS组织化学染色
将构建好的重组载体命名为OfEXPA2∶∶GUS、OfEXPA4∶∶GUS 和OfEXLA1∶∶GUS,并与 pBI121(CAMV35S∶∶GUS)空载体用冻融法转化到农杆菌GV3101中,其中pBI121空载体为阳性对照,GV3101为阴性对照,通过叶盘法转化烟草进行瞬时表达。结果表明:转CAMV35S启动子和转化OfEXPA2∶∶GUS、OfEXPA4∶∶GUS、OfEXLA1∶∶GUS的烟草叶片经GUS组织化学染色后均有蓝色,其中OfEXPA2∶∶GUS 的染色最深,其次是OfEXLA1∶∶GUS,而OfEXPA4∶∶GUS染色最浅,而阴性对照没有蓝色(图5)。说明克隆的3种启动子均能驱动报告基因GUS的表达。

图3 OfEXPA4启动子序列及顺式作用元件Fig.3 Sequences and cis-elements of OfEXPA4 promoter
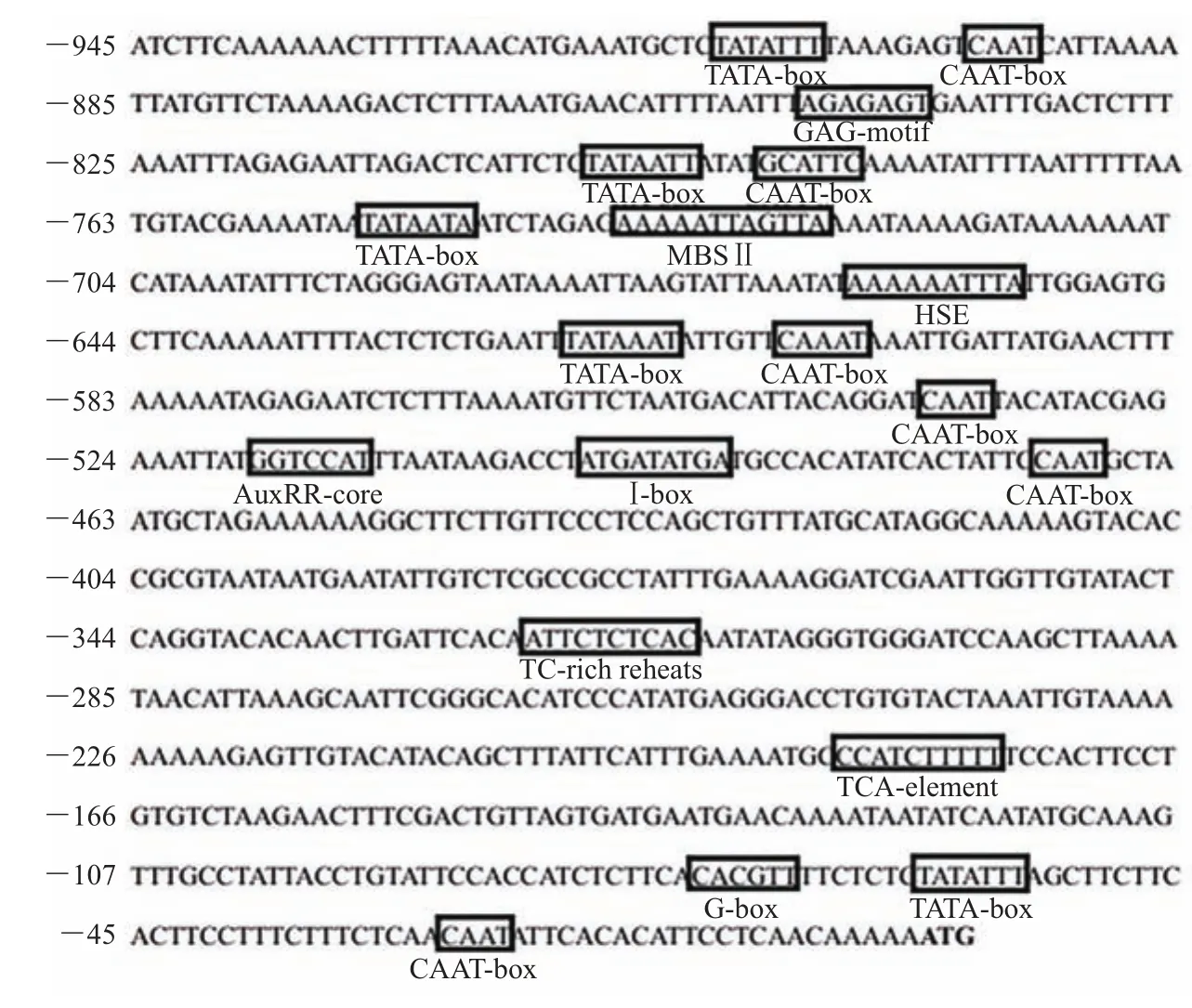
图4 OfEXLA1启动子序列及顺式作用元件Fig.4 Sequences and cis-elements of OfEXLA1 promoter
3 讨论
高等植物基因的表达受到多种因素的影响,但是主要发生在调控水平上,受多种顺式作用元件与反式作用因子的相互协调作用[15];因此,了解基因的调控网络取决于对顺式作用元件的分析[16]。在扩展蛋白家族中,一些扩展蛋白基因受激素的调控。MaExp1是香蕉(Musa acuminata)果实中的特异性基因,在MaExp1启动子中存在乙烯和生长素的响应元件,实验证明乙烯和生长素能够协同作用增强该基因的表达[17]。棉花(Gossypium barbadense)扩展蛋白基因GbEXPA2启动子中有脱落酸和赤霉素响应元件,外源赤霉素和脱落酸分别能够上调和下降GbEXPA2的表达[18]。水稻中扩展蛋白的活性在干旱胁迫下受到生长素和脱落酸的诱导[19]。在洋桔梗(Eustoma grandiflorum)中,茉莉酸甲酯能够促进EgEXPA2、EgEXPA3和EgXTH1的表达,推动花瓣中细胞壁的松弛,从而影响花开放进程[20]。生物信息学分析发现,在OfEXPA2启动子中含有脱落酸响应元件,在OfEXLA1启动子中含有生长素响应元件、水杨酸响应元件。因此,推测OfEXPA2和OfEXLA1启动子能够在激素的诱导下调控基因的表达。
除各类激素元件外,OfEXPA2、OfEXPA4和OfEXLA1的启动子中还存在温度、干旱胁迫等相关元件。在OfEXLA1启动子中存在热激元件HSE,该元件能够和参与热胁迫的转录因子结合,启动下游基因的表达,提高或降低植物的耐热性[21]。除此之外,MBS元件、MBSⅡ元件分别与其中MYB转录因子结合参与干旱胁迫的响应和类黄酮的合成,其中MYB转录因子广泛分布在植物中,并与脱落酸合成有关,能够与其他转录因子相互作用[22]。目前,参与类黄酮合成的MYB转录因子有AtMYB011/AtMYB012/AtMYB111[23]、EsMYB[24]等,参与干旱胁迫响 应 的 有AtMYB002、AtMYB060/AtMYB094[25]、AtMYB096[26]等,其中,AtMYB102和AtMYB096受外源脱落酸的诱导。在本研究的OfEXPA2启动子中有脱落酸响应元件,推测脱落酸响应元件与MYB结合位点共同作用于OfEXPA2启动子,从而调控目的基因的表达。
通过对启动子和GUS融合表达载体的转基因烟草叶片研究发现,OfEXPA2、OfEXPA4和OfEXLA1启动子均能够驱动下游基因的表达。其中OfEXPA2启动子染色最深,OfEXPA4启动子染色最浅,可能是由于扩展蛋白基因在不同的组织器官中的表达活性不同。
综上所述,在本研究中启动子活性可能受到激素的诱导并使得相关扩展蛋白基因的表达发生变化,影响花开放。下一步研究将构建脱落酸、生长素、水杨酸响应元件的缺失载体,分析不同缺失启动子片段诱导表达活性的强弱,从而确定激素对启动子的作用,期望通过对OfEXPA2、OfEXPA4和OfEXLA1启动子的深入研究来为揭示桂花花开放的分子机制提供理论依据。

图5 瞬时表达检测结果Fig.5 Detection result of transient expression
4 结论
本研究克隆了桂花花开放相关基因OfEXPA2、OfEXPA4和OfEXLA1起始密码子上游1 108、808、945 bp的启动子序列,在这3个启动子序列中均存在基本元件TATA盒和CAAT盒,以及激素诱导元件和干旱、高温等多个与植物非生物胁迫相关的元件;通过烟草叶片瞬时表达证明这3个启动子均能驱动下游基因的表达。
参考文献(References):
[1]王英,张超,付建新,等.桂花花芽分化和花开放研究进展.浙江农林大学学报,2016,33(2):340-347.WANG Y,ZHANG C,FU J X,et al.Progresses on flower bud differentiation and floweropening inOsmanthus fragrans.Journal of Zhejiang A&F University,2016,33(2):340-347.(in Chinese with English abstract)
[2]VAN DOORN W G,VAN M U.Flower opening and closure:A review.Journal of Experimental Botany,2003,54(389):1801-1812.
[3]MCQUEEN-MASON S,COSGROVE D J.Disruption of hydrogen bonding between plant cell wall polymers by proteins that induce wall extension.Proceedings of the National Academy of Sciences of the United States of America,1994,91(14):6574-6578.
[4]KENDE H,BRADFORD K,BRUMMELL D,et al.Nomenclature for members of the expansin superfamily of genes and proteins.Plant Molecular Biology,2004,55(3):311-314.
[5]YAN A,WU M J,YAN L M,et al.AtEXP2is involved in seed germination and abiotic stress response inArabidopsis.PLoS One,2014,9(1):e85208.
[6]ZOU H Y,WENWEN Y H,ZANG G C,et al.OsEXPB2,aβexpansin gene,is involved in rice root system architecture.Molecular Breeding,2015,35:41.
[7]XING S C,LI F,GUO Q F,et al.The involvement of an expansin geneTaEXPB23from wheat in regulating plant cell growth.Biologia Plantarum,2009,53(3):429-434.
[8]GOH H H.The role of expansin in leaf development:A molecular genetics and AFM approach.Sheffield,UK:The University of Sheffield,2011.
[9]VALDIVIAER,STEPHENSONAG,DURACHKODM,et al.Class Bβ-expansins are neededfor pollenseparationandstigma penetration.Sexual Plant Reproduction,2009,22(3):141-152.
[10]PALAPOL Y,KUNYAMEE S,THONGKHUM M,et al.Expression of expansin genes in the pulp and the dehiscence zone of ripening durian(Durio zibethinus)fruit.Journal of Plant Physiology,2015,182:33-39.
[11]AZEEZ A,SANE A P,TRIPATHI S K,et al.The gladiolusGgEXPA1is a GA-responsive alpha-expansin gene expressed ubiquitously during expansion of all floral tissues and leaves but repressed during organ senescence.Postharvest Biology&Technology,2010,58(1):48-56.
[12]HARADAT,TORII Y,MORITAS,et al.Cloning,characterization,and expression of xyloglucan endotransglucosylase/hydrolase and expansin genes associated with petal growth and development during carnation flower opening.Journal of Experimental Botany,2010,62(2):815-823.
[13]MA J,LI Z,WANG B,et al.Cloning of an expansin gene fromChimonanthus praecoxflowers and its expression in flowers treated with ethephon or 1-methylcyclopropene.HortScience,2012,47(10):1472-1477.
[14]罗云,张超,付建新,等.桂花扩展蛋白基因家族的鉴定和表达分析.农业生物技术学报,2017,25(8):1289-1299.LUO Y,ZHANG C,FU J X,et al.Identification and expression analysis of expansin gene family inOsmanthusfragrans.Journal of Agricultural Biotechnology,2017,25(8):1289-1299.(in Chinese with English abstract)
[15]周小琼,丁一琼,左丽,等.大豆硫转运蛋白基因GmSULTR1;2b启动子的克隆及活性分析.中国农业科学,2015,48(8):1650-1659.ZHOU X Q,DING Y Q,ZUO L,et al.Cloning and activity analysisofthe promoterofsulfate transportergeneGmSULTR1;2b.Scientia Agricultura Sinica,2015,48(8):1650-1659.(in Chinese with English abstract)
[16]YAMAGUCHI-SHINOZAKI K,SHINOZAKI K.Organization ofcis-acting regulatory elements in osmotic-and cold-stress-responsive promoters.Trends in Plant Science,2005,10(2):88-94.
[17]TRIVEDI P K,NATH P.MaExp1,an ethylene-induced expansin from ripening banana fruit.Plant Science,2004,167(6):1351-1358.
[18]LI Y,TU L L,YE Z X,et al.A cotton fiber-preferential promoter,PGbEXPA2,is regulated by GA and ABA inArabidopsis.Plant Cell Reports,2015,34(9):1539-1549.
[19]ZHAO M R,HAN Y Y,FENG Y N,et al.Expansins are involved in cell growth mediated by abscisic acid and indole-3-acetic acid under drought stress in wheat.Plant Cell Reports,2012,31(4):671-685.
[20]OCHIAI M,MATSUMOTO S,YAMADA K.Methyl jasmonate treatmentpromotesfloweropening ofcutEustomaby inducing cell wall loosening proteins in petals.Postharvest Biology&Technology,2013,82:1-5.
[21]李娟.水稻温度诱导启动子POsUAH和POsACO1的结构与功能研究.北京:中国科学院大学,2014:20-24.LI J.Function analysis of two rice temperature-inducible promotersPOsUAHandPOsACO1.Beijing:University of Chinese Academy of Sciences,2014:20-24.(in Chinese with English abstract)
[22]AMBAWAT S,SHARMA P,YADAV N R,et al.MYB transcription factor genes as regulators for plant responses:an overview.Physiology and Molecular Biology of Plants,2013,19(3):307-321.
[23]STRACKE R,ISHIHARA H,HUEP G,et al.Differential regulation of closely related R2R3-MYB transcription factors controls flavonol accumulation in different parts of theArabidopsis thalianaseedling.The Plant Journal,2007,50(4):660-677.
[24]HUANG W J,SUN W,LÜ H Y,et al.A R2R3-MYB transcription factor fromEpimedium sagittatumregulates the flavonoid biosynthetic pathway.PLoS One,2013,8(8):e70778.
[25]COMINELLI E,GALBIATI M,VAVASSEUR A,et al.A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance.Current Biology,2005,15(13):1196-1200.
[26]SEO P J,XIANG F N,QIAO M,et al.The MYB96 transcription factor mediates abscisic acid signaling during drought stress response inArabidopsis.Plant Physiology,2009,151(1):275-289.

