介入封堵治疗心肌梗死后室间隔穿孔疗效观察
蒋 辉, 吴志勇, 卢荔红, 陈 斌, 郭延松
心肌梗死后室间隔穿孔(post-infarction ventricular septal rupture,PI-VSR)是一种少见的急性心肌梗死(acute myocardial infarction,AMI)后致命性机械并发症,确诊后2月内的死亡率高达87%~100%[1]。由于早期血运重建术策略的应用,PI-VSR的发病率由1%~2%下降至0.25%~0.31%[2]。外科缝补术是治疗PI-VSR的传统有效的治疗手段,但术后病死率较高,大量残余分流及缝补后再破裂的发生率达10%~20%[3-4]。近年来,经皮导管介入封堵治疗PI-VSR也是可选择的方法,具有创伤小、恢复快的优点[5],可帮助患者度过血流动力学不稳定时期,改善远期心功能及生活质量。本研究通过单中心回顾性分析2014年12月-2016年10月确诊的10例PI-VSR患者的临床特征,总结经皮导管介入封堵的治疗效果及对术后心功能的影响。
1 对象与方法
1.1对象 10例中,男性5例,女性5例,年龄(64.5±7.5)岁(54~80岁)。体表心电图定位显示,前壁心肌梗死7例,下壁心肌梗死3例;超声心动图提示,左室射血分数(left ventricular ejection fraction,LVEF)为20%~48%,左室舒张末内径(left ventricular end-diastolic diameter,LVEDD)为50~55 mm。单一穿孔7例,多发穿孔3例,穿孔直径4~19 mm;穿孔位于心尖部6例,位于后间隔4例;穿孔时间明确的7例,为5.5 d(1~10 d)。4例使用IABP辅助治疗。
患者均符合我国推荐的“心肌梗死全球定义”的诊断标准:(1)持续胸痛>20 min;(2)心电图示相邻2个导联ST段抬高的动态演变;(3)心肌坏死的血清心肌标记物动态改变。PI-VSR诊断标准:(1)查体为新出现的胸骨左缘中下部响亮的全收缩期喷射性杂音;(2)超声心动图证实室间隔回声失落,且出现左向右分流血流信号。
1.2方法
1.2.1药物治疗方法 患者确诊时均未接受急诊血运重建或溶栓治疗,入院后均接受双联抗血小板、抗凝、调脂及利尿等治疗,并加用血管活性药物,如多巴胺、硝酸酯类等。术前患者均常规口服阿司匹林100 mg/d和氯吡格雷75 mg/d,皮下注射低分子肝素5 000 U(每天2次)。术前1天予负荷剂量的氯吡格雷300 mg顿服,术中予肝素100 U/kg,1 h后追加1 000~2 000 U。术后继续口服阿司匹林100 mg/d和氯吡格雷75 mg/d,连续3 d皮下注射低分子肝素5 000 U(每天2次)。
1.2.2介入封堵方法 (1)术前常规行超声心电图检查,确认VSR及瓣膜启闭情况(图1A),常规左侧股静脉穿刺置管,送临时起搏电极至下腔静脉处备用;(2)右侧股动脉穿刺后,6F猪尾导管在导丝引导下进至左心室行左心室造影,在左前斜+头位体位显示室间隔穿孔位置及大小(图1B),主动脉瓣上造影观察主动脉瓣返流情况;(3)塑形的猪尾导管和260 mm超滑导丝经穿孔口送至右心室达肺动脉或上下腔静脉,沿右侧股静脉送入圈套器抓取导丝建立动静脉轨道;(4)根据超声心动图及左心室造影结果选择相应的国产VSR专用封堵器(上海形状记忆合金公司),沿导丝经股静脉送入输送鞘及封堵器,完成封堵(图1C);(5)重复左心室造影,床旁超声心动图评估封堵器位置、形态及残余分流情况(图1D),释放封堵器。同期行冠状动脉(冠脉)造影,观察冠脉病变情况,并对部分患者同时行经皮冠脉介入治疗(percutaneous coronary intervention,PCI)。

A:术前超声提示室间隔穿孔;B:左心室造影提示室间隔穿孔;C:封堵后残余少量分流;D:术后超声提示封堵器位置良好.图1 VSR封堵前后超声心动图及左心室造影Fig 1 Echocardiography image and left ventriculography image contrast by before and after VSR occlusion
1.2.3分组及观察指标 根据患者的临床资料特征将患者分为存活组(5例)和死亡组(5例)。对2组患者的临床特点及介入封堵治疗疗效进行分析,并对介入封堵组中封堵成功的患者6及12月的心功能——6 min步行实验(6-minute walk test,6MWT)进行随访。
2 结 果
2.1一般资料 10例患者中,成功介入封堵6例,具体临床资料见表1。随访12月,存活5例;1例行封堵后12月因反复心力衰竭死亡;3例院内死亡患者,因严重心力衰竭、顽固心律失常、合并肺部感染分别死于发现穿孔后1,6,15 d;1例NYHA心功能Ⅱ级患者,因拒绝血运重建、封堵及外科修补治疗,12月后死于心力衰竭。
2.2PI-VSR封堵治疗结果 成功行介入封堵术的6例患者,介入封堵治疗距穿孔时间为(20.5±5.3)d(12~23 d),左心室造影均见巨大心尖部室壁瘤,3例为多发性穿孔,穿孔直径分别为6~18 mm,封堵器直径为10~24 mm,均有少-中量封堵器边上残余分流。封堵术后并发溶血2例,经治疗均在1周内恢复,复查超声心动图提示少量残余分流。2例封堵术后继续使用IABP至PCI血运重建。
2.3PI-VSR封堵治疗疗效及随访情况 封堵治疗的6例患者,术前、术后平均NYHA心功能评分分别为(3.43±0.55)及(2.58±0.62),LVEF分别为(40.0±5.3)%及(45.0±7.6)%,二者均有改善1 mmHg=133.3 Pa. pro-BNP:N末端B型脑钠肽前体; LVEF:左心室射血分数; IABP:主动脉内球囊反搏; VSR:室间隔穿孔; AMI:急性心肌梗死. 表中数据计量资料用中位数(最小值,最大值)表示,计数资料用构成比表示.
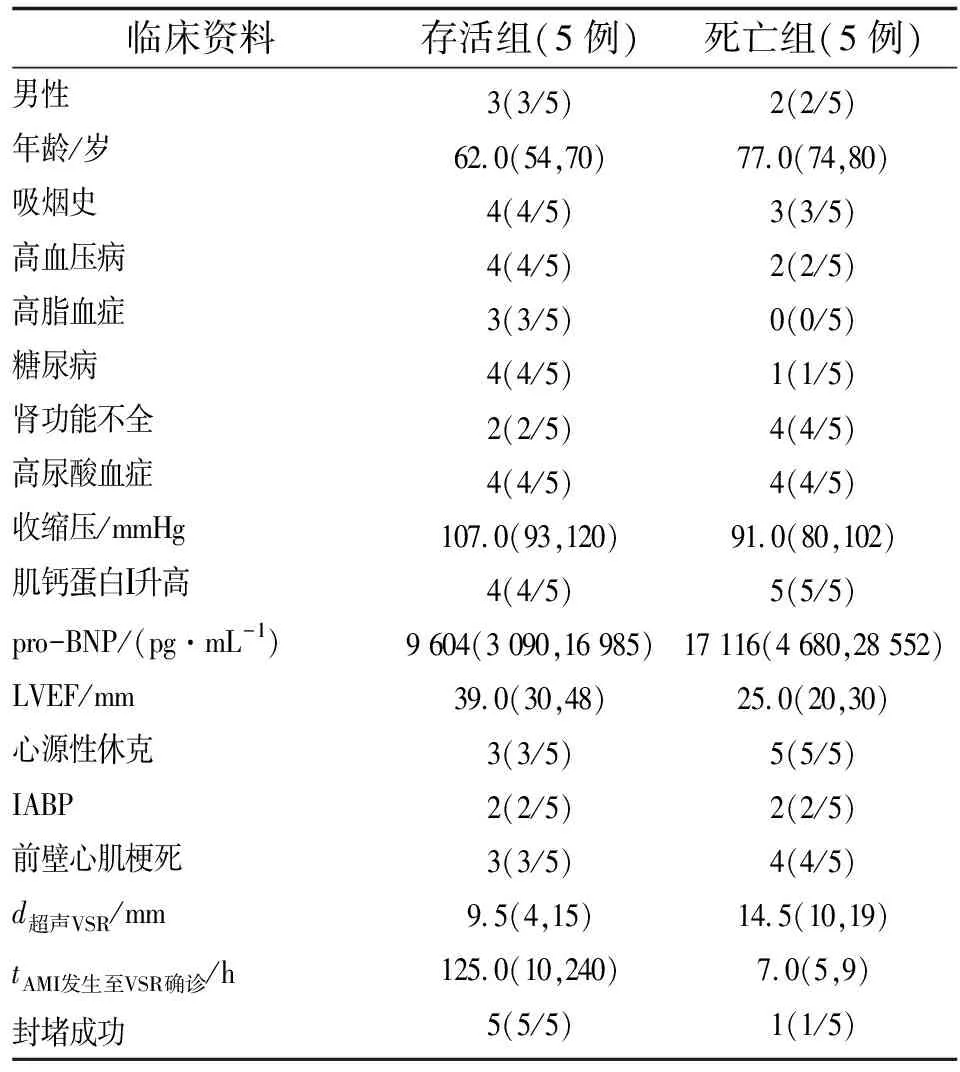
表1 2组患者临床资料比较
趋势,但差别均无统计学意义(均为P<0.05)。6例患者均行PCI血运重建,6,12月的6MWT分别为(368±55)及(403±58)m,活动耐量有逐渐改善趋势,但差别无统计学意义(P<0.05,表2)。1例行封堵后随访至12月时,因反复心力衰竭死亡。
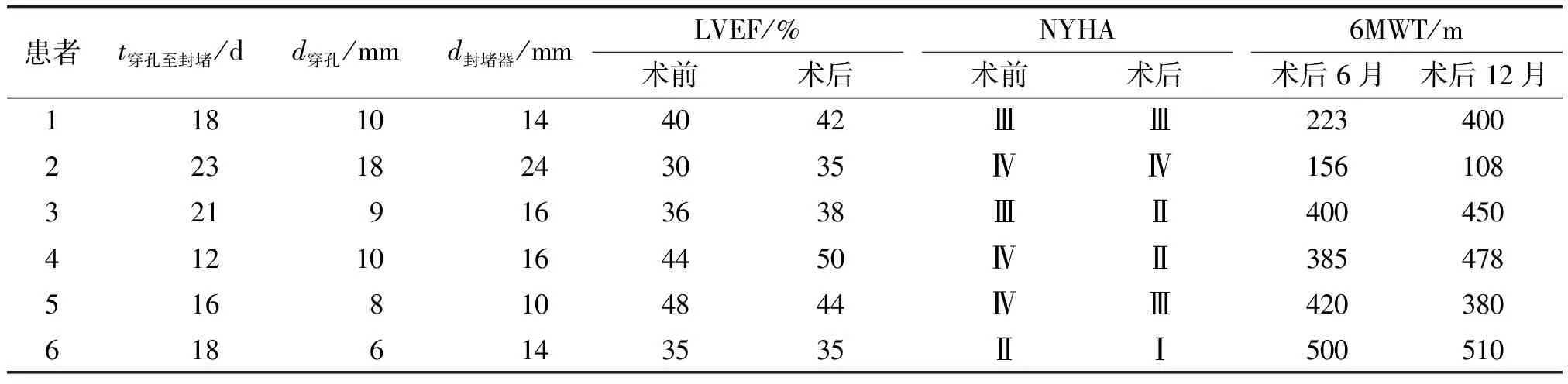
表2 PI-VSR患者封堵治疗情况
PI-VSR:心肌梗死后室间隔穿孔; LVEF:左心室射血分数; NYHA:美国纽约心脏病协会; 6MWT:6 min步行实验.
3 讨 论
PI-VSR是AMI后1周内具有较高死亡率的罕见机械性并发症之一,好发于高龄、女性、急性广泛前壁心肌梗死、未行缺血再灌注治疗、无心绞痛发作病史、伴有高血压及高脂血症、大量吸烟史的AMI患者[6]。临床表现多为急性左心衰竭或顽固性心源性休克,约24%死于确诊为PI-VSR后24 h内,46%在1周内死亡,67%~82%死于2月内,仅5%~7%患者存活期超过1年[7-8]。本研究中,死亡患者高龄、女性、高血压病史、高尿酸血症、合并肾功能不全及心源性休克系为穿孔高危因素,其死亡率与文献报道相似。本研究发现,与行介入封堵治疗存活患者比较,年龄愈大,AMI至VSR时间越短,LVEF低或pro-BNP高等指标所提示的心功能越差,VSR直径越大,其死亡风险呈增高趋势。
近年,经皮介入封堵术成为治疗PI-VSR的另一可选方法,已取得良好效果,或成为外科手术修补前的过渡方法[9]。目前,许多临床研究已证实,介入封堵术有效、安全,术后生存率甚至优于外科手术修补治疗方式[10]。本研究6例介入封堵患者,随访12月,除1例因多发穿孔、心肌梗死范围大且合并糖尿病及后期感染而反复心力衰竭死亡,余5例均存活,死亡率为16.7%(1/6)。存活病例中,初期仍有不同程度的心源性休克(3/5),需要IABP过渡治疗(2/5)。高存活率考虑与经皮导管介入封堵治疗手术时机选择恰当有关。有学者认为,穿孔边缘组织纤维化后较为坚固,有利于封堵器固定,故建议在穿孔后2~4周行介入封堵手术[11-12]。本研究患者介入封堵手术时机距穿孔时间为(20.5±5.3)d(12~23 d),术后随访,超声心动图提示封堵器边缘分流未见增多,甚至经过一定时间,术后出现的少-中量分流随着时间的延长而减少,从而快速纠正了血流动力学异常,为患者冠脉的血运重建及心功能的改善争取时间。
本研究提示,PI-VSR病情危重,若能及时发现,可在药物及IABP等的支持下,争取维持稳定的血流动力学2~4周后行介入封堵术。经皮介入封堵治疗策略安全可行,有改善PI-VSR患者心功能的趋势。本研究病例数较少,因此未来该项技术的发展尚需要多中心、规范化治疗,以及加强内外科治疗效果的对比研究。

