人群的自然和社会属性分类下PM2.5对心血管疾病的影响
龚天宜,孙兆彬,张小玲,王式功
人群的自然和社会属性分类下PM2.5对心血管疾病的影响
龚天宜1,2,孙兆彬2*,张小玲1,3**,王式功1,3
(1.成都信息工程大学大气科学学院,高原大气与环境四川省重点实验室,四川 成都 610225;2.中国气象局北京城市气象研究所,北京 100089;3.上海市气象与健康重点实验室,上海 200030)
为了研究人群在自然属性和社会属性分类下的效应修饰作用,利用2005~2011年北京市大气PM2.5日均浓度、气象要素及循环系统疾病每日死亡人数数据,根据不同年龄、性别及学历将人群分组,采用时间序列的半参数广义相加模型(GAM),定量评价大气PM2.5对居民循环系统疾病死亡人数的影响.单污染物模型和多污染物模型结果表明,PM2.5为影响循环系统疾病每日死亡人数的主要大气污染物.北京市空气中PM2.5的浓度每增加10μg/m3,循环系统疾病总死亡人数增加0.50% (95%CI: 0.36, 0.63).不同人群的易感程度不同,各人群死亡人数的增加范围为0.23~0.71%,女性、60~74岁人群、文盲人群的健康风险相对较高.在文盲人群中,老年(60+)女性占比为66.2%,为了分离社会属性人群分类中可能存在的自然属性因素干扰,本文去除其中老年、女性这两个混杂因素的影响,文盲人群健康风险仍然大于较高学历的人群.年龄和性别因素叠加在学历因素上,可能加大低学历人群的健康风险,对于这部分叠加了自然因素和社会因素双重敏感性的人群应给与重点关注.
不同人群;细颗粒物;心血管疾病;时间序列;效应修饰作用
近年来,北京的重度雾霾天气受到国际社会的高度关注,我国也积极出台强有力的治理措施,使得北京的PM2.5年均浓度从2013年的90μg/m3降至2017年的58μg/m3[1],但北京地区重污染频发这一现状仍未得到彻底解决[2].据学者估算,我国2010年大气环境中的PM2.5污染使得125万人过早死亡,比2000年高出了42%[3].现有的流行病学和毒理学研究显示,在大气污染物中,颗粒物污染的人群不良健康效应最为显著,且颗粒物粒径越小效应越强,会对人体心肺系统等造成诱发疾病、加重病情等众多不利影响[4-5].从20世纪90年代以来,国际上开始了对于颗粒物污染的人体健康急性和慢性影响的流行病学评估.应用时间序列和队列研究等方法,近年来我国研究人员对PM2.5污染的呼吸系统毒性、心血管系统毒性等方面的健康效应研究也有较为丰硕的成果[6-9].的易感人群是当今学界关注的热点.Bell等[10]通过对1995~2012年间发表的108篇相关文献进行meta分析,归纳出了国际上大致认可的颗粒物短期暴露与人群死亡或住院风险之间的关联及相关修饰效应结论.结果显示,有确凿证据证明年龄具有显著效应修饰作用,而性别的效应修饰作用证据不够显著,至于证明教育程度低、收入或就业状况较差人群具有较高风险这一论断的可信证据则更加缺乏.换而言之,从人的社会属性角度(学历、收入或就业状况)出发的研究,其结论的不确定性较大.由于缺少相关医疗数据,目前国内对于大气颗粒物健康效应的流行病学研究多集中于全人群范围[11-14].在我国南方地区,如Lin等[15]在珠江三角洲地区、复旦大学公共卫生学院的研究团队在广州[16]和上海[17]有过几个讨论不同分类人群易感程度的研究,但是中国南、北方城市的污染水平、排放源清单、颗粒物成分、人群结构都有所不同,关于北京市易感人群的研究仍有待开展.
基于此,本研究采用时间序列的半参数广义相加模型(GAM),探讨北京市大气PM2.5浓度对不同年龄、性别及学历人群的心血管疾病死亡人数的影响.并从学历(社会属性)因素中剥离年龄、性别(自然属性)因素的干扰,从而研究不同人群自然属性和社会属性之间的交互影响.研究结果将为保护易感人群提供依据, 也为城市大气污染物健康效应评价奠定基础,同时为北京地区大气污染防治措施和政策的制定提供直接的科学依据.
1 材料与方法
1.1 材料
本研究时段为2005年1月1日~2011年12月31日.每日大气污染物浓度均值数据包括PM2.5和气态污染物SO2、NO2,来源于宝联大气成分观测站,该站为城区站,附近无工业污染源,以居民和办公区为主,为北京市气象局所建设运行的准业务研究观测站,有专职人员负责日常仪器维护和数据质量控制,对北京市具有较好的区域代表性[18-19].PM2.5数据采自美国Rupprecht&Patashnick公司生产的TEOM1400a系列环境颗粒物监测仪,仪器原理是锥形元件振荡微量天平方法,可以连续测量大气中颗粒物的质量浓度.原始数据的采样及数据分析周期为5min,7a间PM2.5日均值缺失率为2%,未对缺测值进行处理.SO2数据采自EC9841型氮氧化物分析仪,采用化学发光法进行测量.NO2数据采自EC9850型二氧化硫分析仪,应用紫外荧光原理进行测量.
本研究的气象资料(包括气温、气压、风速、相对湿度和降雨量数据的日均值)来源于北京观象台(39°48¢N,116°28¢E),位于北京市东南五环.该站点为北京范围内的中国地面国际交换站,为国家基本气象站,所有获取的数据均经过国家气象信息中心严格的质量控制和检查.
本研究中所用到的疾病数据来自于中国疾病预防疾病控制中心(CDC)全国疾病监测系统死因监测数据集,覆盖了北京市2005年1月1日~2011年12月31日之间所有死亡人口.根据第十版国际疾病分类编码(ICD-10)对死因进行分类,心血管疾病资料共229223例.根据死者家庭住址地区编码,剔除非北京市居住的人群资料,以确保研究对象均来自当地的常居人口,再根据年龄(45~59、60~75、>75)、性别(男性、女性)及学历(文盲、小学、中学及以上)对全人群进行分组.由于2005年北京市居民死亡人口的受教育程度记录不全,本研究使用的学历分类数据的时间跨度为2006~2011年,其他组别的日死亡人数数据的时间跨度均为2005~2011年.
1.2 方法
本研究采用SPSS19.0统计软件进行统计描述和分析,采用R3.4.3软件中的“mgcv”软件包对数据进行建模和定量分析.相对于总人口而言,北京每天的循环系统疾病死亡人口属于小概率事件,其实际分布更近似Poisson分布.因此本研究将回归模型(Possion)引入半参数广义相加模型(GAM)[20]中,利用该模型来研究大气污染物的短期波动对循环系统疾病死亡率变化的急性影响.
首先,利用非参数平滑样条函数排除“星期几效应”、长期趋势等混杂因素的影响,根据AIC值最小原则,确定非参数平滑样条函数的自由度取值.气象因素也是需要排除的混杂因素之一,本研究分别引入气温、气压、相对湿度、风速到模型中,若某气象因子的引入没有使模型的AIC值降低,则弃用该气象因子,反之则保留.再将PM2.5日均浓度作为线性变量引入模型中,同心血管疾病每日死亡人数建立泊松广义相加模型.在建立模型的过程中,考虑到大气细颗粒物对心血管疾病每日死亡人数的滞后效应,对各污染物当日(lag0)及1~6d前浓度(lag1、lag2、……、lag6)分别建立GAM模型,同样采用AIC准则对模型进行检验,确定最佳滞后天数,选择最优模型进行暴露-反应关系分析.具体模型如下:
log[(Y)]=+DOW+´X+(time,df)+s(Z,df) (1)
式中:Y为第日的心血管疾病死亡人数;(Y)为第日的心血管疾病死亡人数的期望值;为截距;DOW代表处理“星期几效应”的虚拟函数;为暴露-反应关系系数;X为第日的PM2.5浓度;为非参数样条平滑函数;time为日历时间;df为自由度;Z为第日的某种气象要素.
在确定最优模型后,将PM2.5、SO2、NO2这3种污染物引入模型,目的是在检验单污染物模型敏感性的同时,分析多种污染物协同作用下大气污染物对居民健康造成的影响如何变化,由此确定研究期间影响心血管疾病每日死亡人数的主要危险因子.根据GAM模型估算出暴露-反应关系系数,计算当PM2.5变化单位浓度时,每日死亡人数的相对危险度(RR).本研究中, RR部分的单位浓度变化为污染物浓度的四分位间距(IQR). RR =EXP(IQR).在此基础上计算出RR的95%置信区间(95%CI)为:EXP[(±1.96SE)´IQR].污染物浓度每增加10mg/m3,心血管疾病日死亡人数变化的百分比为:
10/IQR´(RR-1)´100% (2)
按照上述原则和步骤,分别对不同年龄、性别、学历的各层次人群逐个建立模型,估算PM2.5对不同人群健康的影响.
为了探讨性别及年龄对污染物造成的健康风险的效应修饰作用,检验性别、年龄、学历的不同分层间是否存在显著性差别,采用下述公式计算两层间差别的95%CI[21].如果置信区间不包括0,说明两层间污染物效应的差别具有统计学意义.
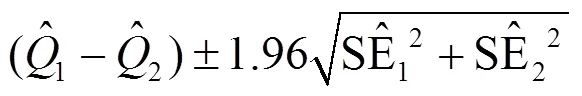
2 结果与分析
2.1 描述性分析
大气污染物、气象因素以及心血管疾病每日死亡人数的频数分布见表1.研究期间北京PM2.5、SO2和NO2的日均浓度分别为75.9,42.3和49.1μg/m3, PM2.5和NO2的浓度都超过了国家二级标准[22].平均温度为13.4℃,相对湿度为51.6%,平均风速为2.3m/s,平均气压为1012.5hPa,符合北京市暖温带半湿润半干旱季风气候的特征.
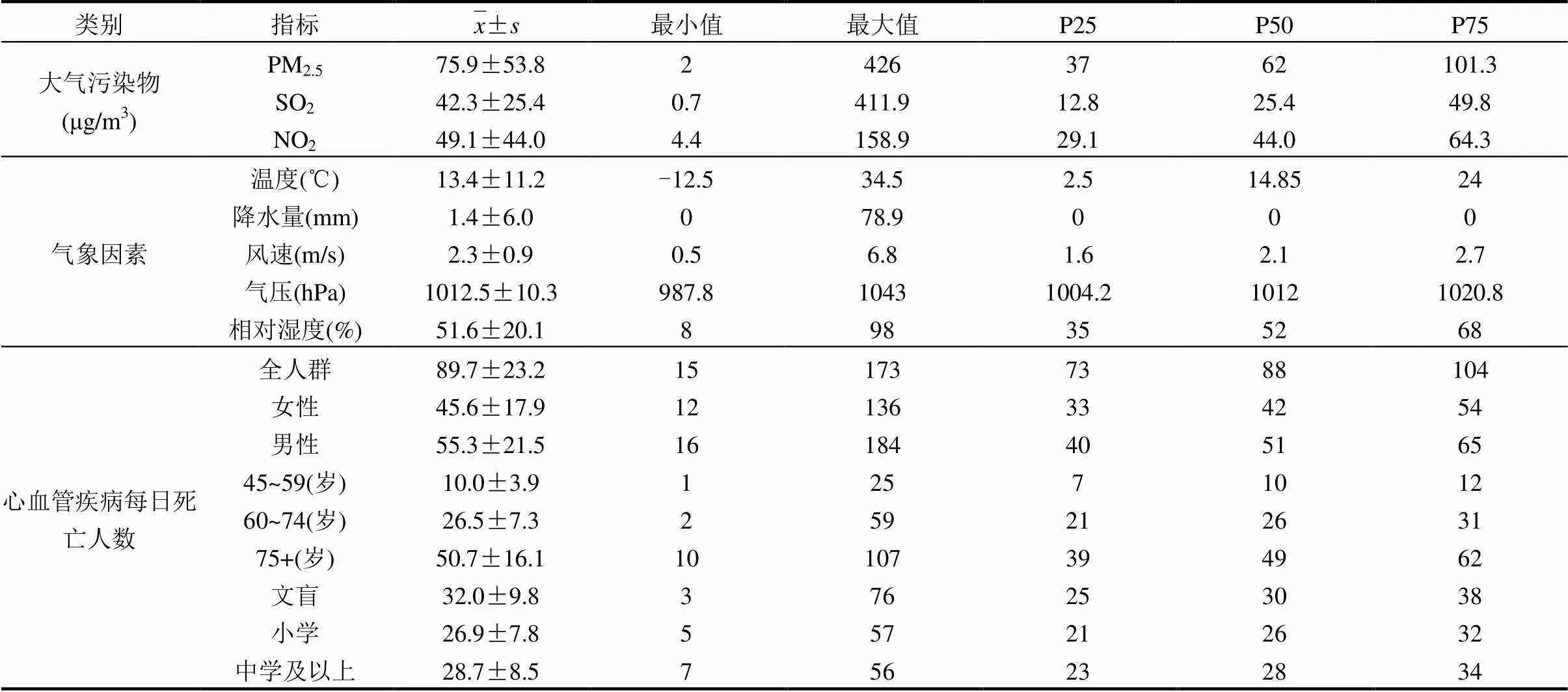
表1 北京市2005~2011年北京市心血管疾病每日死亡人数、空气污染物及气象因素描述性分析 Table 1 Descriptive statistics of daily environmental variables and cardiovascular mortality in Beijing, China, 2005~2011
对心血管疾病原始资料进行统计分析得知(表格未在文中展示),男性占比为54.7%,高于女性.从年龄来看,居民中45岁及以上者,即中年及老年死者占绝大多数,占比为97.2%.考虑到低年龄段死者对于研究细颗粒物的健康影响与学历的关系的干扰,及其对于学历背后可能折射的社会经济学现象的干扰,因此,在本文的年龄、学历两个群组中,仅使用45岁及以上死者的统计数据.参照文献[23],本研究对北京市45岁及以上人群按照45~59岁(中年)、60~74岁(老年前期)、75岁及以上(老年)3个年龄段人群进行分组研究.其中,45~59岁死亡者相对较少,数量和构成比分别为25479例、11.1%,60~74岁、75岁及以上死亡者构成比分别为29.5%、56.6%.其次,对2006~2011年45岁及以上死亡者按学历分成文盲、小学、中学及以上组,3组人数的数量级相当,构成比分别为39.1%、33.0%、27.9%.
2.2 单污染物模型拟合分析
2.2.1 PM2.5与心血管疾病死亡人数的暴露反应关系 图1表示PM2.5浓度每升高一个IQR单位(64μg/m3),心血管疾病的相对危险度(RR)及其在lag0~6的变化趋势,lag0~2的所有数据点都具有统计学意义.从当天到滞后6d,大部分数据组的相对危险度数值变化趋势有较好的一致性,都是先增加并在lag1处达到最大值再逐渐减小.全人群的RR最大值则出现在lag1(图1(a)),为1.032(95%置信区间(CI):1.023,1.041),这也意味着,北京地区大气中PM2.5的浓度每增加10μg/m3,心血管疾病总死亡人数增加0.50% (95%CI: 0.36, 0.63).值得一提的是,男性组的所有数据都通过了显著性检验,而此组的RR值在lag5~6时显示出轻微上升趋势.在所有人群分组中,最大的95%置信区间范围出现在中年组(45~59岁)(图1(b)).

图1 北京市不同人群PM2.5的相对危险度与滞后时间关系的单污染物模型分析结果 Fig.1 Estimated percentage increase in cardiovascular mortality (95% CI) and lag days structure for an IQR increase in PM2.5 using the single-pollutant models
2.2.2 人群的自然属性分组研究结果 本文从人群先天具有的自然属性的角度出发,探讨对于不同年龄、性别的人群而言,大气中PM2.5浓度与循环系统疾病死亡人数之间的联系.虽然组间的修饰效应差异并未通过显著性检验,但是从结果来看,各组在数值上的区别较为明显(表2).
关于性别的修饰作用,本研究发现心血管疾病的女性人群健康风险均高于男性.北京大气PM2.5浓度每升高10μg/m3,男性和女性的心血管疾病死亡人数升高的百分比分别为0.55%(95%CI:0.47,0.64)和0.49%(95%CI:0.37,0.64).关于年龄的修饰作用,研究结果显示,因PM2.5浓度升高而导致的心血管疾病超额死亡率(Excess Risk, ER)在两个老年人组(60~74, 75+)间的差别不大.大气PM2.5浓度每升高10μg/m3, 60~74岁和75岁以上人群的超额死亡率分别为0.63% (95%CI:0.48,0.78)和0.62%(95%CI:0.51, 0.73).与年长者相比,中年人(45~59岁)的超额死亡率为0.23%(95%CI:-0.01,0.47).
2.2.3 人群的社会属性分组研究结果 本文从人群后天获得的社会属性的角度出发,探讨对于不同学历人群,大气PM2.5浓度变化所引起的心血管疾病健康风险,试图从学历(社会属性)因素中剥离出其中掺杂的年龄、性别(自然属性)因素的干扰,从而研究不同人群自然属性和社会属性之间的交互影响.
首先,本文直接按照文盲、小学和中学及以上3个受教育程度级别对人群分组.结果显示,低学历人群的健康风险明显大于较高学历人群(表2).PM2.5浓度每升高10μg/m3,文盲、小学和中学及以上人群的循环系统疾病的超额死亡率分别为0.71%(95%CI: 0.54,0.88)、0.63%(95%CI:0.46,0.81)和0.47%(95%CI: 0.26,0.60).
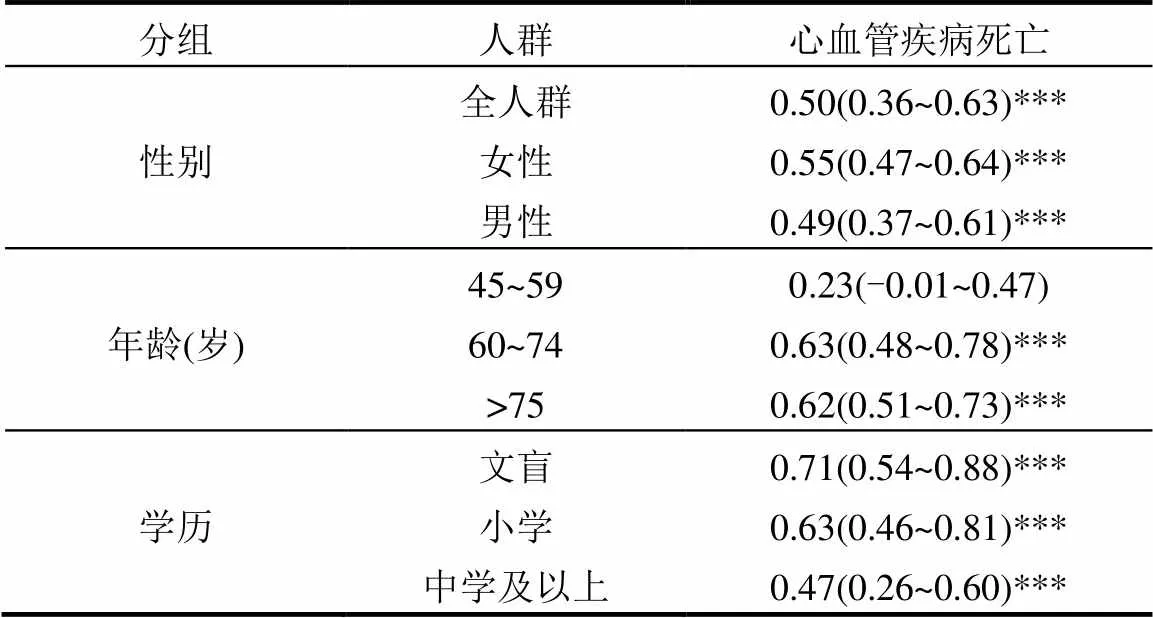
表2 PM2.5浓度每升高10μg/m3引起北京市居民心血管疾病每日死亡人数增加的百分比及95%CI Table 2 Estimated percentage increase in cardiovascular mortality (95% CI) for a 10μg/m3increase in PM2.5 in different subgroups
注:***表示<0.001.
然而,通过检视原始数据发现,不同年龄段、不同性别的学历人群结构的差异较为明显. 如表3所示,在75~89岁这一年龄段(显然全部都是1949年前出生),文盲、小学、中学及以上这3种学历级别的人群比例近似于5:3:2,其中,文盲的男女比例近似于3:7,中学及以上的男女比例近似于7:3. 其他年龄段的各个学历级别人群比例及其对应的男女比例差异也较大. 对于学历研究部分的原始数据中存在的明显年龄、性别差异,容易产生以下疑问:前文得出的随教育程度的升高健康风险明显降低这一结论是否会掺杂年龄、性别的影响.
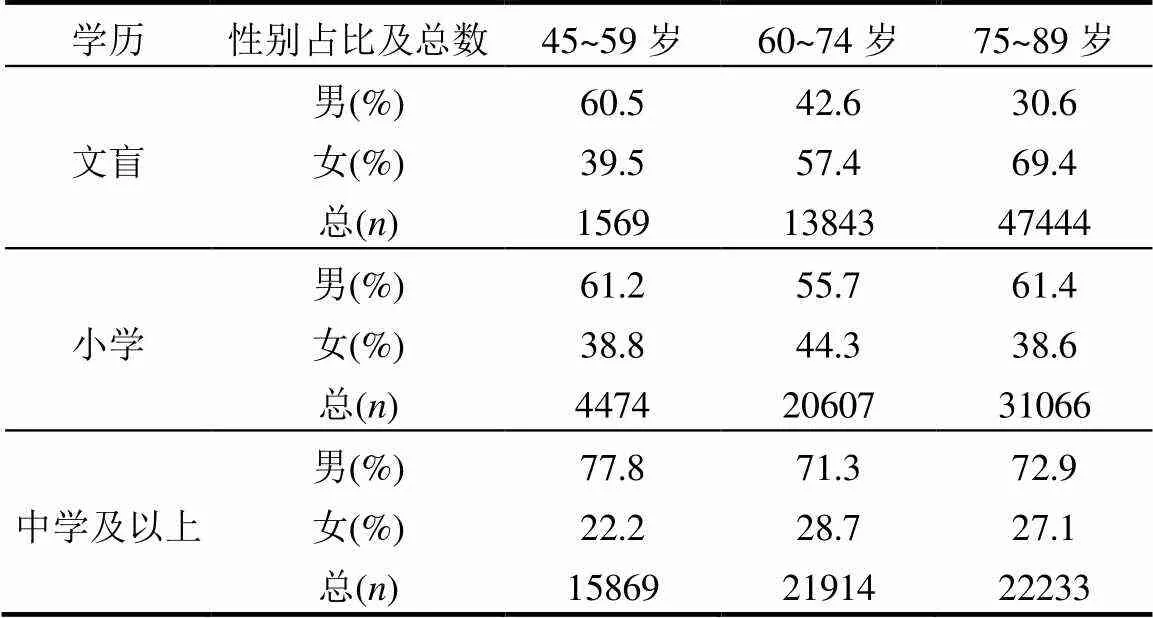
表3 不同年龄段、不同性别的学历人群结构 Table 3 Inhabitant structure of education attainment level in different age or sex groups
为了解决这一质疑,本文选取北京市2006~2011年循环系统疾病死者中的45~89岁人群(占循环系统疾病全人群的91.1%),进一步设计了2组实验开展更细致的分组研究.第一组实验,为了控制年龄这个可能的混杂因素,将45~89岁人群以15岁(研究时段长度的两倍)为跨度分为3大组,分别代表中年(多为1949年后出生)、老年前期、老年(均为1949年前出生)人群,在每个大组内按学历分为文盲、小学、中学及以上3个小组,第一组实验共计9个小组.第二组实验,为了控制性别这个可能的混杂因素,将45~89岁人群按上述学历分层划分为3大组,在每个大组内分成男、女2个小组,第二组实验共计6个小组.
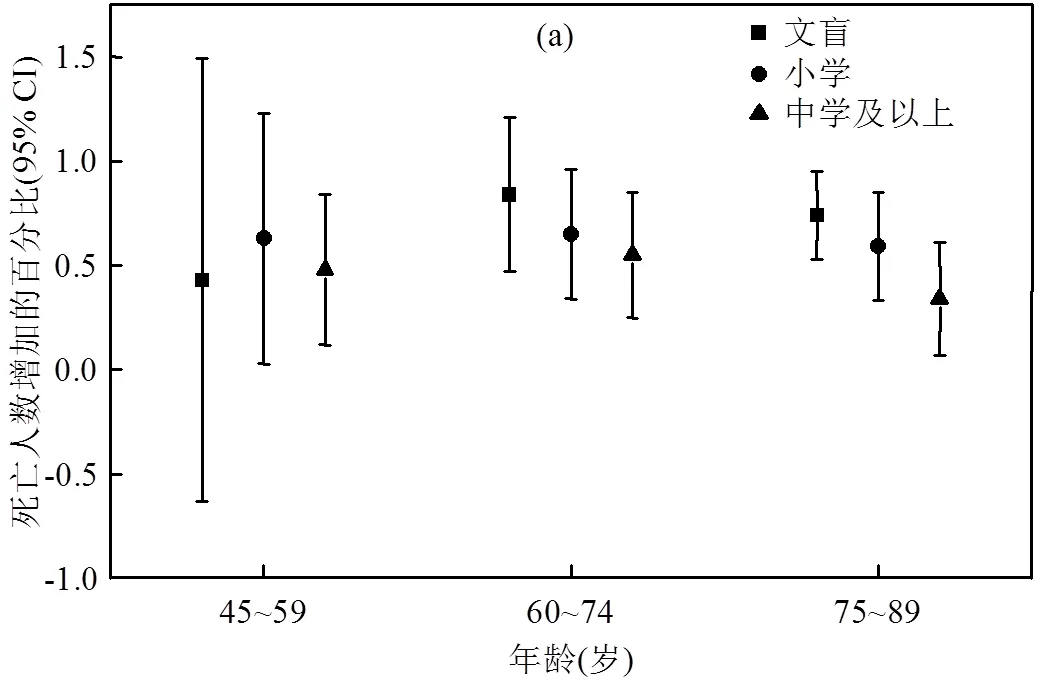
PM2.5浓度每增加10μg/m3,各小组的死亡人数增加百分比如图2所示,其中,除了45~59岁的文盲小组(该组样本数量最少,为1569例,其余组别的样本数量均超过4300例),其他15个小组的结果均通过了显著性检验(<0.001).第一组(图2(a)),45~59岁年龄段中文盲、小学和中学及以上人群的超额死亡率分别为0.43%(95%CI:-0.56,1.49)、0.63%(95%CI: 0.04,1.23)和0.48%(95%CI:0.13,0.84),60~74岁年龄段的分别为0.84%(95%CI:0.48,1.21)、0.65% (95%CI:0.34,0.96)和0.55%(95%CI:0.25,0.84),75~89岁年龄段的分别为0.74%(95%CI:0.53,0.94)、0.59% (95%CI:0.34,0.85)和0.34%(95%CI:0.07,0.61).结果显示,在同一个年龄段内,健康风险均随受教育程度的升高而降低,60~74岁年龄段的文盲、小学、中学及以上3组别的超额死亡率均大于前文中的粗略分组结果(0.71%、0.63%、0.47%).第二组(图2(b)),男性中文盲、小学和中学及以上人群的超额死亡率分别为0.62%(95%CI:0.40,0.84)、0.49%(95%CI:0.23, 0.75)和0.29%(95%CI:-0.02,0.61),女性的分别为0.68%(95%CI:0.41,0.95)、0.51%(95%CI:0.29,0.72)和0.37%(95%CI:0.18,0.56).结果显示,在同一种性别分组中,健康风险均随受教育程度的升高而降低.
2.3 多污染物模型拟合分析
为了检验模型的稳健性、考察PM2.5是否为影响心血管疾病每日死亡人数的主要大气污染物,研究中引入了气态污染物SO2、NO2,多污染模型各污染物的相对危险度见表4. PM2.5在 lag1有最大的滞后效应,SO2和NO2的最大滞后效应在lag0,所有数值均通过了显著性检验.对总人数来说,在单污染物模型中,PM2.5、SO2、NO2对应的RR值分别为1.032、1.021、1.017,PM2.5的最高,SO2高于NO2.在多污染物模型中,PM2.5、SO2、NO2对应的RR值分别为1.030、1.019、1.014,PM2.5的最高,其次是SO2,NO2最低.结果表明,当我们将PM2.5、SO2、NO2三种污染物一同引入模型中时,PM2.5的RR值较单污染模型有所降低但仍是最高的,它的相对危险度被SO2和NO2所共同分担,并且SO2分担较多.

表4 大气污染影响心血管疾病日死亡总人数的相对危险度及95%CI(多污染物模型) Table 4 Estimated percentage increase in cardiovascular mortality (95% CI) for an IQR increase in PM2.5using the multi-pollutant models
注:***表示<0.001,**表示<0.01.
3 讨论
为了探讨细颗粒物污染环境下是否存在心血管疾病死亡的易感人群,本研究从人先天具有的自然属性和后天获得的社会属性两个角度出发,对北京地区的不同年龄、性别及学历的人群进行了分层分析.结果表明,北京地区空气中的PM2.5的浓度每增加10μg/m3,心血管疾病总死亡人数增加0.50%,最佳滞后天数在lag1.综合PM2.5、SO2、NO2的多污染物模型结果来看,本文中的数学模型稳健性较高,PM2.5表现为影响心血管疾病每日死亡人数的主要污染物.不同人群的易感程度也有所不同,女性、60~74岁、文盲人群分别为3种分类下的易感人群,叠加了这3种特征的人群占总样本数量的4.4%.本研究发现,在去除了女性、老年这两个混杂因素影响后,文盲人群健康风险仍然高于较高学历人群,年龄和性别因素叠加在学历因素上,可能加大低学历人群的健康风险.
3.1 PM2.5与心血管疾病死亡人数的暴露反应关系
从全人群的角度而言,本研究与国内外使用同类方法得到的结果具有较好的一致性. Chen等人[24]在北京研究发现,当PM2.5每上升10μg/m3时,人群心血管系统疾病死亡人数百分比增加0.58%(95%CI: 0.35,0.81),本研究结果(0.50%(95%CI:0.36,0.63))与其高度一致.Kan等[25]在上海的研究发现,PM2.5每上升10μg/m3,心血管疾病死亡人数增加0.41%(95% CI:0.01%,0.82%). Franklin等[26]和Pelucchi等[27]对美国27个都市区、欧洲(meta分析)的研究分别发现,当PM2.5浓度每升高10μg/m3,心血管系统疾病每日死亡率分别上升0.94%(95%CI:-0.14%,2.02%)、1.11%(95%CI:1.06%,1.16%). Atkinson等[28]对2011年之前发表的110篇相关文献进行meta分析,发现PM2.5浓度每升高10μg/m3,世界范围内的人群非意外总死亡和心血管疾病死亡率分别增加1.04% (95%CI:0.52%,1.56%)和0.84%(95%CI:0.41%, 1.28%),并且观察到了显著的地区性差异.同国外研究结果相比,我国PM2.5污染水平较高但相对危险度普遍较低,国外PM2.5污染水平较低但相对危险度高[29-30].对于这种现象,有学者通过对北京地区人群健康的研究,发现大气颗粒物的健康效应风险存在关键污染浓度段,即人群对PM2.5在20~60μg/m3浓度范围内的浓度变化最敏感[31].
本研究中,细颗粒物对于循环系统疾病人群存在显著的健康效应,前人进行了很多人体生物学机制方面的探索[5,32-33].细颗粒物的粒径微小,可被吸入呼吸道的深处,进入细支气管和肺泡,并通过气血屏障进入体循环.在细胞中,细颗粒物可直接作为脂质和蛋白质的促氧化剂或作为自由基发生剂,促进氧化应激并诱导炎症反应.
3.2 人群的自然属性和社会属性分组研究
本研究探讨了人群的自然属性(性别、年龄)和社会属性(学历)对于PM2.5健康效应的修饰效应及相对易感人群.本文发现PM2.5对女性人群心血管疾病的健康影响大于男性,该结论与此前大部分关于成年人空气污染健康影响的性别修饰效应的研究结论较为一致.这种现象可能是由于两性的生理学和暴露模式的差异造成的,皮肤吸收、肺功能和吸入气体体积等生理特征及指标因性别而异,男性和女性在职业、活动模式、吸烟状况和社会经济地位方面也存在一定差异[34].研究发现,固体燃料、厨房油烟、家庭涂装等造成的室内污染对于女性的呼吸系统疾病发病率和死亡率有显著影响[35-36].然而,正如最近的一篇综述所言,不同国家、不同社会之间的性别差异体现方式有所不同,性别对空气污染存在效应修饰作用的原因也尚无定论[37],对此有待进行更深入的研究.
与其他研究类似,本研究发现PM2.5对老年人(>60)心血管疾病的健康影响大于年轻一些的人群[38-40].这可能与老年人在冠心病、高血压及其他心血管疾病上的较高发病率,以及人到老年心血管的功能退化有关[41].结果显示,健康风险在两个老年人组(60~74,75+)之间的差异不大,这与某些研究得出的更老的老年人的健康风险更高的结论不同[42],可能是因为研究地区及人群结构的差异.此外,由于中年组的样本数量较少,所以该组的95%置信区间范围较大.关于这些不确定性,接下来仍需进一步探索以找寻各年龄组之间更明显的差异及其可能的原因.
本研究发现,当PM2.5浓度升高时,较低学历人群所面临的心血管疾病的健康风险明显大于学历较高人群,从文盲、小学到中学及以上人群,随着教育程度的升高健康风险逐级降低.学界普遍认为,在流行病学研究中,受教育程度可以作为居民社会经济地位(SES)的替代指标[43].对此国际上已经做了一些研究,比如探讨在各个SES级别的群体中是否存在颗粒物污染的易感人群,但是研究结果不尽相同[44-45].曾有学者对中国南部的长江三角洲、珠江三角洲地区的一些城市进行了相关探索[15-17,25,38,40,46],对人群分两种受教育程度进行研究,发现较低学历人士的健康风险更高,但关于北京地区的更细致学历分类的研究还较为缺乏.本研究中学历较低人群对于空气污染健康风险的易感性,原因可能是低社会经济地位人群缺乏自身防护意识或可取的有效保护手段,他们的营养状况和卫生保健条件也较差[46].
本研究发现,对于2006~2011年间北京的死亡人口,在心血管分类下的文盲人群中(共计70734例)老年(>60)女性占66.2%.这种现象在全国普遍存在, 2010年中国人口普查资料[47]显示,关于文盲人口占15岁及以上人口比重,全国范围内的平均水平为4.88%,其中的男女比例近似于3:7;北京市则为1.89%,其中的男女比例近似于2:8.由于近百年尤其是中华人民共和国成立后(1949~)中国的快速发展,本研究中不同年龄段、不同性别的学历人群结构的变化较为明显,基于该现象,本文开始研究不同人群自然属性和社会属性之间交互影响.不同于先天自然属性因素人群分类所固有的相对独立的特性,后天社会属性因素人群分类中还可能掺杂自然因素(性别、年龄)影响,这也是从人的社会属性角度(学历、收入或就业状况)出发的前人研究难以获得效应修饰作用的显著证据的可能原因.因此,本文进一步设计了两组实验开展更细致的分组研究,希望通过组内对照的方式排除年龄、性别的干扰,从而得到学历对颗粒物健康效应可能造成的更为真实的影响.结果显示,在同一个年龄段内或同一种性别分组中,健康风险均随受教育程度的升高而降低,尤其是60~74岁年龄段的文盲、小学、中学及以上3个学历组别的超额死亡率均大于前文中的粗略分组结果.这表明,在剥离了年龄、性别这两个混杂因素的干扰之后,学历因素仍然表现为一个独立的因素,这就在一定程度上证明了它对于PM2.5的急性健康效应具有效应修饰作用,并且当年龄和性别因素叠加在学历因素上,可能加大低学历人群的健康风险.换而言之,当先天具有的自然型因素叠加在后天获得的社会型因素上时,可能加大受教育程度等社会型因素本身的效应修饰作用,这部分对应的叠加人群应得到重点关注.
3.3 局限性说明
本文也存在一定的局限性.首先,本研究估计总人口的暴露是用一个监测站点监测结果的均值代替.考虑到污染物浓度在城市各区域的非均匀分布,这可能会增加模拟结果的不确定性.其次,本文发现各组别的样本数量对于GAM模型的模拟结果存在一些影响,极个别组别的样本数量较少,其模拟结果的置信区间较大甚至未通过显著性检验,虽然本文通过调整分组设计缩小了一些组别间的样本数量差距,这还是可能对结果造成一定偏倚.第三,和发达国家相比,由于我国医疗数据的获取难度较大,本研究只是在一个城市,样本量和样本资料的多因素维度都受到影响,也无法排除个体的混杂因素如吸烟、饮酒、体重等对于空气污染健康效应估计结果的干扰.以上问题都给本研究的模拟结果增加了一些不确定性.
4 结论
4.1 PM2.5浓度升高对人体的心血管存在显著健康影响并具有滞后效应.北京地区大气中的PM2.5浓度每增加10μg/m3,心血管疾病总死亡人数增加0.50%,最显著滞后天数为1d. 综合PM2.5、SO2、NO2的多污染物模型结果来看,本文构建的数学模型稳健性较高,PM2.5表现为影响循环系统疾病每日死亡人数的主要大气污染物.
4.2 从人群先天自然因素(性别、年龄)和后天社会因素(学历)的角度分析,北京市大气PM2.5浓度每增加10μg/m3,女性、男性人群的心血管疾病日死亡人数分别增加0.55%、0.49%,45~59岁、60~74岁、75岁及以上人群分别增加0.23%、0.63%、0.62%,学历分别为文盲、小学、中学及以上人群分别增加0.71%、0.63%、0.47%,相对易感人群为女性、60~74岁、文盲人群.
4.3 在文盲群体中,老年(>60)女性占比达66.2%.本研究发现,在去除了女性、老年这两个混杂因素影响后,文盲人群健康风险仍然高于较高学历人群,年龄和性别因素叠加在学历因素上,可能加大低学历人群的健康风险,对于这部分叠加了自然因素和社会因素双重敏感性的人群应给与重点关注.
[1] 北京市环境状况公报 [EB/OL]. 北京市环保局, 2018. http: //www.bjepb.gov.cn/bjhrb/xxgk/ywdt/hjzlzk/hjzkgb65/index.html.Beijing Environmental Statement [EB/OL]. Beijing Municipal Environmental Protection Bureau, 2018.
[2] Sun Z, Zhang X, Zhao X, et al. Oscillation of Surface PM2.5, Concentration Resulting from an Alternation of Easterly and Southerly Winds in Beijing: Mechanisms and Implications [J]. Journal of Meteorological Research, 2018,32(2):288-301.
[3] Xie R, Sabel C E, Lu X, et al. Long-term trend and spatial pattern of PM2.5induced premature mortality in China [J]. Environment International, 2016,97:180.
[4] Kampa M, Castanas E. Human health effects of air pollution [J]. Environmental Pollution, 2008,151(2):362-367.
[5] Yang W, Omaye S. Air pollutants, oxidative stress and human health [J]. Mutation Research/genetic Toxicology & Environmental Mutagenesis, 2009,674(1/2):45-54.
[6] 程慧波,王乃昂,李晓红,等.兰州主城区大气颗粒物质量浓度及健康风险 [J]. 中国环境科学, 2018,38(1):348-360.Cheng H B, Wang N A, Li X H, et al. Mass concentration and health risk of atmospheric particulate matter in main urban district of Lanzhou [J]. China Environmental Science, 2018,38(1):348-360.
[7] 乐 满,王式功,谢佳君,等.环境条件对遵义市呼吸系统疾病的影响及预测研究 [J]. 中国环境科学, 2018,38(11):4334-4347.Yue M, Wang S G, Xie J J, et al. Study about the impact of environmental conditions on respiratory diseases and prediction in Zunyi City [J]. China Environmental Science, 2018,38(11):4334- 4347.
[8] 翁 俊,韦性富,聂永红,等.颗粒物污染对高血压门急诊就诊人数的影响-时间序列研究 [J]. 中国环境科学, 2018,38(7):2751-2757.Weng J, Wei X F, Nie Y H, et al. Time series study on the effect of air particulate pollution on emergency admissions for hypertension [J]. China Environmental Science, 2018,38(7):2751-2757.
[9] 杜鹏瑞,杜 睿,任伟珊.城市大气颗粒物毒性效应及机制的研究进展 [J]. 中国环境科学, 2016,36(9):2815-2827.Du P R, Du R, Ren W S. Research progress on toxicological characteristics and mechanisms of urban atmospheric particulate matters [J]. China Environmental Science, 2016,36(9):2815-2827.
[10] Bell M L, Zanobetti A, Dominici F. Evidence on Vulnerability and Susceptibility to Health Risks Associated With Short-Term Exposure to Particulate Matter: A Systematic Review and Meta-Analysis [J]. American Journal of Epidemiology, 2013,178(6):865-876.
[11] Aunan K, Pan X C. Exposure-response functions for health effects of ambient air pollution applicable for China – a meta-analysis [J]. Science of the Total Environment, 2004,329(1):3-16.
[12] Lu F, Xu D, Cheng Y, et al. Systematic review and meta-analysis of the adverse health effects of ambient PM2.5and PM10pollution in the Chinese population [J]. Environmental Research, 2015,136:196-204.
[13] Zhang M, Yu S, Cai X. A health-based assessment of particulate air pollution in urban areas of Beijing in 2000~2004 [J]. Science of the Total Environment, 2007,376(1):100-108.
[14] 张 莹,王式功,贾旭伟,等.气温与PM2.5协同作用对疾病急诊就诊人数的影响 [J]. 中国环境科学, 2017,37(8):3175-3182.Zhang Y, Wang S G, Jia X W, et al. Synergetic effect of mean temperature and PM2.5on emergency room visits for different diseases [J]. China Environmenal Science, 2017,37(8):3175-3182.
[15] Lin H, Liu T, Xiao J, et al. Mortality burden of ambient fine particulate air pollution in six Chinese cities: Results from the Pearl River Delta study [J]. Environment International, 2016,96:91-97.
[16] Yang C, Peng X, Huang W, et al. A time-stratified case-crossover study of fine particulate matter air pollution and mortality in Guangzhou, China [J]. International Archives of Occupational & Environmental Health, 2012,85(5):579.
[17] Kan H, London S J, Chen G, et al. Season, sex, age, and education as modifiers of the effects of outdoor air pollution on daily mortality in Shanghai, China: The Public Health and Air Pollution in Asia (PAPA) Study [J]. Environmental Health Perspectives, 2008,116(9):1183- 1188.
[18] 孙兆彬,安兴琴,崔甍甍,等.北京地区颗粒物健康效应研究——沙尘天气、非沙尘天气下颗粒物(PM2.5、PM10)对心血管疾病入院人次的影响 [J]. 中国环境科学, 2016,36(8):2536-2544. Sun Z B, An X Q, Cui M M, et al. The effect of PM2.5and PM10on cardiovascular and cerebrovascular diseases admission visitors in Beijing areas during dust weather, non-dust weather and haze pollution [J]. China Environmental Science, 2016,36(8):2536-2544.
[19] 孙兆彬,陶 燕,崔甍甍,等.北京地区奥运会期间PM2.5对心脑血管疾病的影响 [J]. 中国环境科学, 2015,35(11):3481-3488.Sun Z B, Tao Y, Cui M M, et al. The effect of PM2.5on cardiovascular and cerebrovascular diseases in Beijing areas during the Olympic Games [J]. China Environmental Science, 2015,35(11):3481-3488.
[20] Dominici F, Mc Dermott A,Zeger S L, et al. On the use of generalized additive models in time-series studies of air pollution and health [J]. Am J Epidemiol, 2002,56:193-203.
[21] Zeka A, Zanobetti A, Schwartz J. Individual-level modifiers of the effects of particulate matter on daily mortality [J]. American Journal of Epidemiology, 2006,163(9):849-59.
[22] GB 3095-2012 环境空气质量标准 [S]. GB 3095-2012 Ambient Air Quality Standards [S].
[23] Rosenthal F S, Carney J P, Olinger M L. Out-of-hospital cardiac arrest and airborne fine particulate matter: A case–crossover analysis of emergency medical services data in Indianapolis, Indiana [J]. Environ. Health Perspect., 2008,116(5):631-636.
[24] Chen R, Li Y, Ma Y, et al. Coarse particles and mortality in three Chinese cities: The China Air Pollution and Health Effects Study (CAPES) [J]. Science of the Total Environment, 2011,409(23):4934- 4938.
[25] Kan H, London S J, Chen G, et al. Differentiating the effects of fine and coarse particles on daily mortality in Shanghai, China [J]. Environment International, 2007,33(3):376-384.
[26] Franklin M, Ariana Z, Joel S. Association between PM2.5and all-cause and specific -cause mortality in 27 US communities [J]. Journal of Exposure Science and Environmental Epidemiology, 2007,17:279- 287.
[27] Pelucchi C, Eva N. Long-term particulate matter exposure and mortality: a review of European epidemiological studies [J]. BMC Public Health, 2009,9:453-460.
[28] Atkinson R W, Kang S, Anderson H R, et al. Epidemiological time series studies of PM2.5and daily mortality and hospital admissions: a systematic review and meta-analysis [J]. Thorax, 2015,25(2):208-214.
[29] 王德庆,王宝庆,白志鹏.PM2.5污染与居民每日死亡率关系的Meta分析 [J]. 环境与健康杂志, 2012,29(6):529-532.Wang D Q, Wang B Q, Bai Z P. Meta-analysis of association between air fine particular and daily mortality of residents [J]. Journal of Environment and Health, 2012,29(6):529-532.
[30] 谢 鹏,刘晓云,刘兆荣,等.我国人群大气颗粒物污染暴露-反应关系的研究 [J]. 中国环境科学, 2009,29(10):1034-1040.Xie P, Liu X Y, Liu Z R, et al. Exposure-response functions for health effects of ambient particulate matter pollution applicable for China [J]. China Environmental Science, 2009,29(10):1034-1040.
[31] 李 沛.北京市大气颗粒物污染对人群健康的危害风险研究 [D]. 兰州:兰州大学, 2016.Li P. Study on hazard risk of atmospheric particulate matter to the population health in Beijing [D]. Lanzhou:Lanzhou University, 2016.
[32] Lim S S, Vos T, Flaxman A D, et al. A comparative risk assessment of burden of disease and injury attributable to 67risk factors and risk factor clusters in 21regions, 1990~2010: a systematic analysis for the Global Burden of Disease Study 2010 [J]. Lancet, 2012,380(9859): 2224-2260.
[33] Song X, Wang S, Hu Y, et al. Impact of ambient temperature on morbidity and mortality: An overview of reviews [J]. Science of the Total Environment, 2017,586:241-254.
[34] Clougherty J E, Rossi C A, Lawrence J, et al. Chronic social stress and susceptibility to concentrated ambient fine particles in rats [J]. Environmental Health Perspectives, 2010,118(6):769-775.
[35] Smith K R, Bruce N, Balakrishnan K, et al. Millions dead: How do we know and what does it mean? Methods used in the comparative risk assessment of household air pollution [J]. Annu. Rev. Public Health, 2014,35(1):185-206.
[36] Bruce N, Dan P, Rehfuess E, et al. WHO indoor air quality guidelines on household fuel combustion: Strategy implications of new evidence on interventions and exposure–risk functions [J]. Atmospheric Environment, 2015,106:451-457.
[37] Clougherty J E, Eisen E A, Slade M D, et al. Gender and sex differences in job status and hypertension [J]. Occupational & Environmental Medicine, 2011,68(1):16-23.
[38] Chen R, Yin P, Meng X, et al. Fine particulate air pollution and daily mortality: A nationwide analysis in 272 Chinese cities [J]. American Journal of Respiratory & Critical Care Medicine, 2017,196(1):73.
[39] Franklin M, Zeka A, Schwartz J. Association between PM2.5and all-cause and specific-cause mortality in 27US communities [J]. Journal of Exposure Science & Environmental Epidemiology, 2007, 17(3):279.
[40] Ostro B, Broadwin R, Green S, et al. Fine particulate air pollution and mortality in nine California counties: results from CALFINE [J]. Environmental Health Perspectives, 2006,114(1):29-33.
[41] Li G, Xue M, Zeng Q, et al. Association between fine ambient particulate matter and daily total mortality: An analysis from 160communities of China [J]. Science of the Total Environment, 2017,599-600:108.
[42] Chen C, Zhu P, Lan L, et al. Short-term exposures to PM2.5and cause-specific mortality of cardiovascular health in China [J]. Environmental Research, 2018,161:188-194.
[43] Pope R C, Dockery D W. Health effects of fine particulate air pollution: lines that connect [J]. Journal of the Air & Waste Management Association, 2006,56(10):1368-1380.
[44] Zanobetti A, Schwartz J. Race, gender, and social status as modifiers of the effects of PM10on mortality [J]. Journal of Occupational & Environmental Medicine, 2000,42(5):469.
[45] Cakmak S, Dales R S. Do gender, education, and income modify the effect of air pollution gases on cardiac disease? [J]. Journal of Occupational & Environmental Medicine, 2006,48(1):89-94.
[46] Yang C, Peng X, Huang W, et al. A time-stratified case-crossover study of fine particulate matter air pollution and mortality in Guangzhou, China [J]. International Archives of Occupational & Environmental Health, 2012,85(5):579.
[47] 中国2010年人口普查资料 [M]. 北京:中国统计出版社, 2012:47-53.Tabulation of the 2010 population census of the People Republic of China [M]. Beijing: China Statistics Press, 2012:47-53.
致谢:本研究的疾病数据处理工作在京津冀环境气象预报预警中心李梓铭老师的协助和指导下完成,在此表示感谢!
Natural and social factor as modifiers of the effects of PM2.5on daily cardiovascular mortality in Beijing, China.
GONG Tian-yi1,2, SUN Zhao-bin2*, ZHANG Xiao-ling1,3**, WANG Shi-gong1,3
(1.Plateau Atmosphere and Environment Key Laboratory of Sichuan Province, School of Atmospheric Sciences, Chengdu University of Information Technology, Chengdu 610225, China;2.Institute of Urban Meteorology, China Meteorological Administration, Beijing 100089, China;3.Shanghai Key Laboratory of Meteorology and Health, Shanghai 200030, China)., 2019,39(3):1289~1298
To quantitatively analyze the modification effects of natural factor and social factor, people was classified by sex, age and education in our study. A semi-parametric generalized additive model (GAM) was used to calculate the exposure-response relationship between ambient particulate matter pollution and daily cardiovascular mortality from 2005 to 2011 in Beijing. The results of the single- and the multi-pollutant model indicated that PM2.5was the main air pollution health risk factor affecting the daily cardiovascular mortality. A 10μg/m3increase in PM2.5was associated with 0.50% (95%CI: 0.36, 0.63) increase for overall group. Different susceptibility showed in different subgroups, whose excess risks (ER) were range from 0.23%~0.71%. A much higher ER has been found in the subgroups of age 60~74years, female and illiterate. However, it showed that elderly (60+) women accounted for 66.2% among the illiterate. In order to isolate the possible interference of natural factors in the classification of social factor, distractions of elderly and female has been removed, but ER of illiterate were still greater than those with higher education attainment level. Adverse health effects of the lower education attainment level subgroup may be increase when the modification effects of age and sex are overlay on it. It is necessary to give priority attention to those people who have the dual susceptibility of both natural factor and social factor.
subgroups;fine particulates;cardiovascular disease;time series;modification effects
X503.1
A
1000-6923(2019)03-1289-10
龚天宜(1994-),女,湖南长沙人,成都信息工程大学硕士研究生,主要从事气象环境与健康研究.
2018-07-18
国家重点研发计划(2016YFA0602004);公益性行业(气象)专项(GYHY201206015)
* 责任作者, 副研究员, zbsun@ium.cn; ** 教授, xlzhang @ium.cn

