大肠杆菌外膜蛋白F的原核表达、多克隆抗体制备及生物信息学分析
伍娜娜,康 超,荣 娜,刘 祥,陈春琳,陈 琛,丁 锐,吴三桥
(1.陕西理工大学 生物科学与工程学院/中德天然产物研究所,陕西 汉中 723001;2.陕西省天麻山茱萸工程技术研究中心,陕西 汉中 723001)
大肠杆菌(Escherichiacoli,E.coli)属于革兰氏阴性短杆菌,是一种人畜共患的机会性病原菌,在一定条件下可引起人类的脑膜炎、腹泻、败血症[1-4],奶牛和奶山羊的乳房炎[5],以及鸡的肝周炎、心包炎、气囊炎和脐炎等疾病[6],不仅威胁人类健康,给养殖业造成严重的经济损失,还会对奶制品带来巨大的安全隐患。目前,大肠杆菌引起感染性疾病的主要治疗药物是抗生素[7],但大量使用抗生素会使细菌产生耐药性[8-9],因此迫切需要深入研究其耐药机制,并开发疫苗来防治大肠杆菌病[10]。
在致病性的大肠杆菌中,外膜蛋白是其产生致病性的主要因素[11]。大肠杆菌外膜蛋白F(Outer membrane protein F,OmpF)是由16个反平行β链和8个连接环形成的三聚体桶状结构[12-13],营养物质和抗生素大多经过此通道进出菌体。研究发现,OmpF蛋白的表达量差异可导致细胞膜的通透性改变,这与细菌的耐药性密切相关[14-16]。此外,OmpF蛋白具有高度免疫原性,WANG等[2]免疫小鼠后发现,大肠杆菌OmpF蛋白可激活小鼠机体免疫反应,产生特异性抗体,并能有效抵抗大肠杆菌侵染,可作为大肠杆菌病的候选疫苗。
本研究通过克隆大肠杆菌ompF基因,探究OmpF蛋白表达菌株最佳的表达条件及培养条件,将纯化后的OmpF蛋白免疫小鼠,制备小鼠OmpF多克隆抗体,然后通过Western blotting检测抗OmpF抗体的特异性,并借助生物信息学方法进行OmpF蛋白的系统进化关系分析,为进一步研究OmpF蛋白结构和功能提供基础。
1 材料和方法
1.1 试验材料
E.coliK12、E.coliDH5α和E.coliBL21菌株以及pET-32a质粒由陕西理工大学生物科学与工程学院生物化学与分子生物学实验室保存;Taq酶、T4-DNA连接酶、DNA Marker、限制性内切酶XhoⅠ与BamHⅠ购于TaKaRa公司;蛋白质Marker购于北京安诺伦生物科技有限公司;质粒提取试剂盒购于北京佰亿新创科技有限公司;DNA胶回收试剂盒购于杭州博日科技有限公司;引物合成和基因测序均由北京奥科鼎盛生物科技有限公司完成;昆明鼠购于西安交通大学医学部实验动物中心。
1.2 大肠杆菌ompF基因重组质粒构建
根据从NCBI数据库获得的E.coliK12菌株ompF基因序列(登录号:NC_000913.3),用Primer 5.0软件设计ompF基因引物,Primer 1:5′-TTCGGATCCATGATGAAGCGCAATATT-3′;Primer 2:5′-AGTCTCGAGTTAGAACTGGTAAACGAT-3′,分别在Primer 1和Primer 2两端加入限制性内切酶位点BamHⅠ和XhoⅠ(划线序列)与保护碱基。对目的基因ompF进行PCR扩增,反应程序:94 ℃预变性3 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸150 s,共35个循环;最后72 ℃充分延伸10 min,16 ℃保存。吸取2 μL的PCR产物于0.8%琼脂糖凝胶上进行电泳。用DNA胶回收试剂盒从琼脂糖凝胶中回收目的基因产物,双酶切后将回收的片段连接到pET-32a质粒载体,然后转化至E.coliDH5α中,重组质粒通过BamHⅠ及XhoⅠ限制性内切酶消化后,进行电泳分析,对阳性重组克隆进行测序,将测序正确的ompF重组质粒转入E.coliBL21菌株,构建ompF重组表达菌株。
1.3 大肠杆菌OmpF蛋白表达鉴定及纯化
将转入ompF重组质粒的E.coliBL21菌株置于5 mL的LB培养基中,37 ℃、200 r/min过夜培养,然后吸取500 μL转接至5 mL新鲜LB培养基中,继续培养3 h,添加终浓度为0.5 mmol/L的IPTG再诱导6 h,8 000 r/min、4 ℃离心5 min收集菌体,沸水浴煮样5 min后进行12%的SDS-PAGE电泳,对OmpF蛋白进行纯化。
1.4 大肠杆菌OmpF蛋白表达条件优化
为获得蛋白质最优的表达条件,用L9(34)正交试验模型[17],包括表达菌株的最优培养条件及蛋白质的最优诱导表达条件2种,因子与水平分别如表1和表2所示。

表2 大肠杆菌OmpF蛋白诱导条件正交试验因子与水平 Tab.2 The factor and level of orthogonal experiment for E.coli OmpF induction
OmpF表达菌株培养条件的正交试验过程:将OmpF表达菌株接入5 mL的LB液体培养基中,37 ℃、200 r/min摇床培养过夜,吸取1 mL培养后菌液转接入表1条件下所配置的新鲜培养液中,依据正交试验模型要求,培养OmpF表达菌株8 h后记录所得菌液的OD600值,并对数据进行方差和极差分析,获得菌株最佳培养条件。
表达菌株的蛋白质诱导条件正交试验过程:依据表达菌株最优的培养条件,将OmpF菌株接入新鲜LB液体培养基中,37 ℃、200 r/min快速培养菌液到表2条件下不同OD600值时,再依据正交试验模型要求,加入IPTG诱导OmpF蛋白的表达。吸取1 mL诱导一定时间后的菌液于10 000 r/min离心1 min,收集沉淀并加入300 μL的2×SDS Loading buffer彻底混匀,沸水中煮样5 min,上样量为10 μL,用SDS-PAGE对总蛋白进行分析。采用凝胶分析软件(Phoretix 1D)对电泳后得到的OmpF蛋白表达图谱进行光密度分析,并用SPSS 21.0软件进行不同因子的显著性分析[17]。
1.5 大肠杆菌OmpF蛋白多克隆抗体制备
选取体质量约20 g的昆明鼠作为供试小鼠。取100 μg弗氏完全佐剂乳化后的纯化重组蛋白对每只小鼠进行免疫,间隔14 d后,用相同剂量的抗原和弗氏不完全佐剂进行加强免疫,然后于间隔7 d后进行第2次加强免疫。于末次加强免疫7 d后,收集小鼠血液,进行血清分离,用于进行Western blotting[18]。
1.6 Western blotting对大肠杆菌OmpF蛋白多克隆抗体特异性的检测
以健康血清作为阴性对照,并将纯化后的重组OmpF蛋白经12%的SDS-PAGE凝胶电泳进行分离。在4 ℃下将凝胶上出现单一条带的蛋白质转移至硝酸纤维素膜上,将膜置于含有5%脱脂牛奶的1.5中制备的小鼠抗血清(1∶400稀释)TNT缓冲液中,于37 ℃温育1 h,然后用TNT缓冲液洗涤后,将膜置于山羊抗鼠二抗中,4 ℃孵育过夜,最后用TNT缓冲液清洗后使用DAB进行显色[19]。
1.7 大肠杆菌OmpF蛋白生物信息学分析
依据NCBI数据库中获取的氨基酸序列,利用DNAMAN 8.0软件对不同菌株OmpF蛋白序列进行同源性分析,利用MEGA 5.0软件构建系统发育树,通过String蛋白质相互作用预测网站http://www.string-db.org/,预测OmpF与其他蛋白质的互作关系网络。
2 结果与分析
2.1 大肠杆菌ompF基因重组质粒的构建
利用PCR扩增技术从E.coliK12基因组中扩增出1 089 bp的ompF基因产物(图1)。将其克隆到表达载体pET-32a中,构建pET-32a-ompF质粒,并利用限制性内切酶BamHⅠ和XhoⅠ对重组表达质粒pET-32a-ompF进行消化,得到约1 000 bp的条带,与目的基因大小一致(图2)。对阳性重组克隆进行测序,结果与NCBI数据库公布的ompF基因序列(GenBank:NC_000913.3)具有100%同源性。

M:DL2000 DNA Marker; 1:ompF基因M:DL2000 DNA Marker; 1:ompF gene图1 大肠杆菌ompF基因的PCR扩增Fig.1 PCR amplification of E.coli ompF gene

M:DL2000 DNA Marker; 1:pET-32a-ompF重组表达质粒; 2:pET-32a-ompF重组表达质粒经BamHⅠ和XhoⅠ双酶切M:DL2000 DNA Marker; 1:pET-32a-ompF plasmid; 2:pET-32a-ompF plasmid digested by BamHⅠ and XhoⅠ图2 pET-32a-ompF重组表达质粒的双酶切结果Fig.2 Identification of pET-32a-ompF recombinantplasmid by restriction enzyme analysis of BamHⅠ and XhoⅠ
2.2 大肠杆菌OmpF蛋白的表达与纯化
选用测序正确的重组克隆菌株,用IPTG诱导重组OmpF蛋白在E.coliBL21中表达时发现,诱导6 h时可获得OmpF蛋白的高表达,如图3所示,SDS-PAGE电泳分离获得分子质量约为58.4 ku的蛋白质条带,表达量和纯度均较高,包含理论分子质量约为38 ku的OmpF蛋白和20.4 ku的pET-32a质粒融合蛋白标签,然后用SDS-PAGE电泳切胶的方法,得到纯化的OmpF蛋白。

M:蛋白质分子标准质量; 1:未诱导菌株; 2:IPTG诱导菌株; 3:纯化的OmpF蛋白M:Protein marker; 1:Uninduced strain; 2:IPTG induced strain; 3:Purified OmpF protein图3 大肠杆菌OmpF蛋白的表达与纯化 Fig.3 Expression and purification of recombinant E.coli OmpF protein
2.3 大肠杆菌OmpF蛋白表达菌株的最适培养条件
对大肠杆菌OmpF蛋白表达菌株的培养条件进行正交试验探索,如表3所示获得OmpF蛋白菌株在600 nm处的OD值后,用SPSS 21.0对其进行极差分析显示,对OmpF蛋白表达菌株生长的影响由大到小为装液量>转速>葡萄糖浓度,以培养基的装液量为50 mL、葡萄糖浓度为0、摇床转速为230 r/min条件下,OmpF蛋白表达菌株的量最高(表4),表明该条件为OmpF蛋白的最佳表达条件。此外,方差分析结果表明,3个因子均达到极显著水平,表明这些因子对重组表达菌株的生长均起到重要作用(表5)。
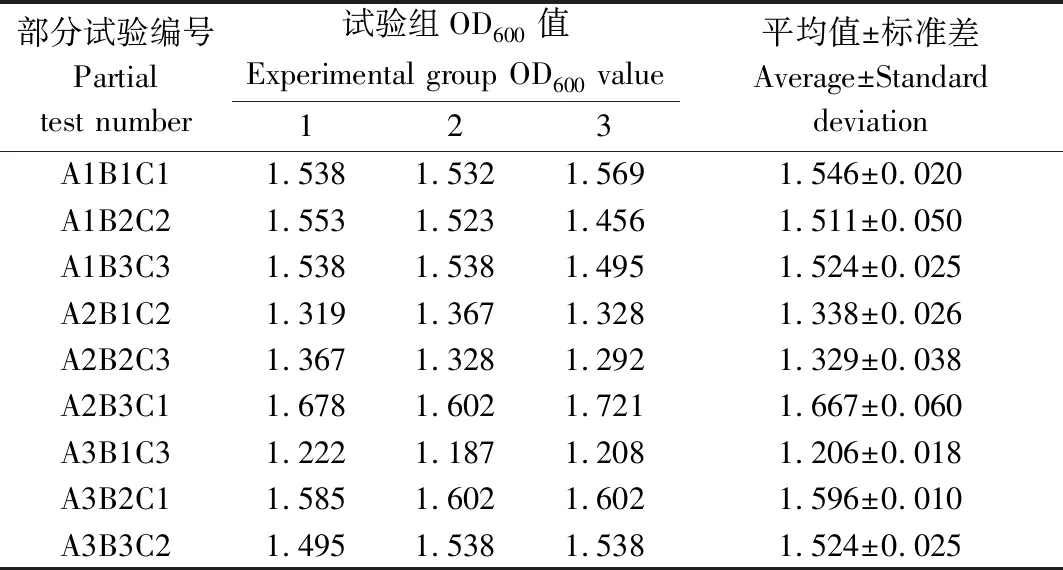
表3 大肠杆菌OmpF蛋白表达菌株的培养结果 Tab.3 The results of 3 experiment for culture of E.coliOmpF protein expressing strain
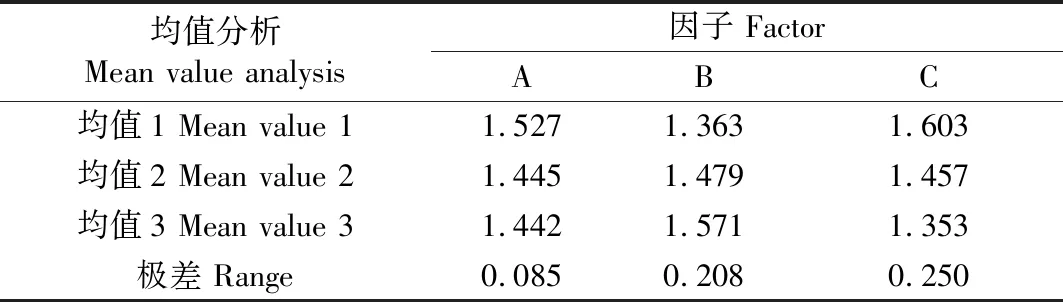
表4 大肠杆菌OmpF蛋白表达菌株培养条件的极差分析 Tab.4 The range results for culture condition of E.coli OmpF protein expressing strain

表5 大肠杆菌OmpF蛋白表达菌株培养条件的方差分析 Tab.5 The variance results for culture condition of E.coli OmpF protein expressing strain
注:**表示相对于对照组,达到了极显着水平(P<0.01),表8同。
Note:** means the difference with control group is significant (P<0.01).The same as Tab.8.
2.4 大肠杆菌OmpF蛋白表达菌株的诱导条件
如图4所示,将3次重复试验收集到的OmpF蛋白表达菌株进行SDS-PAGE电泳表明,不同诱导条件下的OmpF蛋白表达量存在差异。如表6所示,对电泳图谱蛋白条带进行光密度值分析表明,相同诱导条件下的OmpF蛋白表达量值重复性较高。对光密度值进行极差分析表明,在添加IPTG诱导菌体后,当菌液OD600为0.5时,添加终浓度为0.1 mmol/L的IPTG,于28 ℃诱导8 h,OmpF蛋白的表达量最高,且在4个影响因子中,诱导时间对OmpF蛋白表达的影响最大,其次为诱导温度,再次是IPTG诱导菌液OD600值,最后为IPTG浓度(表7)。此外,方差分析结果显示,添加IPTG诱导时的诱导温度及诱导时间对OmpF蛋白表达的影响达到极显著水平(表8)。

M:蛋白质分子质量标准;1:阴性对照;2—4:OD600值为0.5时,诱导温度分别为28、32、37 ℃;5—7:OD600值为0.8时,诱导温度分别为28、32、37 ℃;8—10:OD600值为1.0时,诱导温度分别为28、32、37 ℃M:Protein marker; 1:Negative control; 2—4:OD600 value of 0.5,inducing temperatures were 28,32,37 ℃, respectively; 5—7:OD600 value of 0.8,inducing temperatures were 28,32,37 ℃,respectively; 8—10:OD600 value of 1.0,inducing temperature were 28,32,37 ℃,respectively图4 正交试验获得的大肠杆菌OmpF蛋白SDS-PAGE电泳图谱Fig.4 SDS-PAGE analysis of E.coli OmpFprotein from orthogonal experiment

部分试验编号Partial Test number试验组光密度(×106)Experimental group optical density value123均值±标准差(×106)Average±Standard deviationE1F1G1H11.0441.3551.1171.172±0.163E1F2G2H21.2051.4161.8241.482±0.315E1F3G3H31.3790.9791.2691.209±0.207E2F1G2H31.1961.1221.2271.182±0.054E2F2G3H11.3121.2311.5421.362±0.161E2F3G1H20.8330.5690.9240.775±0.184E3F1G3H21.4441.2761.4381.386±0.095E3F2G1H30.6060.9660.6880.753±0.189E3F3G2H11.5161.4981.4951.503±0.011
2.5 Western blotting检测大肠杆菌OmpF蛋白多克隆抗体的特异性
如图5所示,纯化的OmpF蛋白多克隆抗体通过免疫印迹反应产生单一且清晰的条带,表明获得的OmpF蛋白多克隆抗体具有高度特异性。
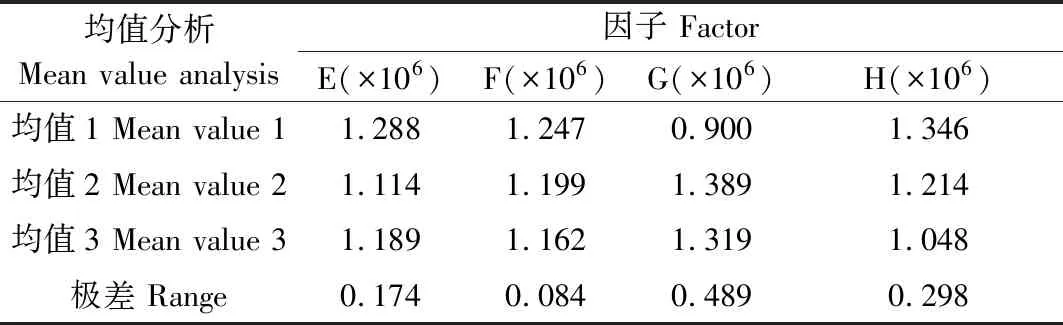
表7 大肠杆菌OmpF蛋白表达图数据的极差分析Tab.7 The range results of E.coli OmpFprotein expressing map data

表8 大肠杆菌OmpF蛋白表达图数据的方差分析Tab.8 The variance results of E.coli OmpFprotein expressing map data

1:阴性对照(1∶400倍稀释的血清);2:1∶400倍稀释的抗血清1:Negative control (dilution proportion of antibodies was 1∶400); 2:Dilution proportion of antibodies was 1∶400图5 Western blotting检测大肠杆菌OmpF蛋白多克隆抗体的特异性Fig.5 Identification of the specificity of E.coli OmpFpolyclonal antibodies by Western blotting
2.6 大肠杆菌OmpF蛋白进化关系分析
如图6所示,用DNAMAN 8.0软件对12种致病菌的OmpF蛋白序列进行比对表明,曼氏假单胞菌、恶臭假单胞菌和嗜水气单胞菌这3种细菌具有最高的同源性;除去这3种菌,其他细菌也具有较高的同源性,可能是由于OmpF蛋白的功能在这些细菌中具有相似性。如图7所示,通过MEGA 5.0软件构建系统进化树显示,大肠杆菌与沙门氏菌、肺炎克雷伯菌、黏质沙雷氏菌存在较近的亲缘关系,其产生的特异性抗体,可能对亲缘关系较近细菌的感染存在交叉免疫保护作用。

图6 大肠杆菌OmpF蛋白氨基酸序列同源性分析Fig.6 Homology analysis for amino acid sequence of E.coli OmpF

图7 MEGA 5.0软件构建的大肠杆菌OmpF氨基酸序列系统进化树Fig.7 Phylogentic tree based on E.coli OmpF amino acid sequences by MEGA 5.0
2.7 大肠杆菌OmpF蛋白作用网络分析
如图8所示,通过String方法对大肠杆菌OmpF蛋白进行预测可知,大肠杆菌OmpF蛋白与10种蛋白质存在相互作用,其中tut蛋白、lamB蛋白、tsx蛋白与OmpF蛋白作用更为紧密。

图8 大肠杆菌OmpF相互作用蛋白质预测Fig.8 Protein-protein interaction prediction of E.coli OmpF protein
3 结论与讨论
致病性大肠杆菌可分为肠致病性、肠产毒性、肠侵袭性、肠出血性、肠黏附性和弥散黏附性大肠杆菌,是临床感染中的主要病原体[20]。目前,临床上主要采用抗生素防治大肠杆菌病,但极易出现耐药性。对大肠杆菌引起的疾病尚无理想的疫苗来预防,开发蛋白质疫苗并研究其耐药机制是预防和控制大肠杆菌病的最有效途径之一[10]。
多克隆抗体以其成本低、周期短及效果好而应用广泛[21],且使用原核表达蛋白免疫小鼠制备多克隆抗体是最为常见的方法之一[22]。本研究利用纯化蛋白制备了特异性较好的大肠杆菌OmpF蛋白多克隆抗体,为研究大肠杆菌OmpF蛋白的生物学功能与相关疫苗开发提供了良好的生物学基础材料。
本研究探索了大肠杆菌OmpF蛋白菌株的培养条件和表达条件。结果表明,在未诱导时,培养基装液量为50 mL,不添加葡萄糖,摇床转速230 r/min时菌株表达水平最高;培养基中添加IPTG诱导时,菌液OD600为0.5,添加0.1 mmol/L的IPTG,诱导时间和诱导温度分别为8 h和28 ℃时,OmpF蛋白表达量最高。研究发现,转速较高或装液量较小,培养基中的溶氧浓度较大,有利于菌的生长[17]。此外,当菌体处于对数生长中期,菌体活性较高,生长代谢能力强,蛋白质合成旺盛[23],此时加入IPTG诱导利于大量表达OmpF蛋白,与本试验在600 nm波长处吸光度为0.5时添加IPTG结果一致。IPTG对细菌有毒性,高浓度的IPTG会影响细菌的生长和蛋白质的表达[24],本研究进一步证实添加低浓度的IPTG,利于OmpF蛋白的表达。有研究发现,降低菌体的生长温度,利于活性蛋白的表达,可有效减少不溶性包涵体的形成[25]。本研究也发现低温利于OmpF蛋白的表达。适度的诱导时间,不仅更有利于融合蛋白的表达[26-27],而且降低了成本,这与本研究结果一致。本研究为大量获得OmpF蛋白用于其功能研究奠定了基础。
此外,本研究发现多种细菌OmpF蛋白具较高的同源性,表明这些种类细菌中OmpF蛋白参与的抗生素耐药机制可能相近;OmpF蛋白产生的抗体,可能为多种细菌感染提供交叉免疫保护作用,从而实现单次免疫OmpF蛋白同时抵御不同种细菌的感染,为开发广谱抑菌的OmpF蛋白疫苗制剂提供了依据。

