外源添加物质对黑莓清汁花色苷 稳定性和抗氧化活性的影响
, ,,, ,,*
(1.江苏省农业科学院农产品加工研究所,江苏南京 210014; 2.江苏惠田农业科技开发有限公司,江苏扬州 211414)
花色苷在食品加工过程中,易受温度、pH、浓度、光、氧气、金属离子、酶以及自身结构等因素的影响,导致色泽不稳定、产品风味改变等[1-3]。提高花色苷的稳定性是提高花色苷产品质量的有效方法之一。近年来,基于其分子结构和呈色特性的辅色作用成为花色苷稳态化研究的热点。在花色苷产品加工过程中,通过添加有机酸、黄酮、生物碱、多糖、蛋白等物质,不仅可以大幅提升花色苷的稳定性,而且可以改变花色苷的生物活性[4-6]。
黑莓富含花色苷,其花色苷类型包括矢车菊-3-O-葡萄糖苷,矢车菊-3-O-阿拉伯糖苷、矢车菊-3-O-木糖苷,矢车菊-3-O-丙二酸酸葡萄糖苷等,其中矢车菊-3-O-葡萄糖苷的含量高达80%以上[7]。黑莓花色苷在食品中的加工稳定性也受到研究者的关注。彭常安等[8]研究表明,向黑莓汁中添加咖啡酸和阿魏酸,能够显著增加花色苷的最大吸收值,最大吸收波长红移,产生了辅色作用。张丽霞等[9]研究表明,草酸、苹果酸和丙二酸等有机酸对黑莓花色苷具有辅色作用,可以显著提高花色苷的热稳定性,降低黑莓花色苷色泽的降解速率。可见,有机酸对黑莓花色苷辅色效果明显。黑莓果汁在加工、贮藏过程中存在色变、沉淀、浑浊等问题,影响果汁品质。花色苷的降解、聚合反应等是引起这些变化的主要原因。因此,对黑莓果汁中花色苷进行辅色稳定化,不仅可以提高果汁的稳定性,而且可能会产生提高活性的协同效应。
为此,本文系统研究了咖啡酸、阿魏酸、单宁酸、黄芩素、茶多酚、没食子酸、原儿茶酸、芦丁等8种外源添加物质(辅色素)对黑莓清汁花色苷辅色效果的影响,并进一步研究了不同辅色素下黑莓清汁花色苷的光热稳定性、抗氧化活性变化规律,以期为黑莓花色苷产品的稳态化加工提供参考依据。
1 材料与方法
1.1 材料与仪器
黑莓(赫尔,Hull) 颗粒饱满多汁,色泽黑红,-20 ℃保存,江苏惠田农业科技开发有限公司;乙醇、柠檬酸、盐酸、磷酸氢二钠、磷酸二氢钠、氯化钾、氢氧化钠、冰乙酸 分析纯,国药集团化学试剂有限公司;咖啡酸、阿魏酸、单宁酸、黄芩素、茶多酚、没食子酸、原儿茶酸、芦丁等试剂(纯度大于95%) 上海源叶生物科技有限公司;果胶酶(6×104U/g)、果浆酶(4×104U/g) 宁夏夏盛实业集团有限公司。
KQ-2500E型超声波清洗器 昆山禾创仪器有限公司;UV-3802H 紫外可见分光光度仪 上海尤尼柯仪器有限公司;真空冷冻干燥机 上海比朗仪器制造有限公司;WSC-S测色色差计 上海精科科学仪器有限公司;pH酸度计 梅特勒-托利多等。
1.2 实验方法
1.2.1 黑莓清汁的制备 按照文献[10]方法,并做适当调整。将冷冻保存的黑莓在4 ℃解冻10 h,然后将其置于盛有沸水的箅子之上,蒸汽热烫3 min,冷却后匀浆,得到黑莓浆。果胶酶和果浆酶以1∶1比例组成复合酶,并按照质量比0.3%加入到黑莓浆中,在超声200 W、45 ℃条件下酶解反应2 h,酶解结束后,加热到90 ℃灭酶5 min,冷却,在5000 r/min离心10 min,取上清为黑莓清汁。
1.2.2 不同辅色素对黑莓清汁花色苷辅色效果的影响 取2.0 mL黑莓清汁(1.5 mmol/L)于试管中,分别加入1.0 mmol/L的咖啡酸、阿魏酸、单宁酸、黄芩素、茶多酚、没食子酸、原儿茶酸、芦丁的乙醇(50%)溶液1.0 mL,用pH3.0柠檬酸-柠檬酸钠缓冲液定容至10 mL,涡旋混匀,并在90 ℃温度下处理10 min,冷却避光静置一周。以不加辅色素的果汁样品为对照。样品分别在400~600 nm范围内进行可见吸收光谱扫描,记录最大吸收波长(λmax)和最大吸光度值(Amax),辅色效果的评价以每mol辅色素物质引起的黑莓清汁花色苷吸光值增加量I表示[11]。
I=(A-A0)/C
式(1)
式中:A为加入辅色后黑莓清汁花色苷的吸光值;A0为对照黑莓清汁花色苷溶液的吸光值;C 为添加的辅色素浓度(mmol/L)。
1.2.3 不同辅色素浓度对黑莓清汁花色苷辅色效果的影响 按照1.2.2方法,配制黑莓清汁(0.5 mmol/L)与辅色素的混合溶液,辅色素的终浓度分别为0.01、0.05、0.08、0.1、0.2、0.4、0.6、0.8、1.0、1.2 mmol/L,混合液在90 ℃温度下处理10 min,避光静置一周。以不加辅色素的黑莓清汁样品为对照。样品分别在400~600 nm范围可见吸收光谱扫描,记录最大吸收波长(λmax)和最大吸光度值(Amax),辅色效果的评价以I表示。计算方法如式(1)。
1.2.4 辅色素对黑莓清汁花色苷热稳定性的影响 将黑莓清汁(0.5 mmol/L)和添加0.1 mmol/L辅色素的清汁(pH3.0)样品分别置于50、60和70 ℃恒温水浴中6 h,每隔2 h测定A520值,计算热降解反应速率常数(k)、热降解活化能(Ea)、热降解半衰期(t1/2)和热降解率(P)。根据Arrhenius方程计算k和Ea值[11-12]:
ln(C/C0)=-kt
式(2)
lnk=lnk0-Ea/RT
式(3)
式中:C为黑莓清汁花色苷加热后的浓度(mmol/L);C0为黑莓清汁花色苷的初始浓度(mmol/L);t为反应时间(min);k0为频率常数;R为气体常数(8.314×10-3kJ·mol-1·K-1);T为绝对温度(K)。根据朗伯比尔定律,溶液的吸光值A与其浓度C成正比,故(2)式可表示为ln(A/A0)=-kt。
热降解半衰期t1/2=-ln(1/2k)
式(4)
热降解率P=(1-A/A0)×100
式(5)
1.2.5 辅色素对黑莓清汁花色苷光稳定性的影响 将黑莓清汁(0.5 mmol/L)和添加0.1 mmol/L辅色素的黑莓清汁(pH3.0)置于25 ℃、自然光下10 d,每隔1 d取样,测定样品在520 nm下的吸光值。根据式(2)、(3)和(4)计算k和t1/2。
1.2.6 辅色素对黑莓清汁花色苷清除自由基能力的影响 考察分子辅色素对黑莓清汁花色苷的1,1-diphenyl-2-picrylhydrazyl(DPPH)自由基清除能力的影响。参照Shimada方法[13],分别取黑莓清汁(0.5 mmol/L)及添加不同辅色素(0.1 mmol/L)的黑莓清汁8.0 mL加入2.0 mL 0.2 mmol/L DPPH甲醇溶液,混匀,于避光条件下静置30 min,测定波长515 nm下的OD值。每个样品平行测定3次。根据公式(6)计算花色苷对DPPH自由基的清除率:
DPPH自由基清除率(100%)=[(A0-A1)/A0]×100
式(6)
式中:A0为DPPH的OD值(空白对照),A1为含有样品的DPPH溶液的OD值。
1.2.7 辅色素对黑莓清汁花色苷还原力的影响 总还原力的测定是根据Oyaizu的经典方法关于Fe3+的还原法[14]。分别取1.0 mL 0.8 mg/mL的黑莓清汁及加有0.1 mmol/L辅色素的黑莓清汁,加入2.5 mL 0.2 mol/L磷酸缓冲液(pH6.6),2.5 mL KFe(CN)4(1.0%)溶液,摇匀后在50 ℃下孵化20 min,迅速添加10%的三氯乙酸2.5 mL,加入2.5 mL倍数的体积样品溶液与0.5 mL FeCl3(0.1%),混合均匀,在700 nm下测定吸光度,每个样品平行测定3次,取其平均值。
1.3 数据处理
采用SPSS 20.0软件对实验数据进行分析。所有实验进行3次重复,结果以平均值±标准差表示,实验数据采用单向方差分析法进行检验,数据之间的差异显著性则利用多重比较法进行判断,p<0.05为差异显著。
2 结果与分析
2.1 辅色素对黑莓清汁花色苷最大吸收波长和吸光值的影响
不同辅色素对黑莓清汁花色苷最大吸收波长和吸光值的影响如表1所示。从表中可以看出,在不同辅色素下,花色苷的最大吸收波长均发生了红移,其中添加阿魏酸对黑莓清汁花色苷的波长影响最明显,发生红移7 nm。与对照组相比,添加咖啡酸、原儿茶酸、茶多酚、没食子酸、单宁酸等物质能增加黑莓清汁花色苷的最大吸光值,辅色效果显著(p<0.05)。但在阿魏酸和和芦丁的影响下,黑莓清汁花色苷的最大吸光值增加并不显著(p>0.05),可能原因是阿魏酸、芦丁与黑莓清汁花色苷辅色作用发生得较缓慢,也可能是辅色素与黑莓清汁中的其它大分子物质发生了相互作用,引起新物质的形成[8]。
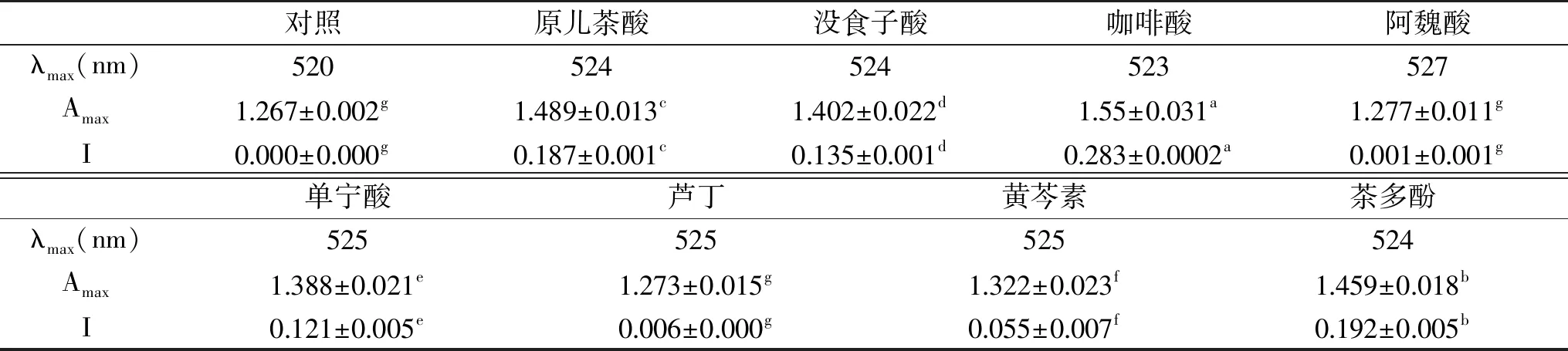
表1 辅色素对黑莓清汁花色苷的辅色效果Table 1 Copigmentation effects of copigments on the blackberry juice anthocyanins
2.2 辅色素浓度对黑莓清汁花色苷辅色效果的影响
考察不同浓度的辅色素对黑莓清汁花色苷辅色效果的影响,结果如图1所示。随着辅色素浓度的增加,黑莓清汁花色苷的辅色效果出现先增加后降低的趋势。原儿茶酸、咖啡酸、阿魏酸、黄芩素、茶多酚、没食子酸、单宁酸等辅色素在浓度小于0.1 mmol/L时,对黑莓清汁的辅色效果I值达到最大,当超过此浓度时,I值急剧下降。这可能是由于辅色剂在浓度0.1 mmol/L时,其与黑莓清汁花色苷分子的结合能力已经达到最大,再增加浓度并不能改变辅色效果。而当芦丁的浓度达到0.4 mmol/L时,其吸光值出现峰值,辅色效果最佳。
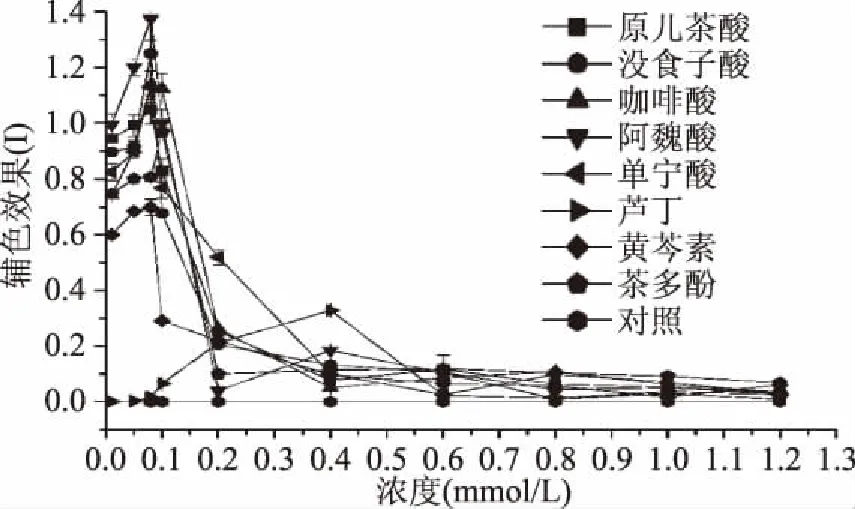
图1 不同浓度辅色素对黑莓清汁花色苷辅色效果的影响Fig.1 Copigmentation effects of different concentrations of copigments on the blackberry juice anthocyanins
2.3 辅色素对黑莓清汁花色苷热稳定性的影响
从表2中可以看出,与对照组相比,不同辅色素辅色后的黑莓清汁花色苷热稳定性发生了变化。并且在50、60和70 ℃的加热过程中,辅色后的花色苷在同一加热条件下的热降解速率k值显著低于对照组(p<0.05),热降解半衰期(t1/2)高于对照组,热降解率(P)显著低于对照组(p<0.05)。其中没食子酸、咖啡酸、阿魏酸的辅色效应促使黑莓清汁花色苷在热降解条件下的反应活化能增加,分别为(44.50±9.53)、(41.76±7.84)、(49.56±8.46) kJ/mol,高于对照组的(40.50±2.02) kJ/mol,即花色苷热降解时需要的能量增加,说明此条件下的花色苷稳定性较好。70 ℃加热时,在这三类辅色素的影响下,黑莓清汁花色苷热降解的半衰期分别延长了6.06、2.07和1.39倍。单宁酸、芦丁、黄芩素、茶多酚作为辅色剂也在一定程度上延长了花色苷的半衰期,而在加热过程中原儿茶酸的辅色效果较差。在热处理过程中,黑莓清汁花色苷会发生一定程度的降解[15],其结构向查耳酮转变,而加入辅色素后,通过辅色素丰富的电子与2-苯并吡喃阳离子的相互作用,减少水分子的攻击,提高花色苷稳定性[9]。实验所选的黄芩素、咖啡酸、阿魏酸、茶多酚、没食子酸、单宁酸、芦丁等物质具备较强的供电子能力,其辅色作用可以有效提高黑莓清汁花色苷的热稳定性,且不同结构辅色素的辅色效果也不尽相同。

表2 辅色素对黑莓清汁花色苷热稳定性的影响Table 2 Effects of copigments on thermostability of the blackberry juice anthocyanins
2.4 辅色素对黑莓清汁花色苷光稳定性的影响
将黑莓清汁和添加辅色素的黑莓清汁置于25 ℃、自然光下储藏10 d,考察辅色素对黑莓清汁花色苷光稳定性(降解速率和半衰期)的影响,结果如表3所示。从表3可以看出,不同辅色素对黑莓清汁花色苷的光稳定性影响有差异。其中,添加原儿茶酸、阿魏酸、芦丁、茶多酚后,黑莓清汁花色苷的光降解速率降低,半衰期延长,而在没食子酸和单宁酸的影响下,黑莓清汁花色苷的光稳定性降低。一般来说,光照会使花色苷的碳原子活性增强,易受到亲水攻击,并发生动力学降解[16],而辅色素与花色苷发生分子间相互作用有效保护了花色苷免受亲水攻击。没食子酸并没有表现出提高黑莓汁花色苷光稳定性的能力,这与其结构有关。没食子酸可能在果汁体系中发生分子聚合,降低与花色苷相互作用的能力;单宁酸分子体积是没食子酸的3倍,其含有大量的羟基,分子间氢键键合牢固,不易与花色苷相互作用。而且随着光照时间的延长,黑莓清汁花色苷体系中不同结构的物质逐渐增多,可能会影响分子之间的辅色作用效果。
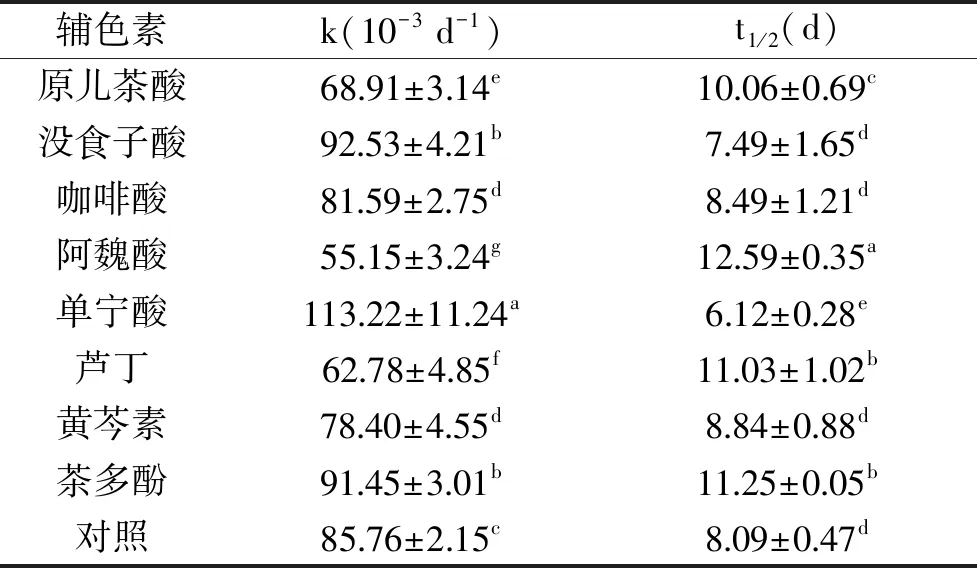
表3 辅色素对黑莓清汁花色苷光稳定性的影响Table 3 Effects of copigments on photostability of the blackberry juice anthocyanins
2.5 辅色素对黑莓清汁花色苷自由基清除能力的影响
DPPH自由基被广泛用于评价抗氧化剂的自由基清除能力。一般来说,原儿茶酸、阿魏酸、咖啡酸等易与花色苷发生酰基化反应。酰基化修饰不仅能提高花色苷的稳定性,而且会提高花色苷的抗氧化能力,但由于酰基化基团的不同,辅色后花色苷的抗氧化活性也会存在差异[17-18]。从图2中可以看出,与对照组相比,黄酮和酚酸物质辅色后的黑莓清汁花色苷表现出较高的DPPH自由基清除能力,尤其原儿茶酸、阿魏酸、咖啡酸、茶多酚、芦丁、黄芩素对其影响显著(p<0.05)。这是因为原儿茶酸、阿魏酸、咖啡酸可能与花色苷发生酰基化反应,生成了抗氧化能力更强的新物质[8]。茶多酚、芦丁、黄芩素自身也是抗氧化物质,除分子辅色效应引起的抗氧化活性增强外,不同结构和种类多酚化合物间的“协同抗氧化效应”也是提高体系抗氧化能力的因素之一。单宁酸的添加反而使黑莓花色苷自由基清除能力略有降低。在辅色过程中,单宁分子易与未酰基化的花色苷发生结合,形成新的物质[19]。这些新复合物可能会导致花色苷总自由基清除能力降低。
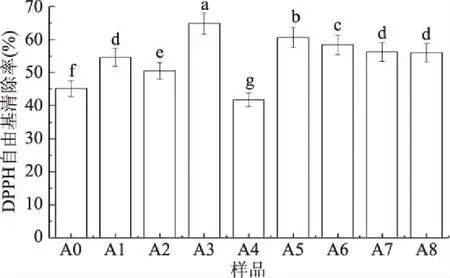
图2 辅色素对黑莓清汁花色苷自由基清除能力的影响Fig.2 Effects of copigments on DPPH radical scavenging activity of the blackberry juice anthocyanins 注:A0:对照,A1:原儿茶酸,A2:没食子酸, A3:阿魏酸,A4:单宁酸,A5:咖啡酸, A6:芦丁,A7:黄芩素,A8:茶多酚,图3同。
2.6 辅色素对黑莓清汁花色苷总还原力的影响
一般情况下,天然化合物的抗氧化性与其还原力可能具有一定关联性。还原剂能将Fe3+/铁氰化物复合物转变为Fe2+形式,Fe3+还原强弱经常与供电子能力强弱相关[20]。抗氧化剂通过供电子作用将Fe3+还原为Fe2+,然后在形成Fe2+复合物普鲁士蓝(Fe4[Fe(CN)6]3)在700 nm下检测其吸光度,吸光度的大小反映了还原力的强弱。从图3可以看出,经分子辅色后的黑莓清汁花色苷吸光值明显大于对照组(p<0.05),显示出较强的还原力,说明辅色后的体系有较强供电子能力,能够更有效地终结自由基链式反应。而茶多酚辅色后的黑莓清汁花色苷的总还原力减弱,这可能是由于在一系列化学反应过程中,茶多酚中各成分与黑莓花色苷相互作用改变导致的,其机理有待进一步研究。
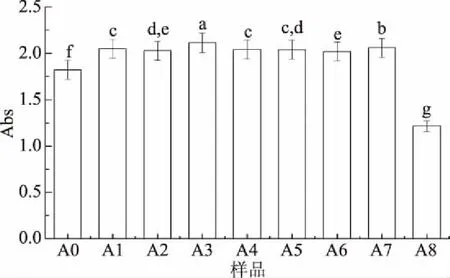
图3 辅色素对黑莓清汁花色苷总还原力的影响Fig.3 Effects of copigments on reducing power of the blackberry juice anthocyanins
3 讨论
3.1 辅色作用对黑莓清汁花色苷性质的影响
分子辅色技术是目前应用于花色苷产品加工的重要技术之一[18]。本实验中发现少量的有机酸和黄酮物质便能够引起黑莓清汁花色苷最大吸收波长和最大吸光值的改变,起到一定的辅色效果。相关研究也证实了有机酸和黄酮在花色苷辅色加工中的作用。Yawadio等[21]研究发现p-香豆酸、阿魏酸、单宁酸等能够与黑米花色苷形成新的复合物,并且在饮料贮藏期间起到增色和提高稳定性的作用。王维茜等[22]研究了槲皮素、黄芩素、芦丁对刺葡萄花色苷有较好的辅色效果,而且槲皮素能提高刺葡萄花色苷的热稳定性。李永强等[23]发现贮藏期间杨梅花色苷最大吸收波长发生蓝移,杨梅黄酮与花色苷存在明显的分子间辅色作用。可见,辅色素对不同种类的花色苷的色泽、稳定性等的影响也呈现出差异,并未呈现出相应的量效关系或者一定的规律特性,这可能与其辅色机制有关。
黑莓清汁花色苷提取物是一个混合体系,其含有大量的黄酮、酚类物质,体系分子之间的相互作用变得尤为复杂,这也增加了后续研究辅色后新形成复合物的难度。此外,抗氧化活性试验发现,单宁酸的辅色能够引起黑莓清汁花色苷DPPH自由基清除能力的减弱,茶多酚引起了其总还原力的降低。可见,选择不同的评价模型,其结果不一。但总的来看,酚酸和黄酮类物质的辅色素能够维持并提高花色苷的生物活性。周剑忠等[24]研究也发现辅色作用能够显著提高花色苷的生物活性。可能是酚类物质、黄酮以及其他小分子物质之间抗氧化作用协同发生的结果。因此,将多种酚酸、黄酮等物质复配使用,通过不同的辅色机制来稳定产品的色香味,已成为花色苷产品加工的一种趋势。
3.2 辅色素对黑莓清汁花色苷的辅色机理
本试验选用的有机酸类物质从结构上来看属于芳香酸类。与脂肪酸类相比,咖啡酸、阿魏酸等芳香酸类更易与花色苷发生酰基化反应,这就使得辅色后的花色苷更稳定。其机理可能是由于体系中的各分子内、分子间容易在氢键、络合、共价结合、电子转移、π-π键等作用下,不同的基团发生旋转、折叠和堆积等空间结构的转换,在花色苷母核阳离子周围形成“保护层”,避免了水分子的亲核攻击和其它降解反应,阻止了花色苷色泽的变化,从而对花色苷产生了增色和稳定效应[25-28]。而黄酮物质是黑莓清汁花色苷体系共存的物质,其分子间辅色效果更强。试验选取的芦丁、黄芩素、茶多酚等,具有与黑莓黄酮类似的作用。其对花色苷的辅色作用主要在于稳定了溶液中紫色的脱水碱,阻止其转化成无色的查尔酮结构[29]。
但是在黑莓果汁加工处理过程中,花色苷所处介质发生了从细胞内到细胞外环境的改变。而在实验中模拟植物复杂的内环境条件也是较困难的。而且分子间辅色作用也具有不稳定性,不同辅色物质的结构和花色苷自身的分子结构变化也关系到辅色效果。因此,选用不同辅色素对花色苷进行必要的分子辅色修饰技术也成为花色苷产品加工的关键技术之一。
4 结论
咖啡酸、原儿茶酸、茶多酚、没食子酸、单宁酸等化合物与黑莓清汁花色苷相互作用可以增加其最大吸光值和最大吸收波长,辅色效果显著;实验所选8种化合物中没食子酸、咖啡酸、阿魏酸能够增强黑莓清汁花色苷的热稳定性;原儿茶酸、阿魏酸、芦丁能够提高黑莓清汁花色苷的光稳定性、DPPH自由基清除能力和总还原力。本实验结果可为黑莓清汁花色苷的辅色稳态化处理及黑莓果汁的深加工提供理论参考。

