菊芋菊糖粗提液的微生物除杂
李雪雁,武晓尧,孙春丽,谢辉灿,王金龙
(兰州理工大学 生命科学与工程学院,甘肃 兰州,730050)
菊芋(Jerusalemartichoke)块茎中菊糖含量为其干重的55%~83%,是自然界已知含有菊糖的36 000种植物中含量最高的植物之一[1]。菊糖,又称菊粉,是由呋喃构型的D-果糖经β-(2,1)糖苷键脱水聚合而成的果聚糖混合物[2]。不同聚合度的果糖具有不同的生理功能,低聚合度的果糖可以促进人体肠道双歧杆菌的增殖,改善肠道功能,提高免疫力和抗病力[3-5]。
由于菊糖易溶于水,加热溶解更快[6],因此工业上提取菊糖一般都采用热水浸提法,在提取过程中一些杂质如蛋白质、果胶、色素等也随之被提取出来,因而菊芋粗提液需进行脱色、脱蛋白等去杂过程[7]。目前脱蛋白主要采用Sevage法、三氯乙酸法、HCl法、石灰乳法、树脂纯化法等[8-12]。菊芋提取液中还含有果糖、葡萄糖等还原糖,要得到高纯度的菊糖,还需额外采用一些方法(如膜过滤等)将还原性糖去除[13-14]。由于现行菊糖的工业化生产工序较复杂,导致成本较高。基于微生物在生长繁殖过程中消耗糖类和蛋白质作为其碳源和氮源,因此将筛选的不降解菊糖的微生物菌株接入菊芋粗提液中,在适宜条件下培养,可逐渐将粗提液中的还原糖和蛋白质消耗,即可达到菊糖纯化和精制的目的,并使原工艺简化。将微生物用于菊芋提取液除杂的研究尚未见文献报道,本文对此进行了研究,以期为工业生产的应用提供依据。
1 材料与方法
1.1 材料与试剂
紫皮菊芋20 kg,购于兰州市某市场。将新鲜菊芋洗净切片,于60 ℃电热恒温鼓风干燥箱中干燥24 h,制得菊芋干片,备用;菌株,兰州理工大学生命科学与工程学院实验中心保藏的11株酵母菌菌株,分离自宁夏贺兰山东麓葡萄酒产区的葡萄果实表皮和根际土壤中[15];菊糖,即菊粉,购自甘肃省白银市某菊粉生产企业。
YPD培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20,pH 5.5。
产酶种子培养基,参照文献[16]略做修改:菊糖10,蛋白胨20,酵母粉10,pH 5.5。
产酶发酵培养基(g/L)[17]:菊糖30,蛋白胨20,酵母粉10,(NH4)2SO45,KH2PO43,pH 5.5。
WL营养培养基(g/L)[18]:酵母浸粉4,胰蛋白胨5,葡萄糖50,琼脂20,储液A(KH2PO45.5 g,KCl 4.25 g,CaCl21.25 g,MgSO41.25 g,定容至400 mL,按1∶25比例添加),储液B(FeCl30.25 g,MnSO40.25 g,定容至100 mL,按1∶1 000比例添加);储液C(0.44 g溴甲酚绿溶于100 mL体积分数50%乙醇溶液中,按1∶1 000比例添加),1×105Pa灭菌20 min。
牛血清蛋白(BSA,生物试剂),考马斯亮蓝(优级纯),蔗糖、果糖、酒石酸钾钠、3,5-二硝基水杨酸、苯酚、蒽酮等试剂均为分析纯。
1.2 主要仪器与设备
WPL-125BE型恒温培养箱,天津市泰斯特仪器有限公司;UV-3000PC型紫外分光光度计,上海美谱达仪器有限公司;TGL-16型高速冷冻离心机,湖南湘仪离心机仪器有限公司;FA2004型分析天平,上海良平仪器仪表有限公司;SHB-111型真空抽滤泵,天津赛得利斯实验分析仪器制造厂;GZX-9030MBE型电热恒温鼓风干燥箱,上海博迅实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 菌株鉴定及其菊粉酶活力的测定
1.3.1.1 菌株初步鉴定[19]
将11株酵母菌分别转接至WL鉴别培养基,28 ℃培养5~7 d,依据各菌株在WL培养基的菌落形态和颜色特征等,参照WL培养基的酵母菌鉴别表,进行初步鉴定。
1.3.1.2 菊粉酶粗酶液的制备
将11株酵母菌菌株分别接入YPD培养基中,28 ℃活化培养24 h;之后转接入产酶种子培养基中,28 ℃恒温振荡培养12 h;再将种子液转接入50 mL产酶发酵培养基中(接种量为10%体积分数),30 ℃恒温振荡培养96 h。将发酵液在3 500 r/min,离心15 min,取上清液即为粗酶液。
1.3.1.3 菊粉酶活力的测定
首先参照文献[20]制作标准果糖曲线。
将粗酶液经适当稀释后取1 mL,加入20 g/L菊糖(用0.2 mol/L,pH 4.5醋酸缓冲液配制)4 mL,50 ℃下反应30 min,沸水加热5 min灭酶活,采用3,5-二硝基水杨酸法(DNS比色法)[16]测还原糖,以沸水浴加热10 min失活的粗酶液作为对照。在果糖标准曲线上查出糖含量,计算反应生成的还原糖量(以果糖计),以每分钟转化生成 1 μmol/L还原糖所需的酶量为1个酶活力单位,该法测得的是内切菊粉酶活力,以I表示。以2% 蔗糖代替菊糖,其他步骤同上。以每分钟转化生成1 μmol/L还原糖所需的酶量为1个酶活力单位,即为外切菊粉酶活力,以S表示。每个菌株实验结果取3次的平均值。
一般认为当I/S>10时,菊粉酶主要表现为内切酶活性,而I/S<10时,主要表现为外切酶活性[21]。
1.3.2 菊糖粗提液的制备
新鲜菊芋洗净切片,于60 ℃电热恒温鼓风干燥箱中干燥24 h,得菊芋干片。以粉碎的菊芋干粉为原料,菊糖热水提取条件为:料液比1∶15(g∶mL)、温度80 ℃、时间80 min,重复提取2次,经活性炭脱色,得菊糖粗提液。
1.3.3 酵母菌除杂实验
1.3.3.1 分析方法
总糖的测定采用硫酸-蒽酮法;还原糖测定采用DNS法;蛋白质含量测定采用考马斯亮蓝法,以牛血清白蛋白绘制标准曲线[20]。
菊糖=总糖-还原糖
(1)
还 原糖脱除率/%=
(2)
蛋 白质脱除率/%=
(3)
菊 糖损失率/%=
(4)
1.3.3.2 单因素试验
将选取的菊粉酶活力较低的酵母菌株先用YPD培养基,28 ℃活化培养24 h,之后转接入已灭菌的菊糖粗提液中,28 ℃恒温振荡培养12 h,即为除杂酵母种子液。取40 mL菊糖粗提液于250 mL三角瓶中,经灭菌后接入体积分数3%除杂酵母菌种子液,对培养时间、温度以及摇瓶转速进行单因素实验,测定菊糖提取液中的还原糖和蛋白质的脱除率,确定3个因素的适宜条件。
1.3.3.3 正交试验
基于单因素试验结果,进行培养时间、温度及转速3因素3水平正交试验,进一步优化酵母菌除杂条件。按公式(5)计算:

×0.5
(5)
1.3.3.4 正交试验验证
以正交试验优化组合条件进行脱除还原糖和蛋白质的验证试验;同时对在优化条件下的菊糖损失率进行测定。
1.3.4 菌株的分类学鉴定
将菌株送到上海生工进行测序,引物用上海生工提供的酵母菌通用引物,得到菌株序列后使用Mega 5.1软件构建系统进化树将其进行进一步鉴定。
2 结果与分析
2.1 菌株鉴定及其菊粉酶活力测定结果
2.1.1 菌株初步鉴定结果
依据11菌株在WL培养基上经过5 d培养后所形成菌落的颜色和形态特征进行鉴定,其中4株为酿酒酵母(Saccharomycescerevisiae),编号S-1-4;3株为有孢汉逊氏酵母(Hanseniasporauvarum),编号H-1-3;4株为假丝酵母(Candidaspccies),编号Z-1-4。
2.1.2 菌株菊粉酶活力测定结果
从表1可以看出,所有测试菌株的菊粉酶活力普遍低于一些文献报道[16-17,22-24],因菊糖经过菊粉酶的水解作用可以产生果糖或低聚果糖,对于利用微生物去除菊芋粗提液中单糖的操作是不利的,故要选择菊粉酶活力较低的菌株。测定菌株中4株酿酒酵母的内切菊粉酶活力(I)均较其他菌株低,其中S-4菌株的I值最低,但其活力比值I/S<10,表现为外切酶活性相对较高,外切型菊粉酶水解菊糖的产物主要为果糖,对纯化产生不利影响,不适宜作为除杂菌株。S-2菌株的内切菊粉酶(I)活力仅高于S-4菌株而低于其他菌株,且其I/S>28,因此选择S-2作为除杂菌株进行以下试验。
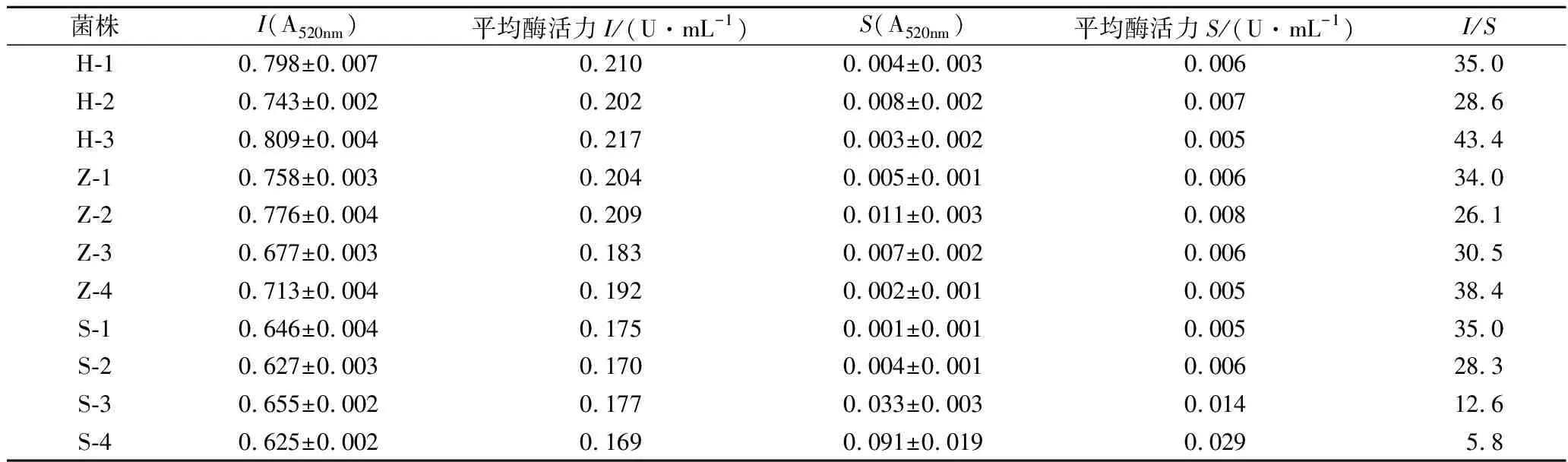
表1 酵母菌株菊粉酶活力Table 1 Inulinase activity of yeast strain
2.2 单因素试验结果
2.2.1 培养时间对还原糖和蛋白质脱除率的影响
酵母菌培养时间对脱除还原糖和蛋白质的影响见图1。随着培养时间的延长,还原糖和蛋白质的脱除率逐渐提高,在50~60 h,脱除率基本稳定。由于菊芋热水粗提液中含有一定量的果糖、葡萄糖、低聚糖及蛋白质,可作为酵母菌的营养物质,在酵母菌生长繁殖的前中期,营养相对丰富,酵母菌生长速率较高,还原糖和蛋白质的消耗速率较快,表现为其去除率上升趋势明显,在40 h之后,糖和蛋白质逐渐被酵母菌消耗殆尽,脱除率即保持相对稳定;培养至70 h之后,还原糖脱除率基本稳定,而蛋白质脱除率略有下降,其原因可能是由于酵母菌开始老化,部分菌体自溶,菌体蛋白溶入提取液中,导致蛋白质含量略有增加。由此可见,控制适当的培养时间对还原糖和蛋白质的脱除是很重要的。
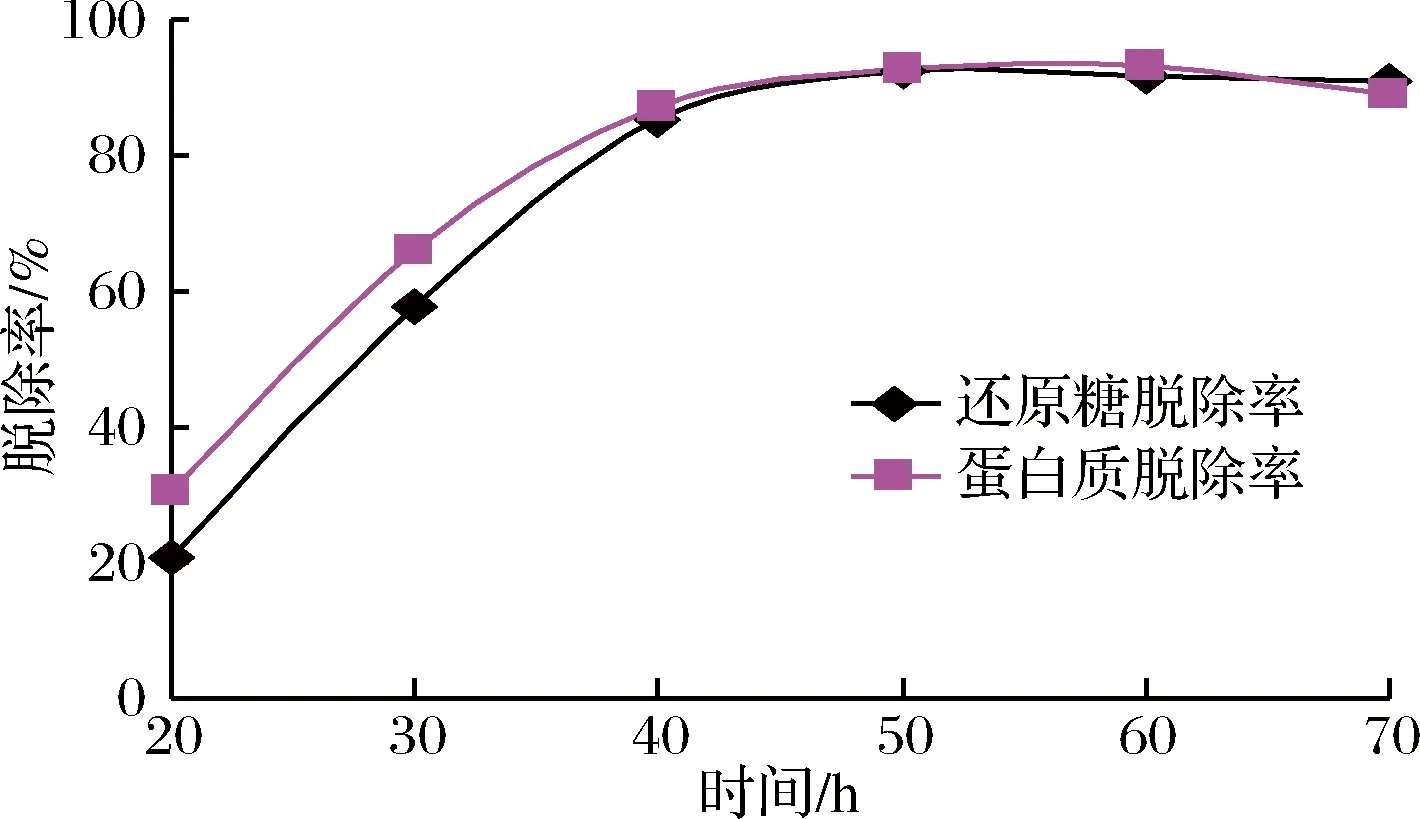
图1 培养时间对除杂的影响Fig.1 Effect of incubation time on impurity removal
2.2.2 培养温度对还原糖和蛋白脱除率的影响
温度对反应体系的影响是多方面的,既影响微生物的生长繁殖、酶的活性,也会影响反应体系的理化状态。通常酵母菌最适的生长温度在28~30 ℃,温度过低或过高,都会影响酵母菌的生长繁殖,由图2可知,30 ℃左右也是除杂效果较好的温度。随着培养温度的升高,一方面,酵母菌的生长将受到不利的影响,特别是在培养初期温度偏高还将导致中后期菌体早衰,还原糖和蛋白的脱除率呈现下降趋势;另一方面,菊粉酶适宜温度一般为50 ℃左右[25],温度升高,酵母菊粉酶活性略有提高,菊糖水解产生少量果糖,在一定程度上使还原糖脱除率下降。

图2 温度对除杂的影响Fig.2 Effect of temperature on impurity removal
2.2.3 转速对还原糖和蛋白脱除率的影响
酵母菌为兼性厌氧微生物,溶解氧含量较高时酵母菌进行有氧代谢,产能效率较高,生长繁殖速率较快。摇瓶转速的高低直接影响反应体系的供氧量,由图3可知,随着转速的增大,溶氧量增加,酵母菌生长速率加快,还原糖和蛋白脱除率随之提高;但当转速在160 r/min以上时,酵母菌的生长繁殖速率趋于稳定,表明溶氧量已超过临界溶氧浓度,已不再是限制性因素,酵母菌对糖和蛋白质的脱除率也就基本稳定。因此摇瓶转速在160~180 r/min较适宜。

图3 转速对除杂的影响Fig.3 Effect of rotational speed on impurity removal
2.3 正交试验结果
正交试验结果及分析见表2、表3。

表2 正交试验结果与分析Table 2 Results of orthogonal tests and rangeanalysis table
注:综合评分采用加权评分法,分别把2项中最大的指标定为100分,权重系数均为0.5。
从表2和表3可以看出,酵母菌培养时间和温度对还原糖脱除率的影响极显著(P<0.01),而摇床转速在140~180 r/min对还原糖脱除率影响不显著;3个因素对蛋白质脱除率的影响均极显著(P<0.01)。通过对还原糖脱除率和蛋白质脱除率的综合评分,3个因素的影响主次顺序为时间>温度>转速;较优组合为A2B2C3。
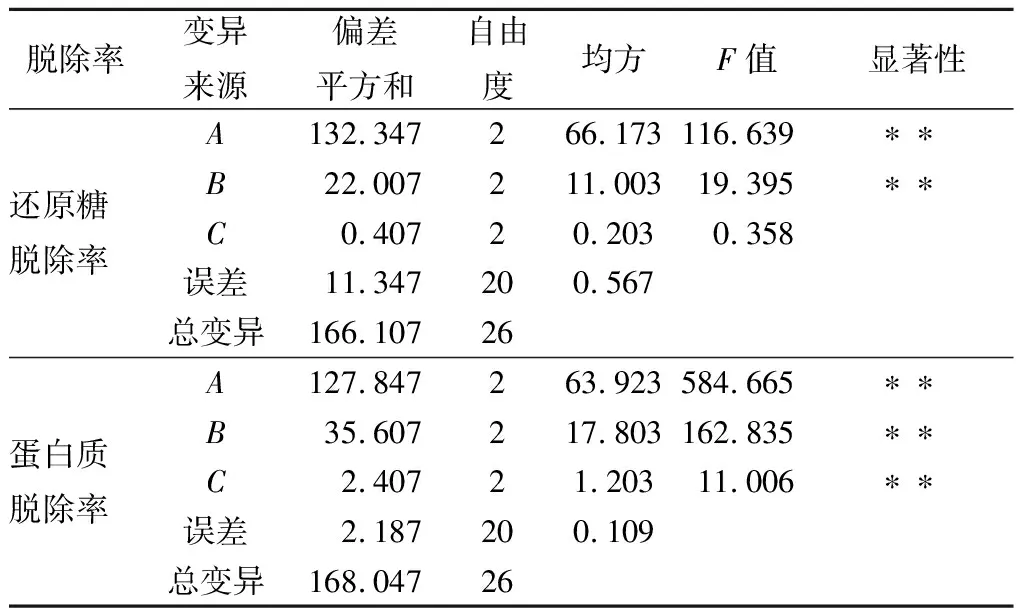
表3 正交试验方差分析结果Table 3 Result of variance analysis for orthogonalexperiment
2.4 正交试验验证结果
因酵母菌摇床培养时转速在160~180 r/min对脱除率综合影响不显著,故以较优组合A2B2C3和A2B2C2做进一步验证,结果见表4。A2B2C3组合的酵母菌还原糖和蛋白质脱除率分别达92.6%和93.1%,但菊糖损失率略高于A2B2C2组合。考虑到工业化培养微生物时,溶解氧常常是限制性因素,因此可选择溶氧水平较低的条件,即温度30 ℃、时间50 h、转速160 r/min,在此条件下,酵母菌对还原糖和蛋白质的脱除率分别为92.4%和92.9%,菊糖损失率为2.86%,除杂效果达到或优于其他方法[7,12,21-23]。
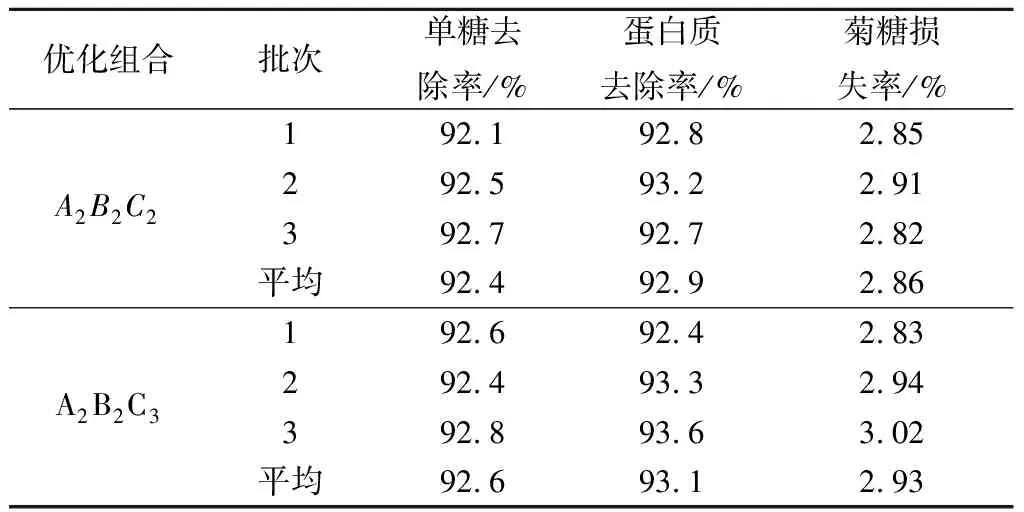
表4 正交试验验证结果Table 4 Verification results of orthogonal tests
2.5 分类学鉴定结果
从图4看出,菌株S-2与来自NCBI数据库的几种酿酒酵母(Saccharomycescerevisiae)在一个进化分支上,并且在NCBI中的序列比对结果显示其相似性在98%以上,表明S-2菌株属于酿酒酵母。
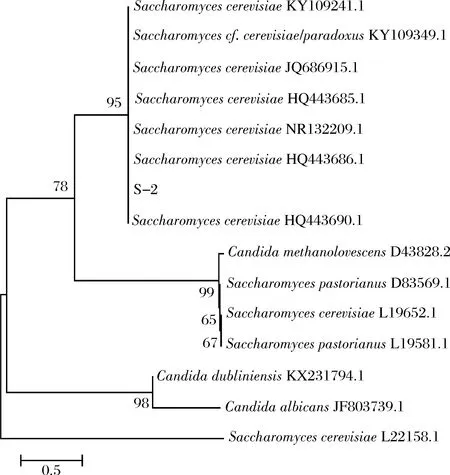
图4 系统进化树Fig.4 Phylogenetic tree
3 结论
本实验通过对11株酵母菌菌株的菊粉酶酶活力的测定与分析,筛选出1株菊粉酶活力较低的菌株S-2,且该菌株主要表现为内切酶活性。
在对影响酵母菌脱除还原糖和蛋白质的培养时间、培养温度及摇床转速单因素试验的基础上,进行了正交试验优化及验证,结果表明,在培养时间为50 h、温度30 ℃、摇瓶转速在160~180 r/min条件下,菌株S-2对还原糖的脱除率大于92%,对蛋白质的脱除率在93%左右,菊糖损失率低于3%。体现出脱杂效果好、菊糖损失少的优点,说明利用微生物脱除菊芋粗提液中的还原糖和蛋白质是可行的。
本实验所选择的除杂酵母菌S-2经系统鉴定为酿酒酵母,在食品生产中酿酒酵母已被美国FDA认证为GRAS菌株,不存在食品安全问题。除杂过程中培养产生的菌体可做进一步开发利用,或可通过微生物育种,选择菊粉酶活性低而菌体蛋白含量高的酵母菌株除杂,菌体可作为饲料蛋白添加剂使用。

