RBP-Jκ对结肠癌细胞增殖和移植瘤生长的影响及其在小鼠结肠癌组织的表达
王文娟,刘梦洁#,徐 瑞,王淑红
(1西安交通大学第一附属医院肿瘤内科,西安 710061;2西安交通大学医学院附属陕西省肿瘤医院内一科;#共同第一作者;*通讯作者,E-mail:aduanxu@163.com)
结肠癌是全球最常见的肿瘤之一,每年的新增病例位列第三。无论对于男性还是女性,结肠癌都是主要致死原因[1]。结肠癌的发生不但与环境相关,与基因的关系更为密切。Notch信号通路在进化上高度保守,它在所有后生动物有机体的胚胎发育中发挥着重要的作用[2]。Notch蛋白是一种单跨膜蛋白,可与Delta或Delta样及Jagged/Serrate家族结合,并在细胞膜发生剪切,释放出有活性的胞内段(NICD)。NICD从细胞膜转运至细胞核,并与DNA结合蛋白形成复合体,进而参与调控下游多个靶基因的转录,发挥相应的功能[3]。Notch通路中的DNA结合蛋白在哺乳动物中成为RBP-Jκ,它是Notch信号通路的转录抑制因子,可识别并结合特定的DNA序列,在Notch信号通路中发挥重要的作用[4]。Notch信号的异常激活与人类多种恶性肿瘤有关,例如结肠癌[5]、肺癌[6]、乳腺癌[7]等。这使得Notch通路成为了潜在的治疗靶点。但是Notch信号通路中的重要的转录调控因子RBP-Jκ在结肠癌的发生发展中发挥的作用尚不明确。本课题组前期研究结果表明沉默结肠癌细胞中LEF1的表达可以抑制结肠癌细胞的增殖能力,并且降低细胞中RBP-Jκ的蛋白表达[8]。如前所述,Notch通路的异常激活也与结肠癌密切相关,因此,从前期的实验结果推测RBP-Jκ可能也参与了调控结肠癌细胞的增殖,为了明确此假说,本研究观察结肠癌细胞中RBP-Jκ的表达,利用慢病毒载体改变结肠癌细胞中RBP-Jκ的表达,在体外探讨RBP-Jκ对人结肠癌细胞增殖的影响,同时通过裸鼠皮下移植瘤模型验证体外实验的结果,并且构建AOM诱导的C57BL/6小鼠结肠癌模型探讨RBP-Jκ与小鼠结肠癌发生发展的关系。
1 材料与方法
1.1 实验动物、细胞株与质粒
4周龄雄性SPF级C57BL/6小鼠24只,体质量18-22 g,购买自西安交通大学实验动物中心,生产许可证号:SCXK(陕)2012-003。4-6周龄雄性SPF级裸鼠24只,体质量20-24 g,由湖南斯莱克景达实验动物有限公司提供,生产许可证号:SCXK(湘)-2016-002。上述动物均饲养于西安交通大学动物中心[许可证号:SYXK(陕)-2015-002]。所有动物实验均遵守实验动物法律法规以及相关伦理学规定。
人结肠癌细胞系SW480、Caco2、SW620、HCT116、RKO、HT29、LS147T细胞和Lovo细胞均购买自中国科学院上海生科院细胞资源中心。慢病毒质粒由上海吉凯基因化学技术有限公司包装合成。分别为RBP-Jκ过表达重组慢病毒载体(Lentivirus-RBP-Jκ)和对照组(Lentivirus-NC),沉默RBP-Jκ重组慢病毒载体(Lentivirus-shRBP-Jκ)和对照组(Lentivirus-shNC)。
1.2 主要试剂和仪器
DMEM高糖培养基(美国Gibco公司),AOM(美国Sigama公司),RBP-Jκ抗体(美国Abcam公司),β-actin抗体(美国CST公司),MTT试剂盒(美国Solarbio公司),SDS-PAGE制胶试剂盒(北京索莱宝科技有限公司),RNA提取试剂盒fast200(天根有限公司),逆转录反应试剂盒(RR036;TAKARA),SYBR GREEN Ⅰ检测试剂盒(RR716;TAKARA)。恒温CO2细胞培养箱(美国Themo Fisher Scientific公司),多功能酶标仪(德国BMG LABTECH公司),化学发光成像系统(美国UVP公司)。
1.3 细胞培养
人结肠癌细胞系SW480在10%胎牛血清的RPMI-1640培养基中,HT29和LS147T在含10%胎牛血清的DMEM/F12培养基中,RKO在含10%胎牛血清的DMEM培养基中,以上四株细胞均于5% CO2,37 ℃培养箱中常规培养,1-2 d用0.25%胰酶消化传代,常规冻存。人结肠癌细胞系Caco2、HCT116和Lovo在含10%胎牛血清的DMEM培养基中,SW620在含20%胎牛血清的L-15培养基中,以上四株细胞均于5% CO2,37 ℃培养箱中常规培养,2-3 d用0.25%胰酶消化传代,常规冻存。
1.4 重组慢病毒载体感染人结肠癌细胞
取对数生长期的细胞,以5×104/ml的密度将生长良好的两株目的细胞接种于6孔板,孵育24 h。根据预实验结果计算出两株目的细胞的MOI值。根据细胞MOI值加入相应的滴度的病毒稀释液。感染后72 h,观察荧光表达情况。随后1 ∶6传代,换用加有嘌呤霉素(终浓度为3 μg/ml)的相应培养基,每2-3 d换液,直至单克隆集落形成,挑取抗性单克隆细胞至24孔板,用含1.5 μg/ml嘌呤霉素的相应培养基进行筛选扩增。
1.5 细胞蛋白的提取及Western blot检测蛋白表达
收集对数生长期的细胞,加入RIPA裂解液冰上孵育30 min,收集细胞裂解液,4 ℃ 12 000 r/min离心10 min,收集上清。加入上清1/4体积的Loading buffer,100 ℃煮沸5 min。紫外分光光度计法测量蛋白样品浓度。于垂直电泳槽内行10%聚丙烯酰胺凝胶(SDS-PAGE)电泳,转印至聚偏二氟乙烯(PVDF)膜。5%BSA封闭1 h,RBP-Jκ(1 ∶800)及β-actin(1 ∶2 000)一抗4 ℃孵育过夜。PBST清洗,二抗(1 ∶10 000)室温孵育1 h。PBST清洗,在化学发光成像仪上进行结果显像。
1.6 Real time-PCR检测mRNA表达
将提取的细胞总RNA逆转录生成cDNA。RBP-Jκ和GAPDH引物序列见表1。选用25 μl的Real time-PCR反应体系:SYBR Premix Ex TaqⅡ(2×)12.5 μl;cDNA模板2 μl;上、下游引物各1 μl;ddH2O 8.5 μl。预变性:95 ℃ 5 min,变性95 ℃ 5 s,退火延伸60 ℃ 20 s,循环40次。所有实验重复3次,应用2-ΔΔCt(目的基因的表达相对于对照组的变化倍数)方法分析目的基因的表达差异。
表1RBP-Jκ和GAPDH引物序列
Table1RT-PCRprimersequencesofRBP-JκandGAPDH

基因 上游引物 下游引物 RBP-Jκ(人)5′-CAAGAGTCTCAACCGTGTGCATTTA-3′5′-ACATGAAGTGCTTTCGCTTGTCTG-3′RBP-Jκ(小鼠)5′-GTTCTTAACCTGTTGGTCGGAACC-3′5′-GCTTGAGGCTTGATGTTCTGTATTGC-3′GAPDH5′-ATGGGGAAGGTGAAGGTCG-3′5′-GGGTCATTGATGGCAACAATATC-3′
1.7 MTT法检测细胞增殖
制备1.5×104/ml的细胞悬液,于96孔板内每孔加入200 μl,共计3个复孔。于第2天加入20 μl 5 mg/ml MTT溶液,并于37 ℃培养箱中继续孵育4 h,弃去上清后每孔加入100 μl DMSO溶液,漩涡振荡器振荡10 min,在492 nm波长下于酶标仪上测定细胞的OD值,连续测量7 d。
1.8 裸鼠皮下移植瘤模型的构建
选取生长良好的细胞持续培养48 h,达到90%以上融合度时,常规胰酶消化制成单细胞悬液,用含有50% Matrigel的无血清培养基重悬,制备5×107/ml对数生长期细胞悬液,于裸鼠背侧皮下注射200 μl。每四天用游标卡尺测量肿瘤结节的长径(l)、短径(w),按公式(l×w2)/2计算出肿瘤近似体积。连续观测28 d,根据计算所得的肿瘤体积绘制肿瘤移植瘤生长曲线。在动物实验中遵循动物实验伦理原则。
1.9 C57BL/6小鼠结肠癌模型的构建
AOM诱导的小鼠结肠癌模型构建流程见图1。选用4周龄雄性C57BL/6小鼠24只用于模型的构建。称重,等数分组并标记小鼠;以10 mg/kg的剂量腹腔注射AOM到实验组小鼠,同时注射等体积的无菌生理盐水到对照组小鼠。每周注射1次,连续6周。每8周处死3只小鼠,收集结肠组织,HE染色后显微镜下观察结肠病理组织学改变。

图1 AOM诱导的小鼠结肠癌模型构建流程图Figure 1 Flow chart of AOM-induced colon cancer in mice
1.10 肿瘤组织标本的取材
实验结束时采用拉颈处死,解剖取出肿瘤组织,称重后,分两份保存,一份入液氮冻存,以备提取RNA和蛋白,进行RT-PCR和Western blot之用。另一份入4%多聚甲醛溶液中固定,以备HE、免疫组化染色。
1.11 统计学分析
每个实验独立重复3次,计量资料采用独立样本t检验进行统计分析,所有数据分析在SPSS 22.0中进行,以P<0.05为差异有统计学意义。
2 结果
2.1 RBP-Jκ对人结肠癌细胞增殖的影响
利用Western blot和RT-PCR在8种结肠癌细胞中筛选出RBP-Jκ高表达的RKO细胞和RBP-Jκ低表达的SW480细胞(见图2)。分别构建沉默RBP-Jκ的RKO稳定转染细胞(RKO-shRBP)和过表达RBP-Jκ的SW480稳定转染细胞(SW480-RBP)。Western blot检测结果显示,RKO-shRBP细胞中RBP-Jκ的蛋白表达较RKO-NC细胞显著降低(P<0.05,见图3A)。SW480-RBP细胞中RBP-Jκ的蛋白表达较SW480-NC细胞显著升高(P<0.05,见图3B)。MTT检测各组细胞的增殖,结果显示RKO-shRBP细胞的增殖速度较RKO-NC细胞显著降低(P<0.05,见图4A),SW480-RBP细胞的增殖速度较SW480-NC细胞显著增快(P<0.05,见图4B)。
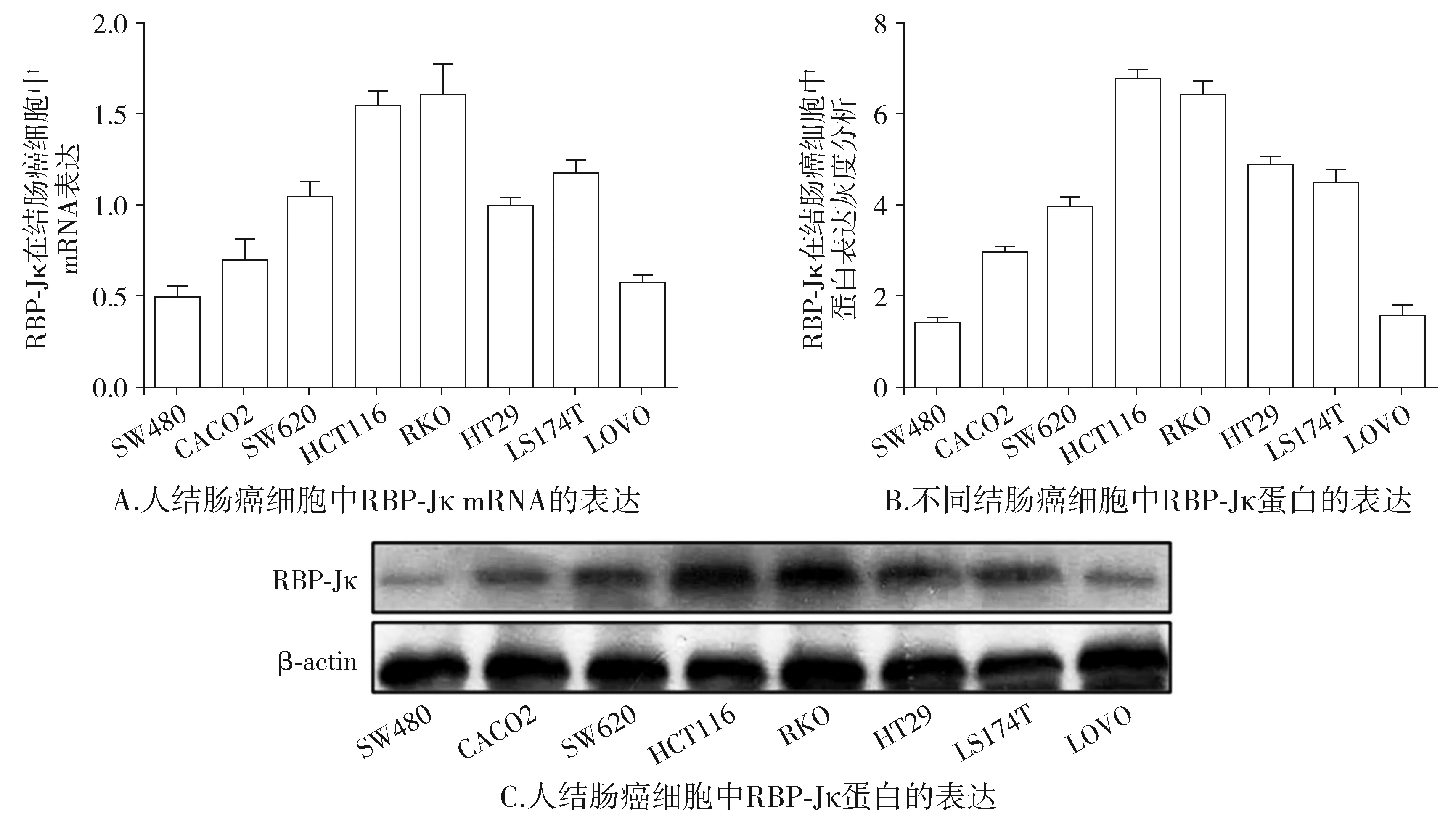
图2 人结肠癌细胞中RBP-Jκ mRNA和蛋白的表达Figure 2 The mRNA and protein expression of RBP-Jκ in human colon cancer cell lines
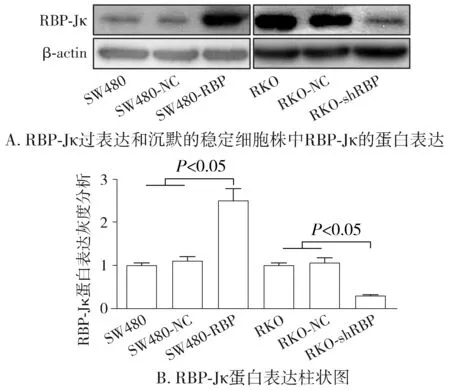
图3 Western blot检测RBP-Jκ过表达和沉默的稳定细胞株中RBP-Jκ的蛋白表达Figure 3 The protein expression of RBP-Jκ in RBP-Jκ over-expressed and silenced colon cancer cells by Western blot
2.2 RBP-Jκ促进裸鼠皮下移植瘤的生长
如前所述实验方法绘制出裸鼠皮下移植瘤生长曲线(见图5B)。结果显示,RKO-shRBP移植瘤的生长速度比RKO-NC移植瘤明显减慢,SW480-RBP移植瘤的生长速度比SW480-NC移植瘤明显增快。注射28 d后处死裸鼠,随后取下皮下移植瘤观察其大体形态(见图5A)。同时称重,RKO-shRBP移植瘤的体积比RKO-NC移植瘤的体积明显减小,质量减轻,SW480-RBP移植瘤的体积比SW480-NC移植瘤的体积明显增大,质量加重(P<0.05,见图5C和5D)。
2.3 AOM诱导C57BL/6小鼠结肠癌模型
为进一步探讨RBP-Jκ在结肠癌发生发展中所发挥的作用,通过腹腔注射AOM的方法,成功构建了小鼠结肠癌模型。将首次注射AOM记为第1周,在第28周时小鼠肛门开始出现充血红肿溃烂(图6A)。总观察时间为32周,结束观察后处死小鼠,结肠内可见多个蕈伞样肿块(见图6B)。收集小鼠肿瘤组织及对照组小鼠结肠组织,HE染色可见小鼠肿瘤组织中细胞排列紊乱,正常腺管结构消失,细胞核增大(见图6C),对照组小鼠结肠组织中细胞排列整齐,腺管结构清晰,核质比正常(见图6D)。
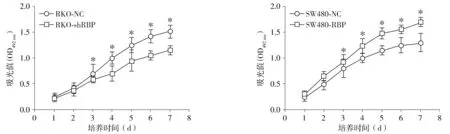
A. MTT法检测RBP-Jκ沉默对RKO细胞增殖的影响B. MTT法检测RBP-Jκ过表达对SW480细胞增殖的影响与对照组相比,*P<0.05图4 RBP-Jκ沉默和过表达对RKO细胞和SW480细胞增殖的影响Figure 4 Effects of RBP-Jκ silencing and over-expression on RKO cell and SW480 cell proliferation

与RKO-NC细胞相比,*P<0.05;与SW480-NC相比,#P<0.05图5 裸鼠皮下移植瘤模型分析RBP-Jκ对肿瘤生成的影响Figure 5 Effects of RBP-Jκ silencing and over-expressing on regulation of formation and growth of nude mouse xenografts
2.4 RBP-Jκ在C57BL/6小鼠结肠癌组织中的表达
收集并检测实验组及对照组不同时间点小鼠结肠组织中RBP-Jκ蛋白及mRNA的表达。Real time PCR结果显示,在小鼠结肠癌的形成过程中,RBP-Jκ的mRNA表达逐渐升高(见图7A),并且结肠癌组织中RBP-Jκ的mRNA表达较对照组显著升高(P<0.05,见图7B)。Western blot结果显示,在小鼠结肠癌的形成过程中,RBP-Jκ的蛋白表达也逐渐升高(见图8A),并且结肠癌组织中RBP-Jκ的蛋白表达较癌旁组织显著升高(P<0.05,见图8B)。

A.小鼠肛门红肿溃烂;B.小鼠结肠内形成蕈伞样肿块;C.小鼠结肠癌组织HE染 色(×200);D.对照组小鼠结肠组织HE染色(×200)图6 AOM诱导C57BL/6小鼠结肠癌模型的构建Figure 6 The establishment of AOM-induced colon cancer in C57BL/6 mouse

与0周比较,*P<0.05与对照组比较,**P<0.01A.小鼠结肠癌诱导过程中结肠组织中RBP-Jκ的mRNA表达变化B.结肠癌模型组与对照组中RBP-Jκ mRNA表达图7 小鼠结肠组织中RBP-Jκ的mRNA表达Figure 7 The mRNA expression of RBP-Jκ in colon tissue of mice
3 讨论
结肠癌的发生是一个复杂的分子事件,涉及了多个信号通路的异常及多种抑癌基因的失活和原癌基因的激活。Notch/RBP-Jκ通路的多个分子的异常表达和结肠癌的发生发展有关[9]。Notch1的过表达可以在体外促进结肠癌细胞的增殖、克隆形成以及肿瘤球的形成,还可以在体内促进结肠癌细胞移植瘤的生长[10]。在人类结肠癌组织中,Notch1的表达与肿瘤浸润的深度、淋巴结的转移以及TNM分期正相关[5]。Notch2在结肠癌组织中常常为低表达,它和肿瘤分化有关[11]。有研究提示Notch1和Notch2在结肠癌中的表达呈负相关[12]。高表达的Notch1和低表达的Notch2都提示着结肠癌患者的不良预后。Reedijk研究组[13]报道,在临床结肠肿瘤样本中可以检测到Notch1、配体Jagged1,以及Notch途径下游分子Hes1的高水平表达。其结果提示在结肠癌的发生发展过程中,Notch通路不但表达相关分子,而且在肿瘤细胞中处于激活状态。Jubb等[14]则在70%的结肠肿瘤中检测到了Notch配体Dll4的表达,说明Notch通路在结肠癌的发生中扮演着重要角色。
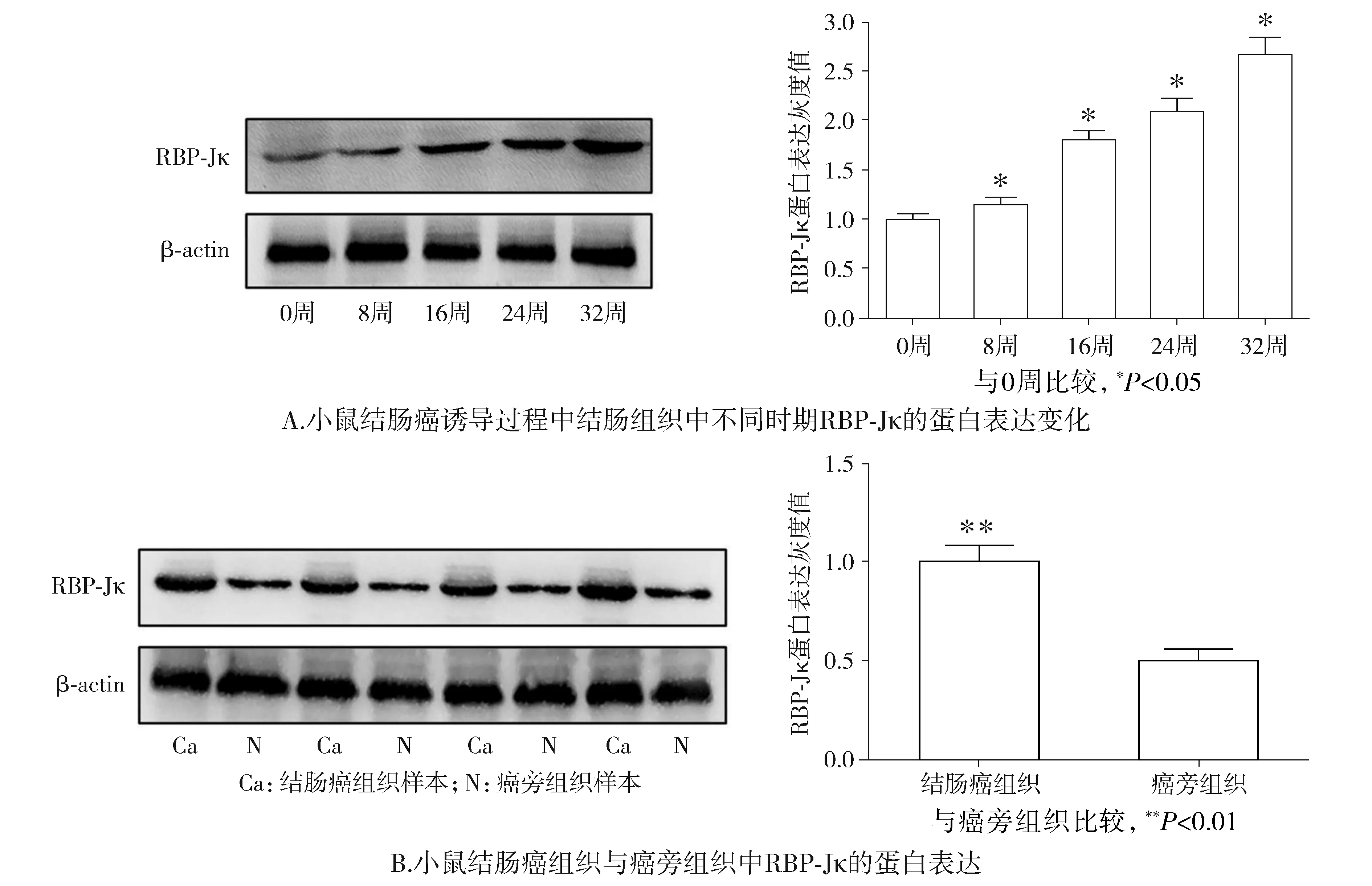
图8 小鼠结肠组织中RBP-Jκ的蛋白表达Figure 8 Protein expression of RBP-Jκ in colon tissue of mice
RBP-Jκ是Notch通路中重要的转录因子。目前,学者们已在多种不同实体瘤中检测出Notch/RBP-Jκ通路存在改变,包括乳腺癌[15]、黑色素瘤[16]、肝癌[17]和肺癌[18]。另外,EBV病毒感染[19]、T细胞淋巴瘤[20]以及神经胶质瘤[21]中亦存在Notch/RBP-Jκ的异常激活。Nagao等[22]的研究提示RBP-Jκ可以调控横纹肌肉瘤细胞的生长,抑制RBP-Jκ可能是横纹肌肉瘤患者一个有效的治疗靶点。肺癌中RBP-Jκ表达升高,抑制其表达可明显抑制肺癌细胞的增殖,其下游多个分子,包括p21、p27、CDK2、Hes1、Bcl-2以及SKP2均参与了此过程[23]。以上都说明RBP-Jκ在恶性肿瘤的发生中扮演着重要角色,但关于RBP-Jκ在结肠癌中的作用机制至今少有报道。
为探讨RBP-Jκ表达变化后对人结肠癌细胞增殖、裸鼠成瘤能力以及小鼠结肠癌形成的影响,本实验首先在结肠癌细胞中检测RBP-Jκ的mRNA和蛋白质表达,筛选出目的细胞,随后分别构建RBP-Jκ稳定过表达及稳定沉默的结肠癌细胞。MTT实验结果提示过表达或沉默RBP-Jκ后,结肠癌细胞的增殖能力发生了改变。过表达RBP-Jκ的SW480细胞的增殖能力较对照组细胞显著增高,而沉默RBP-Jκ的RKO细胞的增殖能力则较对照组显著降低。这说明RBP-Jκ可以促进人结肠癌细胞的增殖,这种促进作用随时间的延长而逐渐增强。而在构建的裸鼠皮下移植瘤模型中,过表达RBP-Jκ的SW480细胞较对照组形成肿瘤的速度快、体积大,而沉默RBP-Jκ的RKO细胞较对照组形成肿瘤的速度慢、体积小,进一步在体内实验中验证了RBP-Jκ促进结肠癌细胞生长的作用。以上均表明RBP-Jκ高表达可能促进结肠癌的生长。这也与其在其他肿瘤的相关研究报道中的结果相一致。
在结肠癌研究中,使用氧化偶氮甲烷(AOM)是小鼠结肠癌化学诱导建模的主要方法之一,本研究在成功构建AOM诱导的小鼠原位结肠癌模型后,对小鼠结肠癌组织中RBP-Jκ的表达进行了检测,结果提示在小鼠结肠癌的形成过程中RBP-Jκ的表达逐渐增多,并且小鼠结肠癌组织中的RBP-Jκ蛋白及mRNA表达显著高于其癌旁组织。提示RBP-Jκ在小鼠结肠癌的形成过程中起促进作用,但其具体的作用机制尚未明确,还有待于在今后的研究中进一步探讨。
综上所述,本研究通过体内外的初步实验为RBP-Jκ作为结肠癌治疗的新靶点之一提供了理论依据。

