甘油水溶液提取米糠多酚绿色工艺优化及多酚种类鉴定
黄 皓,王珍妮,李 莉,任国平,罗自生
甘油水溶液提取米糠多酚绿色工艺优化及多酚种类鉴定
黄 皓1,王珍妮1,李 莉1,任国平2,罗自生1※
(1. 浙江大学生物系统工程与食品科学学院,杭州 310058;2. 杭州万向职业技术学院,杭州 310023)
为探究甘油作为绿色溶剂提取米糠多酚的可行性,该文选取提取温度、甘油体积分数、液料比和提取时间4个因素,采用单因素结合响应面试验进行米糠多酚提取工艺优化。同时,分析了甘油提取液的黏度特性,并利用超高效液相色谱串联三重四级杆飞行时间质谱(UPLC-Triple-TOF/MS)方法进行多酚鉴定。结果表明,甘油提取米糠多酚最优条件为提取温度67 ℃,甘油体积分数19 %,液料比33 mL/g,提取时间固定为80 min,获得的最大多酚得率为700.35 mg/(100 g)。甘油对米糠多酚的提取效率和甘油的黏度有显著的负相关性。此外,UPLC-Triple-TOF/MS分析表明,最优条件下甘油提取得到13种米糠多酚,其中酚酸质量分数如下:对羟基苯甲酸48.53g/g,香草酸69.64g/g,丁香酸33.63g/g,4-香豆酸361.18g/g,阿魏酸392.17g/g,水杨酸34.67g/g。研究结果表明,甘油可以作为从米糠中提取多酚的绿色溶剂。
甘油;黏度;农产品;米糠;多酚;优化
0 引 言
大米是世界一半以上人口的主食,被广泛种植在世界各国[1]。米糠是稻谷脱壳后依附在糙米上的表面层,由外果皮、中果皮、交联层、种皮及糊粉层组成,约占稻谷质量的5%~7%,属于大米生产的副产物[2]。中国米糠资源量居世界之首,年产量超过1 600万t,是一种量大面广的可再生资源。米糠虽然有被用作动物饲料,但仍未得到充分利用。米糠中富含的角鲨烯、Y-谷维醇、不饱和脂肪酸、多酚等生物活性物质,在预防人体心脑血管疾病、增强机体免疫力、抗癌、预防便秘等方面具有显著的功能作用,是保健食品、医药、化工制造业的重要原料[3]。研究表明,米糠含有丰富的酚类化合物,包括阿魏酸,咖啡酸和4-香豆酸,它们具有预防癌症的潜力[4]。同时,还有研究报道了米糠中的酚酸和黄酮类化合物具有抗氧化和抗菌特性[5]。因此,关于米糠多酚类化合物的应用研究逐渐引起国内外研究人员的关注。
目前,大多数多酚化合物的提取研究采用固液提取法,重点研究提取工艺,如溶剂类型,提取温度,溶剂浓度和液料比等[6]。李欢欢等[7]采用甲醇溶液提取米糠多酚。何国庆等[8]采用丙酮溶液提取啤酒花多酚。张韦唯等[9]采用乙醇溶液提取菜籽多酚。然而,甲醇和丙酮毒性较大,乙醇价格较高且应用需要去除溶剂,这些缺点限制了它们的应用。为了克服这些缺点,需要寻找合适的替代溶剂。甘油是生产生物柴油的有机废物,由于其具有低毒性,低成本和无需去除溶剂等优点,被视为绿色溶剂,具有较好的发展前景[10]。马金立[11]采用甘油提取毛竹中的木质素。Makris[12]则报道了利用甘油提取农业或食品废料中的黄酮类化合物。但目前,还没有利用甘油提取米糠中多酚类化合物的研究报道。同时,也缺乏甘油提取效率与其黏度特性之间的相关关系研究。
本研究采用甘油作为绿色溶剂,开发了一种从米糠中提取多酚绿色方法。采用响应面法用于提取工艺(包括提取温度,甘油体积分数和液料比)的优化研究。同时,系统地研究了甘油提取效率及其黏度特性之间的相关关系,并使用UPLC-Triple-TOF/MS方法分析甘油提取物中的多酚类化合物。本研究的目的是探究甘油作为绿色溶剂的提取效率,以及科学地评价米糠多酚,为稻米副产物米糠的高值化利用提供一定的参考。
1 材料与方法
1.1 材料与试剂
米糠,2017年10月购于杭州农副产品交易市场,4 ℃,避光储藏,进行试验。
甘油、无水碳酸钠、甲酸(HPLC级)、乙腈(HPLC级)、标准品(没食子酸、阿魏酸、4-香豆酸、香草酸、对羟基苯甲酸、水杨酸和丁香酸)购于上海阿拉丁生化科技股份有限公司;福林酚试剂购于北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
BL310 电子天平,北京赛多利斯技术有限公司;METTLER TOLEDO XS105分析天平,瑞士Mettler Toledo公司;QL-861漩涡混合器,上海书培实验设备有限公司;SHY-2水浴恒温振荡器,江苏金坛市佳美仪器有限公司;TGL-16M台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;UV-5800PC紫外可见分光光度计,上海元析仪器有限公司;流变仪,德国Haake公司;AcquityTM ultra型高效液相色谱仪,美国Waters公司;Triple TOF 5600+型飞行时间质谱,配电喷雾离子源,美国AB SCIEX公司;安捷伦ZORBAX-SB C18(100 mm× 4.6 mm, 1.8m),美国Agilent Technologies公司。
1.3 试验方法
1.3.1 米糠多酚提取流程
米糠置于烘箱内,45 ℃烘干24 h,研磨,过0.25 mm筛。准确称量1.0 g米糠粉末置于50 mL离心管中。在一定梯度提取温度、甘油体积分数、液料比和时间下,采用水浴恒温振荡提取,提取时离心管密闭,提取结束后10 000 r/min,4 ℃离心15 min,收集上清液,用于后续的试验分析。
1.3.2 多酚得率测定
1)制作标准曲线
采用福林酚法测定多酚得率[13]。取0.125、0.225、0.325、0.425、0.525 mL 0.1 mg/mL的没食子酸溶液,加入0.5 mL的10 %福林酚试剂和0.5 mL蒸馏水,混匀后于暗处静置6 min。再加入1.250 mL的质量分数7%Na2CO3(后文均指质量分数)溶液和1.650、1.550、1.450、1.350、1.250 mL的蒸馏水,溶液定容至4 mL。于暗处静置90 min后在760 nm波长下测定吸光度,制作标曲。以吸光值为纵坐标,没食子酸含量为横坐标,得到多酚回归方程如下,2=0.999。
=20.03+0.096 (1)
2)测定多酚得率
取0.125 mL米糠提取上清液,加入0.5 mL的10%福林酚和0.5 mL蒸馏水,混匀后于暗处静置6 min。再加入1.250 mL的7 %Na2CO3溶液和1.650 mL的蒸馏水,溶液定容至4 mL。于暗处静置90 min后在760 nm波长下测定吸光度,测定结果代入标曲中计算,利用没食子酸当量表示多酚得率,mg/100 g,计算公式如下。

式中为提取液中多酚质量,mg,为米糠质量,100 g。
3)甘油提取液黏度测定
根据文献报道的方法[14],测定不同条件下的甘油提取液的黏度。采用流变仪在25 ℃下进行测定黏度,剪切速率为0.1 s-1。通过SPSS软件进行黏度与多酚得率的相关性分析。
1.3.3 单因素试验
1)提取温度
准确称量1.0 g米糠粉末置于50 mL离心管中。在甘油体积分数15%,液料比20 mL/g,提取时间90 min的条件下,采用40、50、60、70 ℃的温度提取,测定多酚得率。
2)甘油体积分数
准确称量1.0 g米糠粉末置于50 mL离心管中。在提取温度50 ℃,液料比20 mL/g,提取时间90 min的条件下,采用10%、15%、20%、35%、70%的甘油体积分数提取,测定多酚得率。
3)液料比
准确称量1.0 g米糠粉末置于50 mL离心管中。在提取温度50 ℃,甘油体积分数15%,提取时间90 min的条件下,采用10、20、30、40 mL/g的液料比提取,测定多酚得率。
4)提取时间
准确称量1.0 g米糠粉末置于50 mL离心管中。在提取温度50 ℃,甘油体积分数15%,液料比20 mL/g的条件下,采用40、60、80、100、120 min的时间提取,测定多酚得率。
1.3.4 响应面优化试验
依据单因素试验结果,固定提取时间80 min,采用三因素三水平的Box-Behnken 试验设计方法设计试验[15]。试验设计、回归和图形分析采用Design-Expert 8.0.6软件进行。试验因素、水平以及响应值如表1所示。

表1 Box-Behnken试验设计
1.3.5 UPLC-Triple-TOF/MS分析
采用文献报道的方法,略有修改[16]。
1)液相条件:
流动相A:0.1 %甲酸溶液,B:0.1 %甲酸乙腈溶液;流速:0.8 mL/min;检测波长:280 nm;色谱柱:安捷伦ZORBAX-SB C18(100 mm×4.6 mm, 1.8m);进样量:5L;柱温:30 ℃。
梯度洗脱程序如表2所示。

表2 梯度洗脱条件
2)质谱条件:
质谱条件 UPLC-Triple-TOF 5600+飞行时间液质联用仪:负离子扫描模式;扫描范围:质核比(/) 100~1500;雾化气(GS1):0.35 MPa;雾化气(GS2):0.35 MPa;气帘气(CUR):0.24 MPa;离子源温度(TEM):550 ℃;离子源电压(IS):-4 500 V;一级扫描:去簇电压(DP):100 V;聚焦电压(CE):10 V;二级扫描:使用TOF MS~Product Ion~IDA模式采集质谱数据,CID能量为20、40和60 V,进样前,用CDS泵做质量轴校正,使质量轴误差小于0.000 2%。
1.4 数据分析
数据统计分析采用SPSS 20软件进行,各指标测定均重复3次,所得试验数据均以平均值±标准方差来表示。采用方差分析(ANOVA)进行显著性分析,<0.05表示显著差异。运用Origin 9.0软件进行作图。
2 结果与分析
2.1 米糠多酚提取单因素试验
如图1a所示,随着提取温度从40 ℃升高到60 ℃,多酚得率增加,但是当温度达到70 ℃,多酚得率下降。这是由于较高的温度使植物细胞壁透性增加[17],同时高温也增加了多酚的溶解度和扩散性[18]。但是过高的温度会使得热敏性多酚降解,导致多酚得率下降[19-20]。
如图1b所示,随着甘油体积分数从10%增加到15%,多酚得率增加,而随着体积分数增加至70%,多酚得率逐渐降低。甘油溶液的极性随甘油体积分数的变化而变化,导致酚类化合物的溶解度不同,使得多酚得率发生变化[21]。此外,过高的甘油体积分数可能导致过高的黏度,影响多酚提取效率。
如图1c所示,当液料比从10 mL/g增加到30 mL/g时,多酚得率增加,这是由于随着液料比的增加样品和溶剂之间的接触面积增大,更多的多酚可以溶解在溶剂中[22]。但是,当液料比继续增加,多酚得率则有所下降。这是因为当液料比过大,样品中的大量杂质也被溶解,最终阻碍了多酚的提取[23]。
图1d表明,提取时间的变化对于多酚得率的影响并不显著(>0.05)。
基于上述结果,固定提取时间为80 min,选取提取温度为50、60、70 ℃,甘油体积分数为10%、15%、20%,液料比为20、30、40 mL/g,用于米糠多酚提取条件的响应面优化试验设计。

注:图1a中甘油体积分数15%,料液比20 mL·g-1,提取时间90 min;图1b中提取温度50 ℃,料液比20 mL·g-1,提取时间90 min;图1c中提取温度50 ℃,甘油体积分数15%,提取时间90 min;图1d中提取温度50 ℃,甘油体积分数15%,料液比20 mL·g-1。
2.2 米糠多酚提取响应面优化试验
Box-Behnken试验结果如表3所示。
利用Design-Expert 8.0.6软件对试验结果进行多元回归拟合,多酚得率的回归模型方程(3)。
=673.37+37.481+28.542+10.623+19.6912− 0.5713+10.8123−39.5112−25.1622−28.2032(3)
式中为多酚得率,mg/(100 g);1为提取温度,℃;2为甘油体积分数,%;3为液料比,mL/g。
对响应面模型的方差分析如表4所示。模型的值<0.001,说明该拟合模型极显著。而失拟项值为0.083(>0.05),失拟检验不显著,表明试验结果和该模型拟合度高,该模型能较好地预测米糠多酚的提取效果[24]。各个因素对米糠多酚得率的影响程度为:提取温度>甘油体积分数>液料比。提取温度和甘油体积分数的交互作用对多酚得率的影响显著。而3个因素的二次项均达到了显著水平。
回归模型的决定系数2=0.978,调整决定系数2Adj=0.950,说明该模型的拟合程度较好,可以利用该模型对甘油体系提取米糠多酚进行分析及预测。变异系数为1.67%,表明试验的重复性好,试验结果可靠[25]。综上所述,可以采用该模型的试验结果进行分析,确定甘油提取米糠多酚的最优参数条件。
图2a表示提取温度和甘油体积分数的交互作用对多酚得率的影响。多酚得率随着提取温度和甘油体积分数的增大而增大,达到中心点后开始下降。图2b表示提取温度和液料比的交互作用对多酚得率的影响。多酚得率随着提取温度和液料比的增大而增大,达到最大值后变为下降。图2c表示甘油体积分数和液料比的交互作用对多酚得率的影响,随着甘油体积分数的增大,多酚得率先增加后下降,液料比对多酚得率的影响也表现为此趋势。从图中等高线密度可以看出,提取温度的等高线密度最大,其次是甘油体积分数,液料比的等高线密度最小,表明提取温度对多酚得率的影响最大,其次为甘油体积分数,液料比的影响最小。
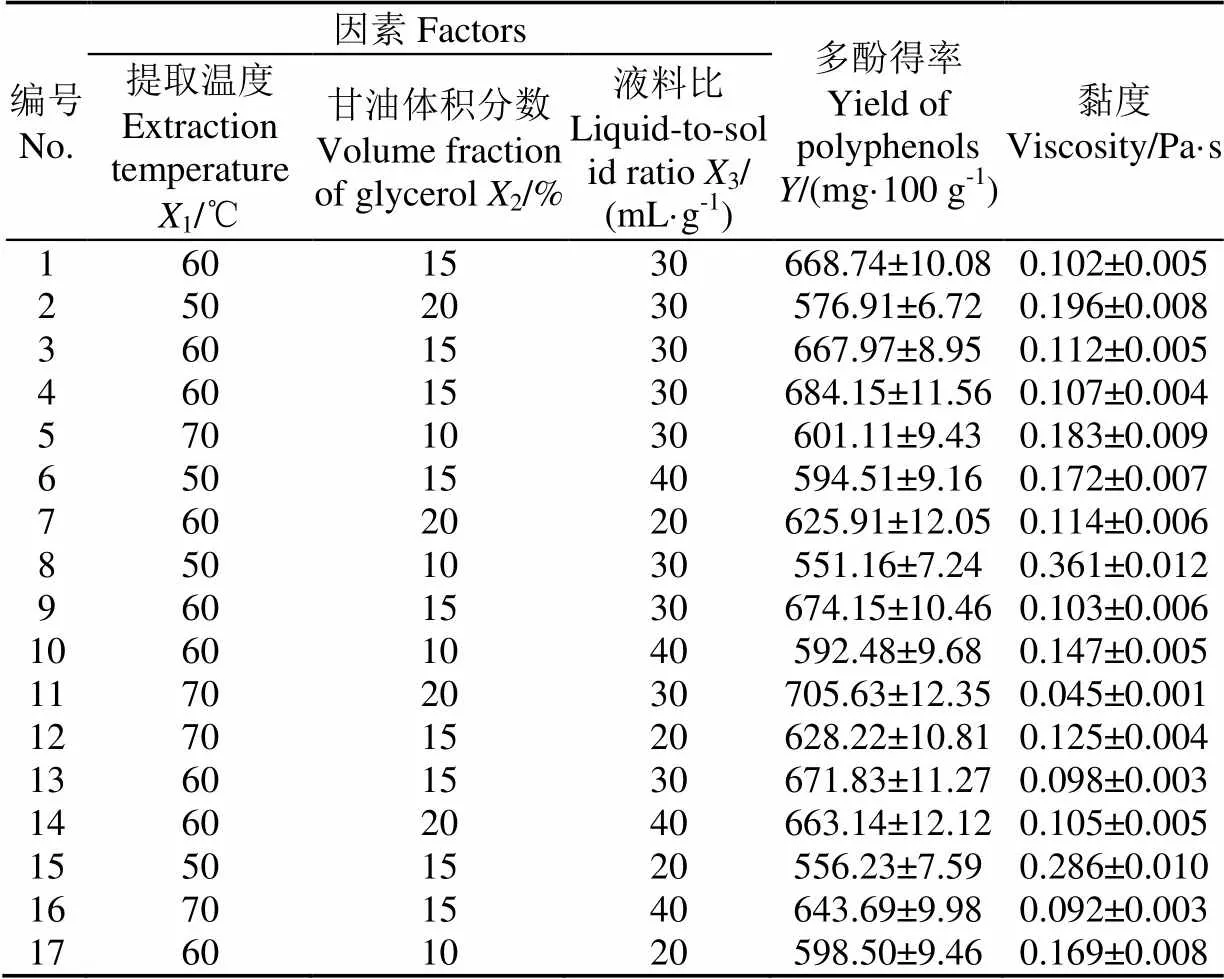
表3 Box-Behnken试验设计及响应值

表4 响应面模型方差分析
注:* 差异显著,<0.05;** 差异高度显著,<0.01;*** 差异极显著,<0.001。
Note: * significant difference,<0.05; ** highly significant difference,<0.01; *** extremely significant difference,<0.001.

图2 提取温度和甘油体积分数,提取温度和液料比,甘油体积分数和液料比等因素交互作用对多酚得率的影响
2.3 最优提取条件的确定与验证
通过Design-Expert 8.0.6软件分析得到米糠多酚的最优提取条件为提取温度67 ℃,甘油体积分数19 %,液料比33 mL/g。在最优提取条件下,理论预测的米糠多酚得率为700.35 mg/100 g。采用最优提取条件,进行3次平行试验,验证预测多酚得率的可靠性。结果显示多酚得率为(708.58±12.36)mg/100 g,与理论值相比,相对误差为1.10%,说明该模型可以较好的预测甘油提取米糠多酚的得率,从而证明优化的提取条件可靠。
2.4 甘油提取液的黏度对多酚得率的影响
如表1所示,甘油提取液的黏度随着提取条件的变化而变化。表5显示甘油黏度与多酚得率相关系数。随着甘油提取液黏度增加,多酚得率显著下降,甘油黏度和多酚得率之间呈显著的负相关关系,负相关系数为−0.879(<0.01)。该结果表明甘油的提取能力可能受到其高黏度的限制,过高的黏度会对物质的传导造成障碍。Duan等[26]报道了溶剂的黏度会影响传质,进而影响提取能力,这与本研究结果相符。甘油溶液中具有随机位置和大小的移动空洞,如果孔的大小等于或大于其相邻分子的大小,则分子能够移动。在加热提取过程中,溶液中分子的振动引起分子重排,导致黏度降低[27]。Zhao等[28]在低共熔溶剂上也发现了类似的变化规律。

表5 甘油黏度与多酚得率的相关系数
2.5 UPLC-Triple-TOF/MS分析
在甘油提取物中发现了13种多酚化合物。将化合物的质谱数据与文献质谱数据库进行比对,鉴定出的多酚化合物列于表6中[29-31]。米糠中常见的多酚化合物,包括对羟基苯甲酸、香草酸、丁香酸、阿魏酸、4-香豆酸和水杨酸均可在甘油提取物中检测到[32]。Laokuldilok等[33]采用甲醇从米糠中提取得到6种酚类化合物,分别为没食子酸、原儿茶酸、对羟基苯甲酸、4-香豆酸、阿魏酸和芥子酸。Sunan等[34]采用乙醇从米糠中提取得到最主要的酚类化合物为阿魏酸、4-香豆酸和香草酸。试验结果证实甘油/水体系具有选择差异性,在甘油提取液中的多酚化合物种类比用甲醇、乙醇或丙酮提取的多,其中4-(-D-吡喃葡萄糖氧基)水杨酸、阿魏酸-4-O--D-吡喃葡萄糖苷、4-O-咖啡酰氧基-葡萄糖苷、6′-O-阿魏酰蔗糖、1-O-(E)-咖啡酰氧基--D-龙胆二糖、丁香酸葡萄糖苷、6-O-芥子酰基蔗糖均为新报道的酚类化合物。相关研究也报道了与乙醇提取物相比,在甘油提取物中观察到更多种类的多酚化合物[35-36],与本研究结果保持一致。
由于米糠中的酚酸占水稻中总酚酸的70%至90%,故采用UPLC对质谱鉴定得到的6种酚酸进行定量测定[37]。图3显示了米糠甘油提取物中6种酚酸的UPLC色谱图,酚酸含量如下:对羟基苯甲酸48.53g/g,香草酸69.64g/g,丁香酸33.63g/g,4-香豆酸361.18g/g,阿魏酸392.17g/g和水杨酸34.67g/g。相比之下,Wanyo等[38]也使用蒸馏水从米糠中提取到阿魏酸11.04g/g,4-香豆酸3.05g/g和香草酸4.18g/g,提取效率远低于我们的研究。而提取效率的差异是由于甘油的存在。米糠甘油提取物中的酚酸以阿魏酸和4-香豆酸为主,其中6种酚酸占80 %以上,其次是香草酸,对羟基苯甲酸,水杨酸和丁香酸。先前的研究工作也报道了阿魏酸,4-香豆酸和香草酸是米糠中主要的酚酸,与本研究结果一致[34]。

表6 UPLC-Triple-TOF/MS鉴定甘油提取物中的酚类化合物

1.对羟基苯甲酸 2.香草酸 3.丁香酸 4.4-香豆酸 5.阿魏酸 6.水杨酸
3 结 论
本研究表明,甘油可以用作绿色溶剂,用于从稻米副产品米糠中提取多酚类化合物。响应面优化的最优提取条件为提取温度67 ℃,甘油体积分数19%,液料比33 mL/g,能得到的最大多酚得率为700.35 mg/(100 g),此时甘油的黏度最低,为0.040Pa·s。甘油的提取效率与黏度显著相关,甘油的高黏度会阻碍其提取能力。本研究利用空洞理论解释了甘油黏度变化规律。
通过UPLC-Triple-TOF/MS分析,于甘油提取液中鉴定出13种多酚化合物,并且通过UPLC定量了6种主要的酚酸,有助于水稻副产物米糠的高值化利用。与甲醇相比,作为绿色溶剂的甘油毒性较小,并且价格低于乙醇。因此,甘油可以作为甲醇和乙醇的理想替代品。此外,由于甘油是一些食品、化妆品和药品中的基本配料,使用甘油作为提取溶剂提取多酚类化合物不仅可以将多酚类化合物更直接地应用于食品、化妆品和制药行业,而且可以减少溶剂废物对环境的不良影响。综上所述,甘油适用于米糠多酚类化合物的绿色提取。
本研究首次采用甘油进行米糠多酚的提取,探究甘油作为米糠多酚提取溶剂的可行性,因此在试验设计方面主要考察了单次提取对多酚得率的影响。如果期望获得更高的多酚得率,可以适当增加提取次数,但需要兼顾提取的成本。此外,可以对提取物多酚的纯度进行考察,研究提取物后续的纯化方法,以完善系统的多酚提取工艺。
[1] Sohail M, Rakha A, Butt M S, et al. Rice bran nutraceutics: A comprehensive review[J]. Critical Reviews in Food Science & Nutrition, 2017, 57(17): 3771-3780.
[2] 李富华,郭晓晖,夏春燕,等. 全谷物酚类化合物抗氧化活性研究进展[J]. 食品科学,2012,33(13):299-304.
Li Fuhua, Guo Xiaohui, Xia Chunyan, et al. Research advance in antioxidant activity of phenolic compounds in whole grains[J]. Food Science, 2012, 33(13): 299-304. (in Chinese with English abstract)
[3] 陈中伟,赵芳芳,丁芬,等. 亚临界丙烷萃取米糠油及其微量活性组分动力学模型[J]. 农业工程学报,2016,32(19):280-286.
Chen Zhongwei, Zhao Fangfang, Ding Fen, et al. Extraction kinetics of rice bran oil and its minor bioactive compounds from rice bran by subcritical propane[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(19): 280-286. (in Chinese with English abstract)
[4] Henderson A J, Ollila C A, Kumar A, et al. Chemopreventive properties of dietary rice bran: Current status and future prospects[J]. Advances in Nutrition, 2012, 3(5): 643-653.
[5] Park H Y, Lee K W, Choi H D. Rice bran constituents: immunomodulatory and therapeutic activities[J]. Food & Function, 2017, 8(3): 935-943.
[6] Baiano A, Del Nobile M A. Antioxidant compounds from vegetable matrices: Biosynthesis, occurrence, and extraction systems[J]. Critical Reviews in Food Science and Nutrition, 2015, 56(12): 2053-2068.
[7] 李欢欢,吴娜娜,谭斌,等. 黑米米糠游离酚对碘与淀粉结合及淀粉消化的影响[J]. 食品科学技术学报,2017,35(5):18-24.
Li Huanhuan, Wu Nana, Tan Bin, et al. Effects of free phenol from black rice bran on combination of iodine and starch and starch digestion[J]. Journal of Food Science and Technology, 2017, 35(5): 18-24. (in Chinese with English abstract)
[8] 何国庆,熊皓平,阮晖,等. 啤酒花多酚类化合物提取工艺的优化研究[J]. 农业工程学报,2005,21(4):163-166.
He Guoqing, Xiong Haoping, Ruan Hui, et al. Optimization of condition for extracting polyphenols from[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2005, 21(4): 163-166. (in Chinese with English abstract)
[9] 张韦唯,代春华,熊锋,等. 菜籽蛋白加工废液中多酚和多糖同步提取工艺优化[J]. 农业工程学报,2017,33(7):302-309.
Zhang Weiwei, Dai Chunhua, Xiong Feng, et al. Extraction processing optimization of polyphenols and polysaccharides from rapeseed protein processing waste liquor[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(7): 302-309. (in Chinese with English abstract)
[10] Gu Y, Jerome F. Glycerol as a sustainable solvent for green chemistry[J]. Green Chemistry, 2010, 12(7): 1127-1138.
[11] 马金立. 甘油提取毛竹木质素及固体酸催化木质素醇解规律研究[D]. 南昌:南昌大学,2012.
Ma Jinli. Study of Glycerol Extracting Lignin from Bamboo and the Solid Acid Catalyzed Alcoholysis[D]. Nanchang: Nanchang University, 2012. (in Chinese with English abstract)
[12] Makris D. Kinetics of ultrasound-assisted flavonoid extraction from agri-food solid wastes using water/glycerol mixtures[J]. Resources, 2016, 5(1): 1—10.
[13] 董亚婷,杨远帆,倪辉,等. 茶花粉酶法破壁工艺提高提取物抗氧化活性及多酚含量[J]. 农业工程学报,2013,29(21):288-294.
Dong Yating, Yang Yuanfan, Ni Hui, et al. Enzymatic cell wall disruption process improves antioxidant activity and polyphenol content of camellia pollen extracts[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(21): 288-294. (in Chinese with English abstract)
[14] Marták J, Štefan Schlosser. Density, viscosity, and structure of equilibrium solvent phases in butyric acid extraction by phosphonium ionic liquid[J]. Journal of Chemical & Engineering Data, 2017, 62(10): 3025-3035.
[15] 黎英,陈雪梅,严月萍,等. 超声波辅助酶法提取红腰豆多糖工艺优化[J]. 农业工程学报,2015,31(15):293-301.
Li Ying, Chen Xuemei, Yan Yueping, et al. Optimal extraction technology of polysaccharides from red kindey bean using ultrasonic assistant with enzyme[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(15): 293-301. (in Chinese with English abstract)
[16] Zeng F, Ge Z, Limwachiranon J, et al. Antioxidant and tyrosinase inhibitory activity of Rosa roxburghii fruit and identification of main bioactive phytochemicals by UPLC-Triple-TOF/MS[J]. International Journal of Food Science & Technology, 2017, 52(4): 897-905.
[17] Yuan B, Lu M, Eskridge K M, et al. Extraction, identification, and quantification of antioxidant phenolics from hazelnut () shells[J]. Food Chemistry, 2017, 244: 7-15.
[18] 卢晓霆,王田田,王军. 响应面法优化葡萄籽多酚提取工艺[J]. 食品工业科技,2013,34(24):279-283.
Lu Xiaoting, Wang Tiantian, Wang Jun. Optimization of extraction of polyphenols from grape seeds by response surface methodology[J]. Science and Technology of Food Industry, 2013, 34(24): 279-283. (in Chinese with English abstract)
[19] Ghafoor K, Choi Y H, Jeon J Y, et al. Optimization of ultrasound-assisted extraction of phenolic compounds, antioxidants, and anthocyanins from grape () seeds[J]. Journal of Agricultural & Food Chemistry, 2009, 57(11): 4988-4994.
[20] 令博,王捷,吴洪斌. 葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J]. 食品科学,2011,32(18):24-29.
Ling Bo, Wang Jie, Wu Hongbin. Polyphenols from grape skin: optimization of ultrasonic-assisted extraction process by response surface methodology and antioxidant activity evaluation[J]. Food Science, 2011, 32(18): 24-29. (in Chinese with English abstract)
[21] Kossah R, Nsabimana C, Zhang H, et al. Optimization of extraction of polyphenols from Syrian sumac () and Chinese sumac () fruits.[J]. Research Journal of Phytochemistry, 2010, 4(3): 146—153.
[22] 段玉清,张海晖,李金凤,等. 脉冲超声辅助提取莲房多酚的工艺[J]. 农业工程学报,2009,25(增刊1):193—197.
Duan Yuqing, Zhang Haihui, Li Jinfeng, et al. Technology for extracting polyphenols from lotus seedpod by pulsed ultrasonic assisted method[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2009, 25(Supp.1): 193-197. (in Chinese with English abstract)
[23] 张艳霞,朱彩平,邓红,等. 超声辅助双水相提取石榴皮多酚[J]. 食品与发酵工业,2016,42(12):150-156.
Zhang Yanxia, Zhu Caiping, Deng Hong, et al. Optimization of ultrasound assisted aqueous two-phase extraction of polyphenols from pomegranate peel by response surface methodology[J]. Food and Fermentation Industries, 2016, 42(12): 150-156. (in Chinese with English abstract)
[24] 鲍涛,王冶,孙崇德,等. 黑苦荞米黄酮提取工艺优化及其降血糖活性研究[J]. 农业工程学报,2016,32(增刊2):383-389.
Bao Tao, Wang Ye, Sun Chongde, et al. Optimization of flavonoids extraction from Tartary buckwheat rice and analysis of its hypoglycemic activity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(Supp.2): 383-389. (in Chinese with English abstract)
[25] 朱文学,焦昆鹏,罗磊,等. 绿豆皮黄酮的超声波辅助水提工艺优化及抗氧化活性[J]. 食品科学,2015,36(16):12-17.
Zhu Wenxue, Jiao Kunpeng, Luo Lei, et al. Optimization of ultrasonic-assisted extraction and antioxidative activities of total flavonoids from mung bean () hull[J]. Food Science, 2015, 36(16): 12-17. (in Chinese with English abstract)
[26] Duan L, Dou L L, Guo L, et al. Comprehensive evaluation of deep eutectic solvents in extraction of bioactive natural products[J]. Acs Sustainable Chemistry & Engineering, 2016, 4(4): 2405-2411.
[27] Abbott A P, Glen C, Davies D L, et al. Ionic liquid analogues formed from hydrated metal salts[J]. Chemistry-A European Journal, 2010, 10(15): 3769-3774.
[28] Zhao B Y, Xu P, Yang F X, et al. Biocompatible deep eutectic solvents based on choline chloride: Characterization and application to the extraction of rutin from[J]. Acs Sustainable Chemistry & Engineering, 2015, 3(11): 2746-2755.
[29] Zhang K X, Wang Y S, Jing W G, et al. Improved quality control method for prescriptions ofthrough simultaneous determination of nine major constituents by HPLC coupled with triple quadruple mass spectrometry[J]. Molecules, 2013, 18(10): 11824-11835.
[30] Wei Z, Luo J, Huang Y, et al. Profile of polyphenol compounds of five muscadine grapes cultivated in the United States and in newly adapted locations in China[J]. International Journal of Molecular Sciences, 2017, 18(3): 631.
[31] Multari S, Pihlava J M, Ollennuchuasam P, et al. Identification and quantification of avenanthramides and free and bound phenolic acids in eight cultivars of husked oat (.) from Finland[J]. Journal of Agricultural & Food Chemistry, 2018, 66(11): 2900-2908.
[32] Das A B, Goud V V, Das C. Extraction of phenolic compounds and anthocyanin from black and purple rice bran () using ultrasound: A comparative analysis and phytochemical profiling[J]. Industrial Crops & Products, 2017, 95: 332-341.
[33] Laokuldilok T, Shoemaker C F, Jongkaewwattana S, et al. Antioxidants and antioxidant activity of several pigmented rice brans[J]. Journal of Agricultural & Food Chemistry, 2011, 59(1): 193-199.
[34] Sunan B, Sirithon S. Antioxidant capacities and phenolic compounds of the husk, bran and endosperm of Thai rice[J]. Food Chemistry, 2010, 119(2): 606-613.
[35] Apostolakis A, Grigorakis S, Makris D P. Optimisation and comparative kinetics study of polyphenol extraction from olive leaves () using heated water/glycerol mixtures[J]. Separation & Purification Technology, 2014, 128(325): 89-95.
[36] Philippi K, Tsamandouras N, Grigorakis S, et al. Ultrasound-assisted green extraction of eggplant peel () polyphenols using aqueous mixtures of glycerol and ethanol: optimisation and kinetics[J]. Environmental Processes, 2016, 3(2): 369-386.
[37] Hung P V. Phenolic compounds of cereals and their antioxidant capacity[J]. Critical Reviews in Food Science & Nutrition, 2016, 56(1): 25-35.
[38] Wanyo P, Meeso N, Siriamornpun S. Effects of different treatments on the antioxidant properties and phenolic compounds of rice bran and rice husk[J]. Food Chemistry, 2014, 157(157): 457-463.
Optimization of green extraction process and identification of polyphenols variety from rice bran using glycerol/water system
Huang Hao1, Wang Zhenni1, Li Li1, Ren Guoping2, Luo Zisheng1※
(1.310058; 2.,310023,)
During rice-milling process, rice bran is produced as one kind of byproduct with high contents of polyphenols. Although there is a huge amount of rice bran in China, most of it is used to feed animals. Therefore, it is inevitable to fully explore the additional value of rice bran for the economic benefit of rice processing industry. Rice bran can be used for extraction of polyphenols. Conventional solvents are methanol, acetone and ethanol, which exhibit some disadvantages. To overcome these disadvantages, we need to find a suitable solvent to replace conventional solvents. Glycerol is one kind of colorless, odorless, viscous liquid, which is sweet-tasting and non-toxic. It is widely applied in the food and pharmaceutical industry. Glycerol might be a potential alternative for green extraction of polyphenols from rice bran. Thus, in our research, a green extraction process of polyphenols from rice bran using glycerol was studied. Four individual factors including extraction temperature, volume fraction of glycerol, liquid-to-solid ratio and extraction time were chosen, and single-factor experiments combined with response surface methodology (RSM) were applied for optimization of the extraction process. The relationship between extraction efficiency of glycerol and its viscosity, the physical property, was analyzed and a UPLC-Triple-TOF/MS method was also conducted for identification of polyphenols. Results showed the order of independent factors affecting the yield of polyphenols was as follows: extraction temperature> volume fraction of glycerol>liquid-to-solid ratio. The ANOVA analysis revealed that independent factors (extraction temperature, volume fraction of glycerol and liquid-to-solid ratio), interaction effect (extraction temperature and volume fraction of glycerol) and their quadratic terms significantly influenced the yield of polyphenols (<0.05). The optimum conditions were extraction temperature at 67 ℃, volume fraction of glycerol at 19 %, liquid-to-solid ratio at 33 mL/gand extraction time fixed at 80 min. Under the optimal conditions, the maximum yield of polyphenols was 700.35 mg/100 g. There is a significantly negative correlation between extraction efficiency of glycerol and its viscosity. During extraction processes, the viscosity of glycerol changed as extraction conditions changed. As the viscosity increased there was a significant decrease in yield of polyphenols, with significant negative correlation coefficient value of -0.878 9 (<0.01). Under the optimal conditions, there were thirteen phenolic compounds identified in the glycerol extract according to UPLC-Triple-TOF/MS analysis. The quantification of all the six phenolic acids was conducted by UPLC. The contents of phenolic acids were as follows: 4-hydroxybenzoic acid (48.53g/g), vanillic acid (69.64g/g), syringic acid (33.63g/g), 4-coumaric acid (361.18g/g), ferulic acid (392.17g/g), and salicylic acid (34.67g/g), which significantly enhanced the value of rice bran.
glycerol; viscosity; agricultural products; rice bran; polyphenols; optimization
黄 皓,王珍妮,李 莉,任国平,罗自生.甘油水溶液提取米糠多酚绿色工艺优化及多酚种类鉴定[J]. 农业工程学报,2019,35(4):305-312.doi:10.11975/j.issn.1002-6819.2019.04.038 http://www.tcsae.org
Huang Hao, Wang Zhenni, Li Li, Ren Guoping, Luo Zisheng. Optimization of green extraction process and identification of polyphenols variety from rice bran using glycerol/water system[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(4): 305-312. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.04.038 http://www.tcsae.org
2018-09-23
2019-02-21
浙江科技重点研发计划项目(2018C02049);杭州科技重点研发计划项目(20170432B24)
黄 皓,博士生,研究方向为食品科学。 Email:qyhuanghao@zju.edu.cn
罗自生,教授,博士,研究方向为食品科学。 Email:luozisheng@zju.edu.cn
10.11975/j.issn.1002-6819.2019.04.038
TS206.4
A
1002-6819(2019)-04-0305-08

